MADDENN YAPISI ve ZELLKLER Atomun Yaps Mustafa ELK





















- Slides: 25

MADDENİN YAPISI ve ÖZELLİKLERİ Atomun Yapısı Mustafa ÇELİK

Atomun Yapısı Parçacıklarım �Elementtir adım, �Her yerde aynıdır yapım. �Etkileşince atomlarım, �Bütün gibi görünür yapım. �Peki atomlarımın �Var mıdır küçük parçacıkları? �Anlamak isterseniz bu gerçeği, �Kumaşa sürtün beni. �Dışardan olunca etki, �Hemen belli ederim kendimi, �Düşünün nasıl elektriklendiğimi.

�Cam bilyeyi ipek kumaşa sürttüğümüzde cam bilyenin atomları ile kumaşın atomları arasında parçacık alışverişi gerçekleşmiştir. Diğer bir ifade ile cam bilyeyi oluşturan atomların parçacıklarının bir kısmı ipek kumaşa geçmiştir. �Yün kumaşı oluşturan atomların parçacıklarının çok az bir kısmı ise balona geçmiştir. �Atomu oluşturan bu parçacıklar proton, nötron ve elektronlardır.

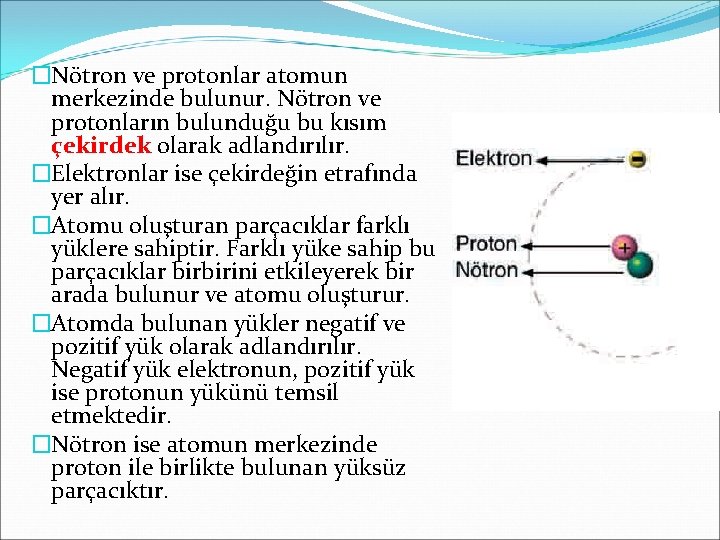
�Nötron ve protonlar atomun merkezinde bulunur. Nötron ve protonların bulunduğu bu kısım çekirdek olarak adlandırılır. �Elektronlar ise çekirdeğin etrafında yer alır. �Atomu oluşturan parçacıklar farklı yüklere sahiptir. Farklı yüke sahip bu parçacıklar birbirini etkileyerek bir arada bulunur ve atomu oluşturur. �Atomda bulunan yükler negatif ve pozitif yük olarak adlandırılır. Negatif yük elektronun, pozitif yük ise protonun yükünü temsil etmektedir. �Nötron ise atomun merkezinde proton ile birlikte bulunan yüksüz parçacıktır.

�Belirli sayılarda proton, nötron ve elektronlar farklı konumlarda bir arada bulunarak atomları oluşturur. Atomu oluşturan bu parçacıkların arasında da sadece boşluk vardır.

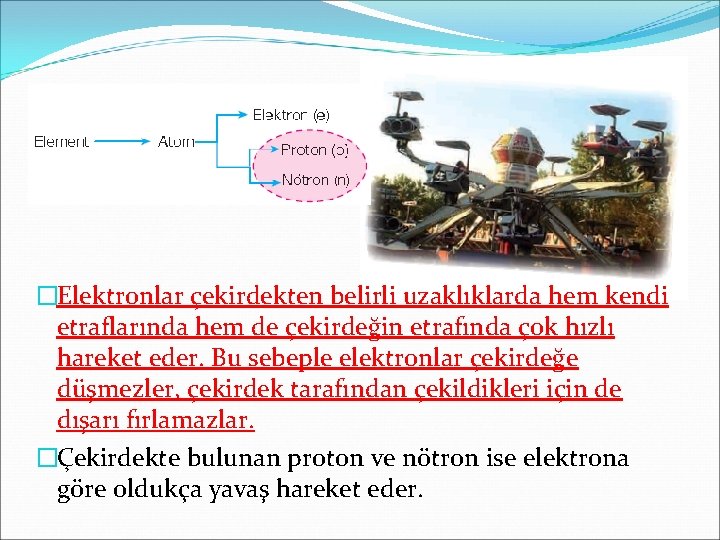
�Elektronlar çekirdekten belirli uzaklıklarda hem kendi etraflarında hem de çekirdeğin etrafında çok hızlı hareket eder. Bu sebeple elektronlar çekirdeğe düşmezler, çekirdek tarafından çekildikleri için de dışarı fırlamazlar. �Çekirdekte bulunan proton ve nötron ise elektrona göre oldukça yavaş hareket eder.

�Şekilde, atomu oluşturan farklı yüklere sahip parçacıklar arasındaki çekme kuvveti gösterilmiştir.

�Atomun çekirdeğinde bulunan proton ve nötronun kütlesi hemen birbirine eşittir. Elektronun kütlesi ise proton ve nötronun kütlesinden çok daha küçüktür. �Protonun veya nötronun kütlesi, elektronun kütlesinin yaklaşık olarak 2000 katı kadardır. Bu durumda atomun kütlesinin yaklaşık olarak proton ve nötron kütleleri toplamıdır.

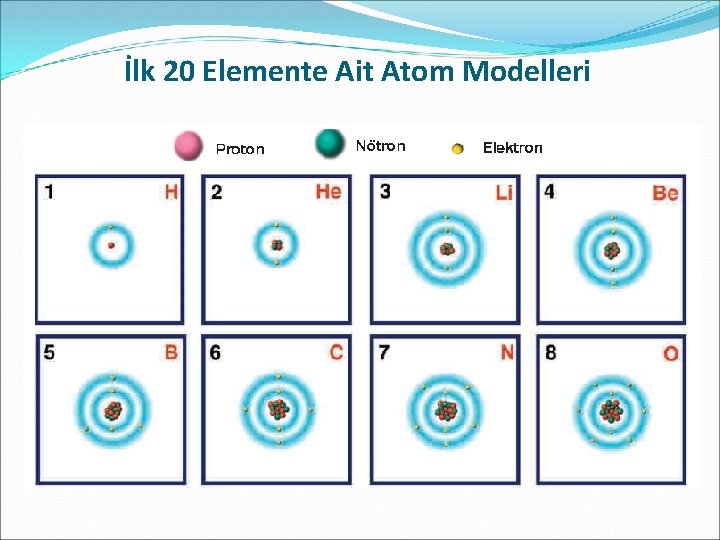
�Aynı atomda bulunan elektronlar çekirdekten farklı uzaklıklarda bulunur. �Elektronların ortalama olarak bulunduğu mavi renk ile gösterilen bölgeler katman olarak adlandırılır. Atomlar birden fazla katmana sahip olabilir. Gerçekte atomun yapısında modelde gösterildiği gibi katman bulunmaz. Fakat elektronların konumunu daha kolay açıklayabilmek için katman, modelde mavi bölgelerle gösterilmiştir. Katmanlar, çizimlerde gösterildiği gibi düz bir zemin değildir. Çekirdeğin çevresini tamamen saran küresel bir yapıya sahiptir.

�Atomlarda birden fazla sayıda katman bulunabilir ve katmanlardaki elektron sayısı farklı olabilir. Ancak ilk katmanda en fazla iki elektron bulunabilir. �İkinci ve üçüncü katmanlarda bulunabilecek elektron sayısı sekizi geçemez. �Elektronlar öncelikle çekirdeğe en yakın katmanda bulunur. İkinci katmanda sekiz elektron yer aldıktan sonra elektronlar üçüncü katmana yerleşir.

İlk 20 Elemente Ait Atom Modelleri

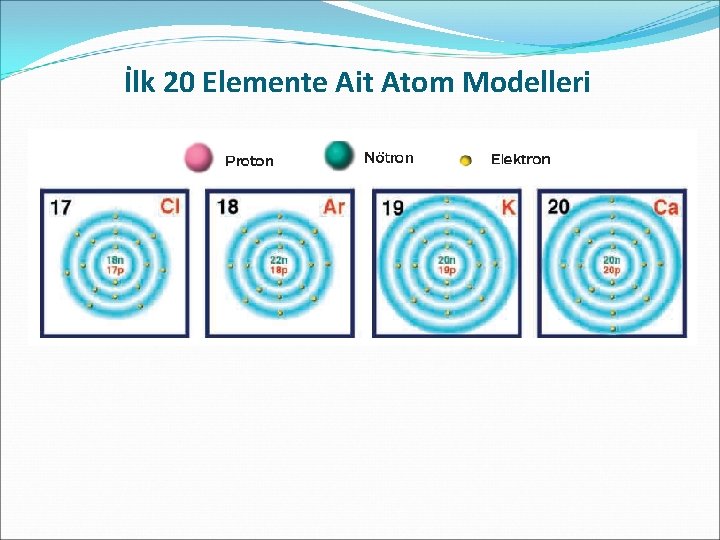
İlk 20 Elemente Ait Atom Modelleri

İlk 20 Elemente Ait Atom Modelleri

�Elementlere ait atomların proton ve elektron sayıları birbirine eşit olduğu için atomlar nötr yapıdadır �Atomun nötr olması atomda bulunan negatif yüklerin sayısının pozitif yüklerin sayısına eşit olması demektir. �Diğer bir ifade ile elektron negatif yüklü, proton pozitif yüklü olduğu için elektron ve proton sayılarının eşit olması atomun nötr olduğunu gösterir.

�Bir elementin atomunun diğer elementin atomundan farklı olması çekirdekte bulunan proton sayısına bağlıdır. �Örneğin, hidrojen atomunun çekirdeğinde bir proton bulunmasına karşılık, azot atomunun çekirdeğinde yedi proton bulunmaktadır. Bu sebeple hidrojen atomu, azot atomundan farklıdır. �Farklı elementlerin atomları aynı sayıda elektron veya nötron içerebilir. Ancak farklı atomların proton sayıları hiçbir zaman aynı olamaz. Bu sebeple atomda bulunan protonların sayısı, o elementin kimliğini belirler. �Nötr atomlarda elektron sayısı proton sayısına bağlı olduğu için proton sayısı kadar elektron bulunur.

�Bir elementin tüm atomlarının çekirdeğinde aynı sayıda proton bulunur. Fakat aynı elementin tüm atomlarının nötron sayıları birbirinden farklı olabilir. �Proton sayısının farklı olması ise elementin farklı olması demektir. �Proton sayısı elementin kimliğini belirlediği için proton sayısı atom numarası olarak adlandırılmıştır.

Atom Modelinin Serüveni

John Dalton

John Joseph Thomson

Ernest Rutherford

Niels Bohr

�Bohr Atom Modeli'nden sonra günümüzde geçerli olan Modern Atom Teorisi'ne dayalı olarak yeni bir atom modeli geliştirilmiştir. Ancak Bohr Atom Modeli, elektron ile ilgili bazı olguları daha somut açıkladığı için günümüzde kullanılmaya devam edilmektedir.

Modern Atom Teorisi �Modern atom teorisine göre elektronlar çok hızlı hareket ettikleri için sabit bir yerleri yoktur. Bu teoriye göre katman kavramından bahsedemiyoruz. Elektronların yerlerini kesin olarak tespit edememekle birlikte yalnızca nerelerde bulunabileceklerini biliyoruz. �Elektronun bulunabileceği ve hareket ettiği alanı, sineğin asılı lambanın çevresinde döndüğü alana benzetebiliriz. İşte elektronların bulunabilecekleri bu kısımlar elektron bulutu olarak adlandırılır.

�Elektron bulutu modelinde elektronun belirli bir yörüngesi olmadığı için elektron, şekilde de gösterildiği gibi kısa süre içinde farklı konumlarda bulunur.

Mustafa ÇELİK Fen ve Teknoloji Öğretmeni Türk Telekom YİBO Digor/KARS
 En kk
En kk Atom modelleri ve tarihsel gelişimi
Atom modelleri ve tarihsel gelişimi Elms school
Elms school Het geheim zaventem
Het geheim zaventem Voor elk probleem is er een oplossing
Voor elk probleem is er een oplossing Elk stack for monitoring
Elk stack for monitoring Elk river lutheran church
Elk river lutheran church Franklin high elk grove
Franklin high elk grove Letken
Letken Tlingit and haida
Tlingit and haida Elk vs wilkins apush
Elk vs wilkins apush Kv-40rw
Kv-40rw Logstash geo_point
Logstash geo_point Elk cloner
Elk cloner Elk grove scholarships
Elk grove scholarships Elk river lutheran church
Elk river lutheran church Voor elk probleem is er een oplossing
Voor elk probleem is er een oplossing Elk grove village youth baseball
Elk grove village youth baseball Orphan boy and the elk dog
Orphan boy and the elk dog Kompetitif inhibisyon
Kompetitif inhibisyon Meissner olayı
Meissner olayı Yağ asitleri isimlendirme
Yağ asitleri isimlendirme Büyük mutfaklarda örgüt yapısı
Büyük mutfaklarda örgüt yapısı Sfinganin
Sfinganin Magnezyum yükseltgenme basamağı
Magnezyum yükseltgenme basamağı Alveollerin yapısı
Alveollerin yapısı