Ma com fatto l HLA HLA DQ 2
































- Slides: 44

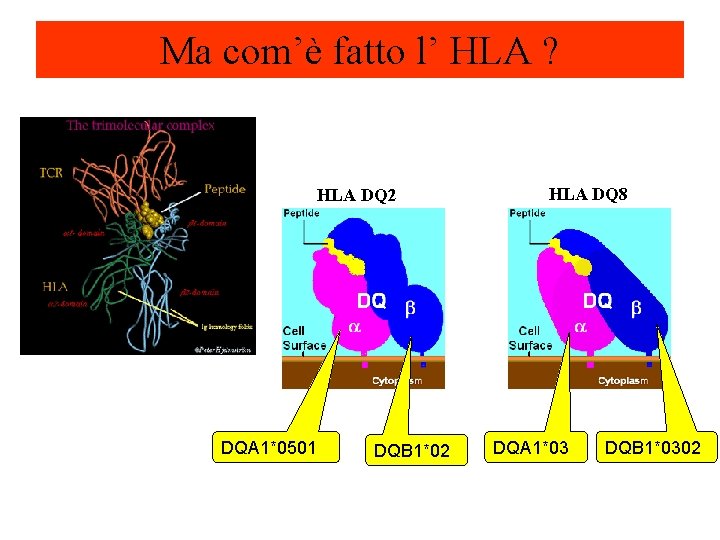
Ma com’è fatto l’ HLA ? HLA DQ 2 DQA 1*0501 DQB 1*02 HLA DQ 8 DQA 1*03 DQB 1*0302

Ruolo giocato dal DQ 2 … DQ 2 codificato in cis con il DR 3/3 DRB 1*03 β DQA 1*05 DQB 1*0201 DQ 2 codificato in trans con il DR 5 e DR 7 DRB 1*05 DRB 1*07 DQB 1*0202 DQA 1*05 β

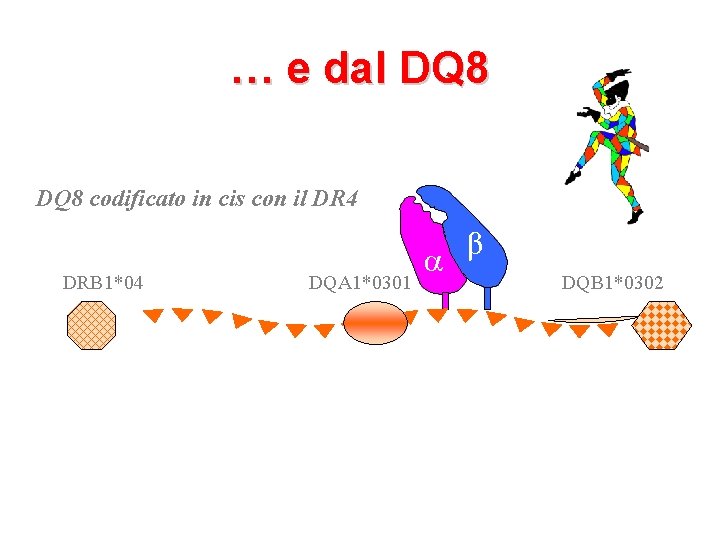
… e dal DQ 8 codificato in cis con il DR 4 DRB 1*04 DQA 1*0301 β DQB 1*0302

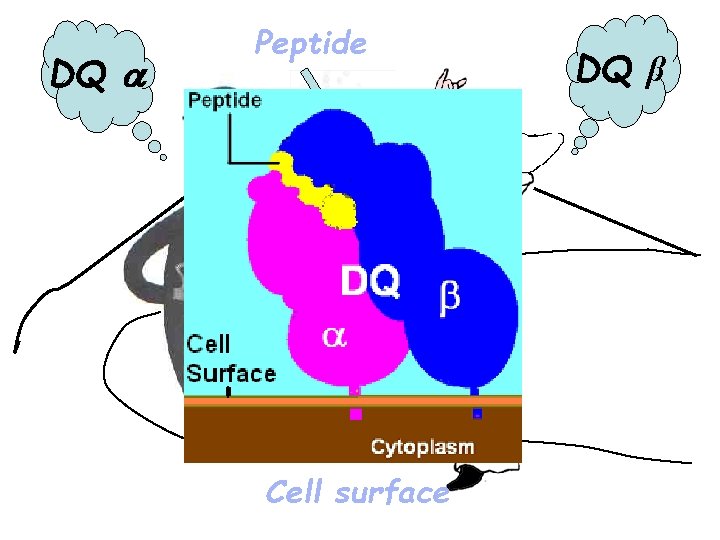
DQ Peptide Cell surface DQ β

DQ Peptide Cell surface DQ β

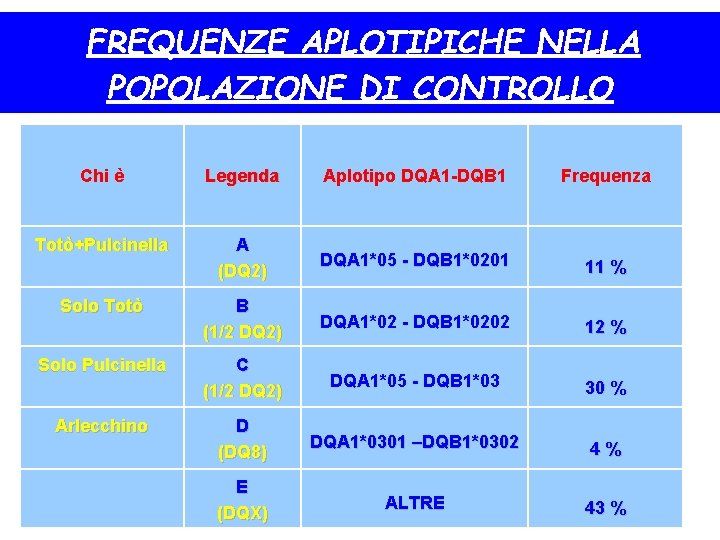
FREQUENZE APLOTIPICHE NELLA POPOLAZIONE DI CONTROLLO Chi è Legenda Aplotipo DQA 1 -DQB 1 Frequenza Totò+Pulcinella A (DQ 2) DQA 1*05 - DQB 1*0201 11 % B (1/2 DQ 2) DQA 1*02 - DQB 1*0202 12 % C (1/2 DQ 2) DQA 1*05 - DQB 1*03 30 % D (DQ 8) DQA 1*0301 –DQB 1*0302 4% E (DQX) ALTRE 43 % Solo Totò Solo Pulcinella Arlecchino

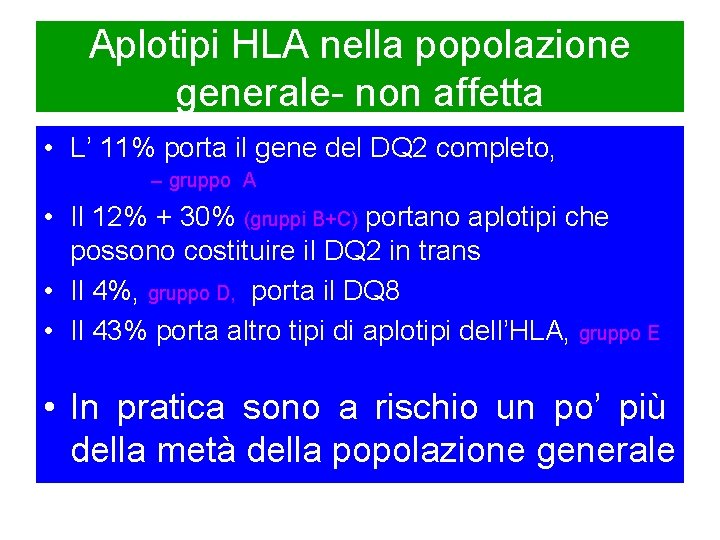
Aplotipi HLA nella popolazione generale- non affetta • L’ 11% porta il gene del DQ 2 completo, – gruppo A • Il 12% + 30% (gruppi B+C) portano aplotipi che possono costituire il DQ 2 in trans • Il 4%, gruppo D, porta il DQ 8 • Il 43% porta altro tipi di aplotipi dell’HLA, gruppo E • In pratica sono a rischio un po’ più della metà della popolazione generale

RISCHI DEI GRUPPI GENOTIPICI NELLA POPOLAZIONE Gruppo Genotipo DR AA DR 3/DR 3 AB DR 3/DR 7 BC DR 5/DR 7 AC DR 3/DR 5 AD DR 3/DR 4 A DR 3/DRX* BB DR 7/DR 7 BD DR 7/DR 4 DD DR 4/DR 4 F altri Gruppo genotipico DQ Rischio % G 1 (Doppio DQ 2) 21 % G 2 (DQ 2 in trans) 17 % G 3 (un solo DQ 2) 6% G 4 (1/2 DQ 2 e/o DQ 8) 5% G 5 0, 6 % rischio per un individuo di sviluppare la malattia secondo il suo gruppo genotipo

Rischio di avere la Celiachia • I soggetti con Doppio DQ 2, AA ed AB, hanno un rischio del 21% • I soggetti con DQ in trans , BC, hanno un rischio del 17% • I soggetti con un solo DQ 2, A, in cis hanno un rischio del 6% • I soggetti DQ 8, D, hanno un rischio del 5%

RISCHIO PER UN FRATELLO DI UN CELIACO SECONDO L’HLA DEL PROBANDO Gruppo G 1 G G G 1 2 3 G 3 G 4 G 4 G 5 G 5 G G G 5 5 5 Genotipo del probando A A A B B C A D A E B B B D D D B E C C C D C E D E E E Rischio % 1 4 1 1 7 7 6 9 6 4 4 3 3 . 0 2 Doppio DQ 2 o DQ in trans = Rischio > 15% Un solo DQ 2 = Rischio tra il 5 ed il 10% Un DQ 8 o ½ DQ 2 = Rischio tra 0, 2 e 5%

Rischio per un nuovo nato a partire dall’ HLA del fratello affetto • Ancora una volta se il fratello affetto è egli stesso un detentore di geni a forte rischio, il nuovo nato avrà un rischio consistente. • Se il fratello ha un doppio DQ 2 , il rischio del nascituro sarà > 15%, se ne ha una sola copia il rischio è stimato al 5 -10%, se ha DQ 8 sarà un rischio < 5%

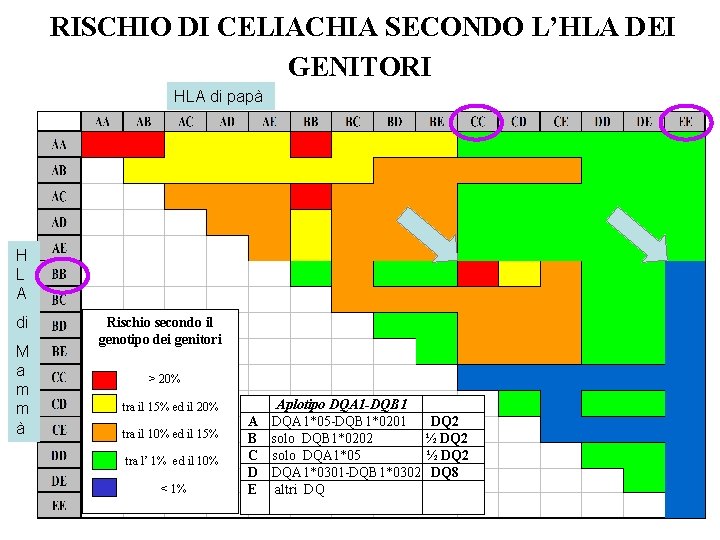
RISCHIO DI CELIACHIA SECONDO L’HLA DEI GENITORI HLA di papà H L A di M a m m à Rischio secondo il genotipo dei genitori > 20% tra il 15% ed il 20% tra il 10% ed il 15% tra l’ 1% ed il 10% < 1% Aplotipo DQA 1 -DQB 1 A DQA 1*05 -DQB 1*0201 B solo DQB 1*0202 C solo DQA 1*05 D DQA 1*0301 -DQB 1*0302 E altri DQ DQ 2 ½ DQ 2 DQ 8

Facciamo un esempio • Se una mamma BB (2 metà B del DQ 2 ) sposa : • un bell’uomo CC (2 metà A del DQ 2 ) • Possono produrre bambini combinati DQB 1*02 + DQBA 1*05 che fa = due copie del DQ 2 a rischio elevato (> 20% di celiachia) • Ma se sposa un giovanotto FF (che non ha alcun pezzo del DQ 2) il rischio per il nascituro sarà trascurabile (< 1%)

CONCLUSIONI Ø Un fratello di un celiaco probando ha un rischio di ricorrenza medio del 10% di sviluppare la celiachia; Ø Secondo l’HLA DQ del probando, la stima del rischio per il fratello varia dal 2 al 14%; Ø Secondo l’HLA dei genitori, la stima del rischio può essere rifinita dall’ 1 al 29%; Ø Nel 40% dei casi, l’ HLA dei genitori sarà sufficiente a dare una stima accurata del rischio per il loro bambino. In altri casi sarà necessario conoscere il genotipo del bambino, subito dopo la nascita, al fine di dare maggiore precisione alla stima del rischio.

CONCLUSIONI Ø 40% dei fratelli di un celiaco probando avrà un rischio trascurabile (< 1%); in tal modo 40% delle famiglie di un celiaco potranno ricevere un messaggio davvero rassicurante Ø 30% avrà un rischio alto o molto alto (> 25%) in tal modo sarà possibile proporre speciali attenzioni durante il follow-up di questi bambini ad alto rischio

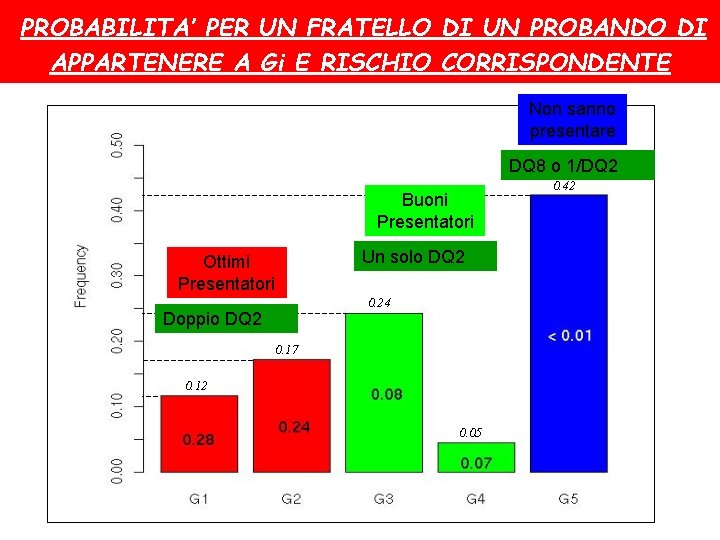
PROBABILITA’ PER UN FRATELLO DI UN PROBANDO DI APPARTENERE A Gi E RISCHIO CORRISPONDENTE Non sanno presentare DQ 8 o 1/DQ 2 Buoni Presentatori Un solo DQ 2 Ottimi Presentatori 0. 24 Doppio DQ 2 0. 17 0. 12 0. 05 0. 42

Rischio Genetico nelle MICI luigi greco ed Oscar Esposito a Pugnochiuso nel 2008

MICI E RISCHIO FAMILIARE • La frequenza è di circa 2 -3/mille =0, 2%. • I familiari di primo grado hanno un Rischio Relativo di malattia di 1415 volte maggiore rispetto alla popolazione • nei familiari di primo grado : • Crohn = 5, 2% (circa 30 volte > popolazione generale) • Colite U. = 1, 6% (circa 15 volte > popolazione generale). • Gli Ebrei hanno un rischio doppio rispetto a non Ebrei.

MICI nei figlioli • Il figlio di un paziente affetto da CD ha un rischio del 10. 4% • I figli hanno la malattia ad età più precoci rispetto ai genitori, ma questo sembra sia dovuto più a distorsione da accertamento che ad un fenomeno reale

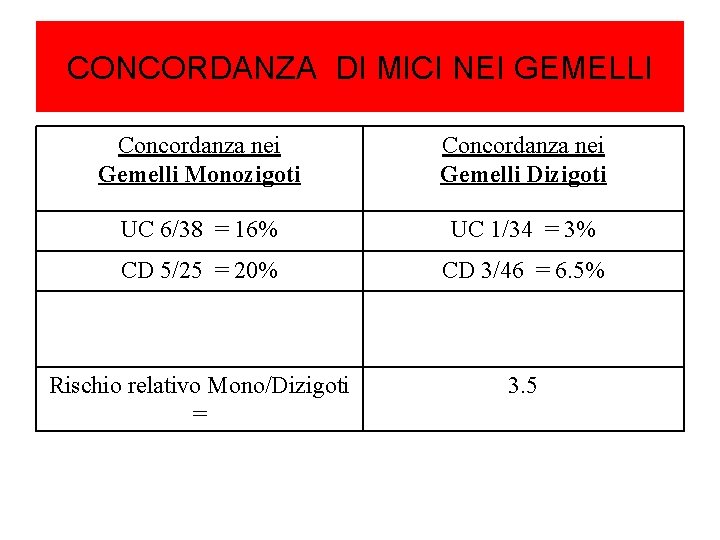
MICI nei gemelli • La concordanza tra monozigoti è modesta (< 20%) : malattie multifattoriali ! • gemelli dizigoti mostrano una concordanza che non è diversa da quella di fratelli non gemelli, suggerendo che la condivisione di esperienze ambientali , che differenziano fratelli non gemelli da gemelli dizigoti, non giochino un ruolo cruciale nella ricorrenza delle MICI.

CONCORDANZA DI MICI NEI GEMELLI Concordanza nei Gemelli Monozigoti Concordanza nei Gemelli Dizigoti UC 6/38 = 16% UC 1/34 = 3% CD 5/25 = 20% CD 3/46 = 6. 5% Rischio relativo Mono/Dizigoti = 3. 5

I GENI DELL' HLA • I geni dell' HLA di Classe II (DR e DQ) sono coinvolti nella predisposizione di malattia e tendono a spiegare circa il 30% del rischio familiare, specie nella UC, ove questi geni hanno una rilevanza circa doppia rispetto al CD. • L'associazioni con specifici aplotipi HLA di Classe II varia molto in diverse popolazioni: • una recente metanalisi ha potuto quantificare il rischio associato a specifici aplotipi dell' HLA.

FATTORI DI RISCHIO LEGATI ALL' HLA DI CLASSE II NELLE MICI Fattori di rischio Fattori di protezione Nel Crohn Nella Colite Ulcerosa DR 7 (OR 1. 42) DR 2 -DR 15 (OR 2) DRB 3*0301 (OR 2. 18) DR 9 (OR 1. 54) DQ 4 (OR 1. 88) nei giapponesi DR 103 (OR 3. 42) DR 2 (OR 0. 83) DR 4 (OR < 0. 7) DR 3 (OR 0. 71)

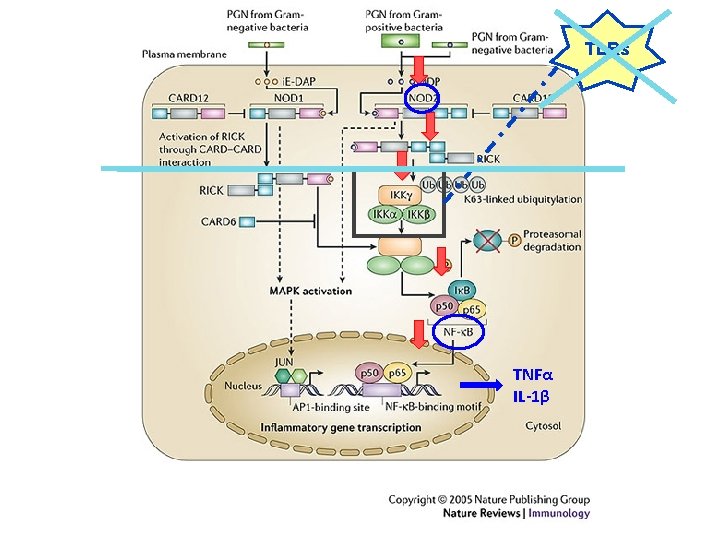
IDENTIFICAZIONE DEL PRIMO GENE DI SUSCETTIBILITA' DELLA MALATTIA DI CROHN • Il gene è denominato NOD 2 (dal Non-Obese Diabetic Mouse) e , nei primi 50 pazienti, ha mostrato 13 polimorfismi. • Due SNPs (Arg 702 Trp e Gli 908 Arg) insieme ad una mutazione frameshift (3020 ins. C) sono risultati associati alla malattia di Crohn. • Il gene NOD 2 mutante mostra una ridotta risposta alla stimolazione indotta da Lipopolisaccaridi batterici.

CARD (Caspase Recruiting Domain) , una unità centrale NOD (Nucleotide Binding Domain) ed una unità C-terminale LRR (Leucine Rich Repeat) NOD LRR Liposaccaridi batterici receptor binding domain signalling attiva il fattore nucleare NF_k. B che gioca un ruolo centrale nella infiammazione Effector domain

Rischio di sviluppare la malattia di Crohn a seconda della combinazione di polimorfismi del NOD 2 (da Hugot 2001) GENOTIPO Rischio Relativo Rischio Assoluto Nessuna mutazione 1 0, 0007 Eterozigosità semplice 3 0, 002 Eterozigosità Composta Omozigosità 44 0, 003 38 0, 003

TLRs TNFα IL-1β

Quanto rischio dal NOD 2 • Circa il 40% dei pazienti Crohn sono portatori di mutazioni del gene NOD 2 (ma anche il 15% dei controlli sani) , • dunque questo primo gene non spiega tutta la componente genetica del Crohn in tutte le popolazioni. • Vi sono infatti altri candidati (IBD 2, 3, 4) che possono interagire con il gene NOD 2 nel costituire la intera suscettibilità genetica delle malattie infiammatorie croniche (24).

Eur J Hum Genet. 2007 Aug; 15(8): 864 -71. Epub 2007 Apr 25. Estimating the odds ratios of Crohn disease for the main CARD 15/NOD 2 mutations using a conditional maximum likelihood method in pedigrees collected via affected family members. Hugot • The odds ratio of Crohn disease were : • 2, 3, 4. 5 for the R 702 W, G 9068 R 1007 fs heterozygotes • 3. 3, 12. 1, 34. 6 for the corresponding homozygotes. • These results confirm the dosage effect for CARD 15/NOD 2 mutations and demonstrate that the disease risks are very different in homozygotes.

A population-based case-control study of CARD 15 and other risk factors in Crohn's disease and ulcerative colitis. Am J Gastroenterol. 2007 Feb; 102(2): 313 -23. Epub 2006 Nov 13. • CD was influenced independently by: • CARD 15/NOD 2 heterozygote and homozygote/ compound-heterozygote status (odds ratios [OR] 3. 7 and 40. 0, respectively), • Jewish ethnicity (OR 18. 5), • CD family history (OR 6. 2), • smoking (OR 3. 0 current and 1. 7 ex-smoker). • Population attributable risk for CARD 15 was 26. 7% and current tobacco use was 46. 8%. .

J Med Genet. 2007 Nov; 44(11): 689 -94. Epub 2007 Jul 27. Estimating risks of common complex diseases across genetic and environmental factors: the example of Crohn disease. • The CD risk to the sibling of a patient with CD who smokes and carries two CARD 15 mutations is approximately 35%, • In contrast, the risk to a non-smoking sibling of a patient with CD who carries no CARD 15 mutations is 2%. • High absolute risks of CD disease can be obtained by incorporating information on smoking, family history and CARD 15 mutations

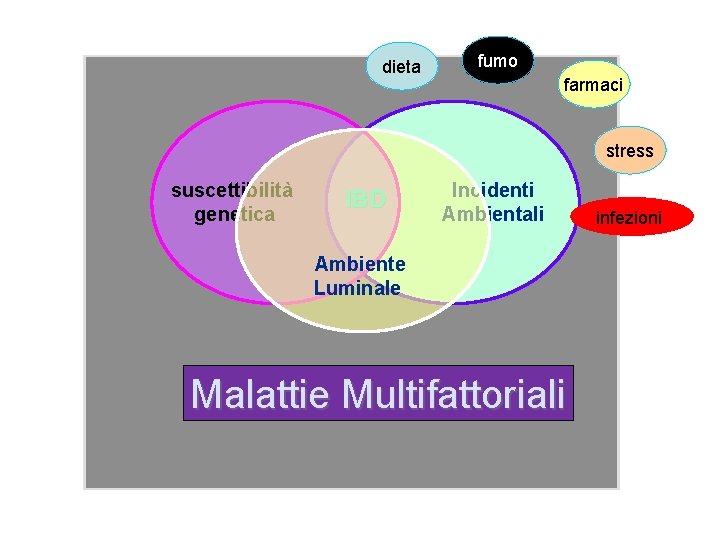
dieta fumo farmaci stress suscettibilità genetica IBD Incidenti Ambientali Ambiente Luminale Malattie Multifattoriali infezioni

Una genetica difficile: la CF Lgreco& Oesposito Pugnochiuso 2008

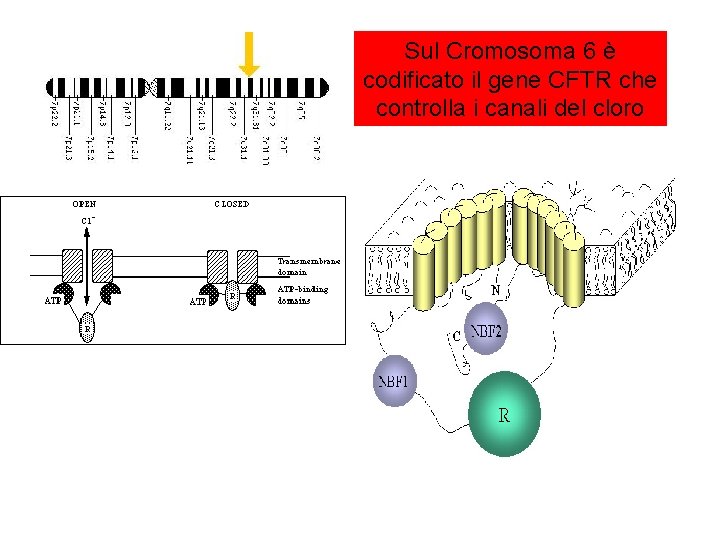
Sul Cromosoma 6 è codificato il gene CFTR che controlla i canali del cloro

2000 Mutazioni possono alterare la funzione della proteina CFTR

Tante Mutazioni ? • La mutazione più frequente nella CF è F 508 del (2/3 dei pazienti) • La prevalenza di questa mutazione decresce dal Nord-Ovest al Sud-est dell’Europa • Le mutazioni CFTR variano per frequenza e distribuzione nelle differenti popolazioni.

Le mutazioni CFTR possono: a) causare CF b) essere associate a disordini CFTR dipendenti c) non avere conseguenze cliniche d) avere conseguenze di dubbia rilevanza clinica o sintomatologia silente

Effetto dei Polimorfismi nella CF

Ma la genetica è incompleta • L’analisi delle mutazioni non è la risposta per tutte le diagnosi dubbie: il ruolo ed i limiti di tale esame devono essere ancora ben definiti; il medico deve usare ed interpretare i risultati nel contesto della clinica. La maggioranza delle mutazioni del CFTR non sono state caratterizzate funzionalmente e per molte ancora il potenziale patogenetico non è ben chiaro.

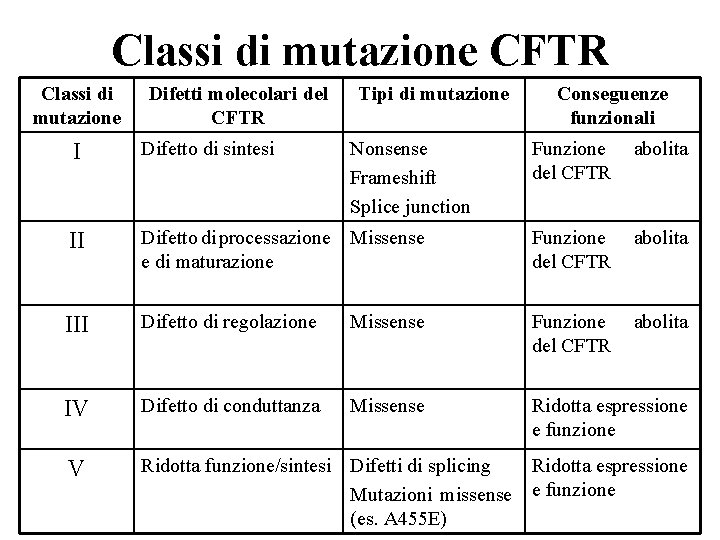
Classi di mutazione CFTR Classi di mutazione Difetti molecolari del CFTR I Difetto di sintesi II Tipi di mutazione Nonsense Frameshift Splice junction Conseguenze funzionali Funzione del CFTR abolita Difetto di processazione Missense e di maturazione Funzione del CFTR abolita III Difetto di regolazione Missense Funzione del CFTR abolita IV Difetto di conduttanza Missense Ridotta espressione e funzione V Ridotta funzione/sintesi Difetti di splicing Ridotta espressione Mutazioni missense e funzione (es. A 455 E)

2000 Mutazioni possono alterare la funzione della proteina CFTR Insufficienza Pancreatica Sufficienza Pancreatica

Genotipo-Fenotipo • Il fenotipo CF è influenzato dal genotipo CFTR così come da altri fattori genetici ed ambientali. • Pazienti appartenenti alle classi di mutazione IV – V del CFTR tendono ad avere un quadro clinico meno severo se confrontati con quelli di classe IIII • La categorizzazione in 5 classi di mutazione è uno strumento di ricerca e non è predittivo dell’outcome del singolo paziente • La correlazione genotipo/fenotipo può essere utile nella popolazione per determinare le associazioni, ma non dovrebbe ancora essere usata per la prognosi del singolo paziente

Genotipo-Fenotipo • Pazienti con mutazioni di classe I-III del CFTR su entrambi gli alleli hanno una elevata probabilità di essere affetti da insufficienza pancreatica, mentre quelli con almeno una mutazione di classe IV – V tenderanno ad avere una funzionalità pancreatica nella norma • Pazienti con sufficienza pancreatica tendono ad avere uno stato nutrizionale migliore, sebbene abbiano comunque un rischio significativo di sviluppare pancreatiti.

La salita verso l’uso clinico della genetica è difficile, ma siamo stati ammessi ai primi gradini Molto presto un ‘chippetiello’ ci aiuterà
 Dậy thổi cơm mua thịt cá
Dậy thổi cơm mua thịt cá Cơm
Cơm Hla b35 artrite psoriasica
Hla b35 artrite psoriasica Mhc and hla
Mhc and hla Hla b27 pozitivita
Hla b27 pozitivita Hla b44 positive
Hla b44 positive Slidetodoc.com
Slidetodoc.com Ulcerative colitis hla
Ulcerative colitis hla Hla typizace
Hla typizace Mhc and hla
Mhc and hla Pygalgie
Pygalgie Hla typizace
Hla typizace Hla 검사 원리
Hla 검사 원리 Indice de shober
Indice de shober Palm sunday hla
Palm sunday hla Fatto
Fatto Grandi cosa ha fatto il signore per noi
Grandi cosa ha fatto il signore per noi Direttamente
Direttamente Convivente di fatto legge 76/2016
Convivente di fatto legge 76/2016 Cristo si è fatto obbediente
Cristo si è fatto obbediente Giovanni falcone cosa ha fatto
Giovanni falcone cosa ha fatto Come è fatto un triangolo
Come è fatto un triangolo Cosa ha fatto pitagora
Cosa ha fatto pitagora Principio di conservazione dell'energia
Principio di conservazione dell'energia Fonti atto
Fonti atto Ed elli avea del cul fatto trombetta translation
Ed elli avea del cul fatto trombetta translation Possesso vale titolo
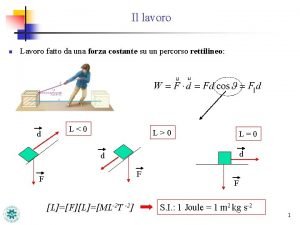
Possesso vale titolo Il lavoro è una forza conservativa
Il lavoro è una forza conservativa Non fare mai quello che non vorresti sia fatto a te
Non fare mai quello che non vorresti sia fatto a te