M 1 Sant Parcours Physiologie Option UE Physiologie




















- Slides: 39

M 1 Santé Parcours Physiologie Option UE Physiologie et Physiopathologie Cardiovasculaire et Respiratoire Développement pulmonaire J. Bourbon, Inserm U 651

Ø Le développement pulmonaire constitue un remarquable exemple des mécanismes d’interactions cellulaires au cours de la morphogenèse et de la cytodifférenciation Ø Il existe des pathologies spécifiques du poumon en développement, particulièrement chez le nouveau-né prématuré

Introduction : Structure pulmonaire

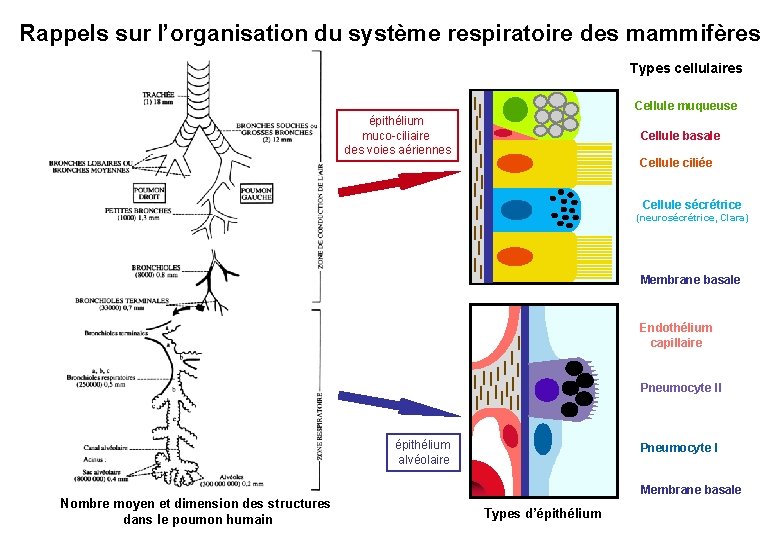
Rappels sur l’organisation du système respiratoire des mammifères Types cellulaires Cellule muqueuse épithélium muco-ciliaire des voies aériennes Cellule basale Cellule ciliée Cellule sécrétrice (neurosécrétrice, Clara) Membrane basale Endothélium capillaire Pneumocyte II épithélium alvéolaire Nombre moyen et dimension des structures dans le poumon humain Pneumocyte I Membrane basale Types d’épithélium

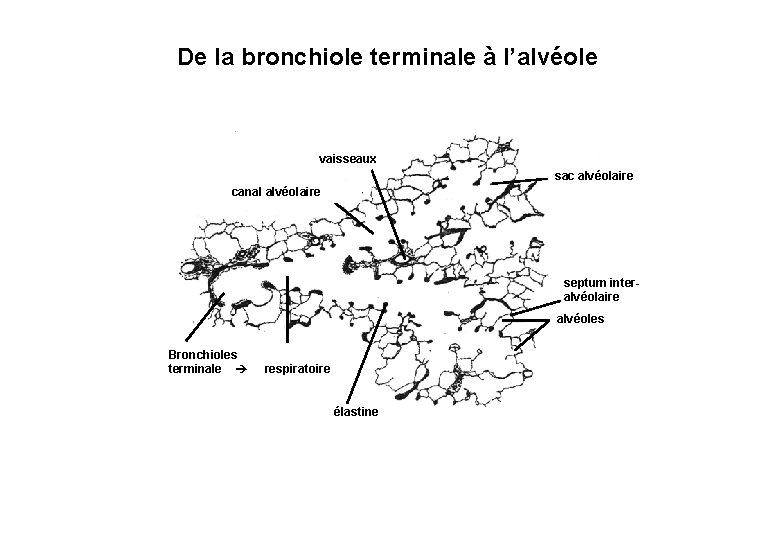
De la bronchiole terminale à l’alvéole vaisseaux sac alvéolaire canal alvéolaire septum interalvéolaire alvéoles Bronchioles terminale respiratoire élastine

Ultrastructure des voies aériennes Les voies aériennes de conduction Cils Cellule à mucus La barrière alvéolo-capillaire (BAC), structure assurant les échanges gazeux Cellule ciliée Hématie Lame basale Pneumocyte I BAC : 0, 2 µm Matrice (collagène…) Cellule endothéliale fibroblaste Pneumocytes I: cellules aplaties très étendues formant la majeure partie de la surface alvéolaire Autre cellule sécrétrice Lame basale Cellule basale (Pneumocytes I : 50% en nombre, mais 97% de la surface, Pneumocytes II : 50% en nombre, mais 3% de la surface)

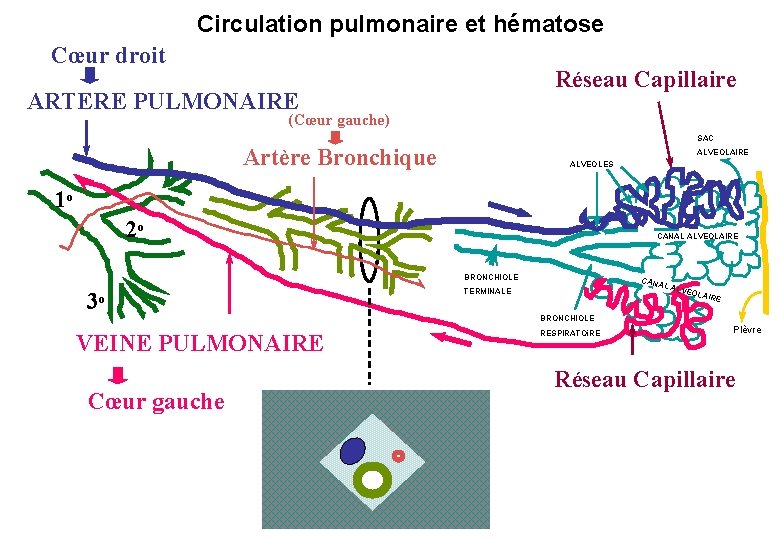
Circulation pulmonaire et hématose Cœur droit Réseau Capillaire ARTERE PULMONAIRE (Cœur gauche) SAC Artère Bronchique ALVEOLAIRE ALVEOLES 1 o 2 o CANAL ALVEOLAIRE BRONCHIOLE 3 o CAN AL A TERMINALE LVEO LAIR E BRONCHIOLE VEINE PULMONAIRE Cœur gauche RESPIRATOi. RE Plèvre Réseau Capillaire

L’arbre aérien et les générations de ramifications Moulage polyester d’un poumon humain adulte vu de dos (le poumon gauche a été moins empli que le poumon droit)

Origine embryologique du poumon et étapes de l’organogenèse pulmonaire

Cellules Quelques définitions Totipotentes : cellules capables d’engendrer un organisme entier en donnant naissance à l’intégralité de ses cellules (œuf, cellules issues des premières divisions de l’œuf jusqu’au stade 8 cellules). Pluripotentes : cellules souches capables sous divers effets inducteurs d’initier toutes les différenciations cellulaires issues des 3 feuillets ectodermique, endodermique, mésodermique, ou à la lignée germinale (cellules ES, EG). Multipotentes : cellules engagées dans une voie particulière de différenciation (induction="commitment") mais possédant un potentiel large correspondant aux cellules d’un seul feuillet embryonnaire (cellules souches hématopoïétiques, mésenchymateuses, neurales, etc…) Feuillets embryonnaires Ectoderme : feuillet externe à l’origine de l’épiderme et du système nerveux Endoderme : feuillet interne issu de la gastrulation, à l’origine du tube digestif et de ses dérivés Mésoderme : feuillet intermédiaire à l’origine du tissu conjonctif, du squelette, des muscles, des vaisseaux, etc… Epithélium : Tissu constitué de cellules polarisées (face apicale, face baso-latérale), juxtaposées et reliées par des jonctions serrées, et reposant sur une lame basale (ou membrane basale, organisation spécifique de la matrice extracellulaire). Mésenchyme : Tissu conjonctif propre à l’embryon et au fœtus, dérivé du mésoderme et caractérisé par la présence de cellules nombreuses (fibroblastes) au sein d’une matrice peu abondante. En dehors des tissus auxquels il donne naissance (endothéliums vasculaires, cartilages, glomérules rénaux, etc…), il est à l’origine du tissu conjonctif de l’adulte.

Organogenèse pulmonaire Ø Les cellules épithéliales du poumon dérivent de l’intestin embryonnaire primitif (endoderme) Intestin antérieur diverticule thyroïdien, diverticule respiratoire (trachée, bronches, parenchyme pulmonaire), appareil digestif (pharynx, œsophage, estomac / début du duodénum / foie, pancréas). Ø Le poumon est issu de l’association du bourgeon épithélial (formé par évagination ventrale du tube digestif embryonnaire) avec le mésenchyme environnant Bourgeon épithélial toutes les cellules épithéliales du poumon mature (voies aériennes et alvéoles) Mésenchyme toutes les autres cellules (fibroblastes, endothéliums vasculaires, fibres musculaires lisses, chondrocytes, etc…) ØLe poumon se développe par ramifications successives du tube épithélial originel ( « branching morphogenesis » ) Ø Le plan de l’organe (asymétrie, nombre de troncs bronchiques et de lobes) est caractéristique de l’espèce et génétiquement déterminé

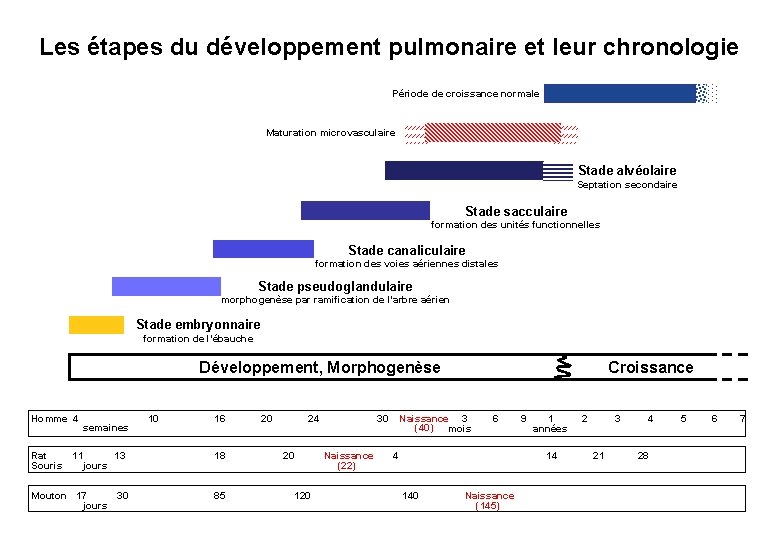
Les étapes du développement pulmonaire et leur chronologie Période de croissance normale Maturation microvasculaire Stade alvéolaire Septation secondaire Stade sacculaire formation des unités functionnelles Stade canaliculaire formation des voies aériennes distales Stade pseudoglandulaire morphogenèse par ramification de l’arbre aérien Stade embryonnaire formation de l’ébauche Développement, Morphogenèse Homme 4 semaines 10 16 Rat 11 13 Souris jours 18 Mouton 17 30 jours 85 20 24 20 30 Naissance (22) 120 Croissance Naissance 3 (40) mois 6 4 9 1 années 14 140 Naissance (145) 2 3 21 4 28 5 6 7

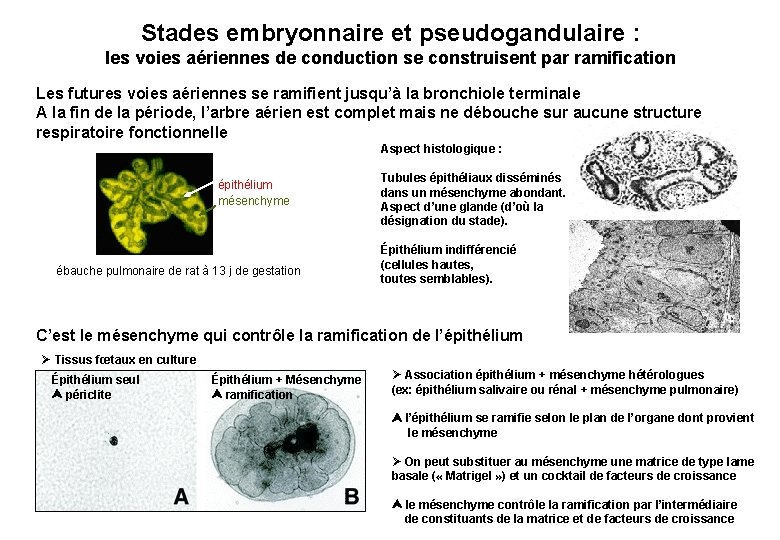
Stades embryonnaire et pseudogandulaire : les voies aériennes de conduction se construisent par ramification Les futures voies aériennes se ramifient jusqu’à la bronchiole terminale A la fin de la période, l’arbre aérien est complet mais ne débouche sur aucune structure respiratoire fonctionnelle Aspect histologique : épithélium mésenchyme ébauche pulmonaire de rat à 13 j de gestation Tubules épithéliaux disséminés dans un mésenchyme abondant. Aspect d’une glande (d’où la désignation du stade). Épithélium indifférencié (cellules hautes, toutes semblables). C’est le mésenchyme qui contrôle la ramification de l’épithélium Ø Tissus fœtaux en culture Épithélium seul périclite Épithélium + Mésenchyme ramification Ø Association épithélium + mésenchyme hétérologues (ex: épithélium salivaire ou rénal + mésenchyme pulmonaire) l’épithélium se ramifie selon le plan de l’organe dont provient le mésenchyme Ø On peut substituer au mésenchyme une matrice de type lame basale ( « Matrigel » ) et un cocktail de facteurs de croissance le mésenchyme contrôle la ramification par l’intermédiaire de constituants de la matrice et de facteurs de croissance

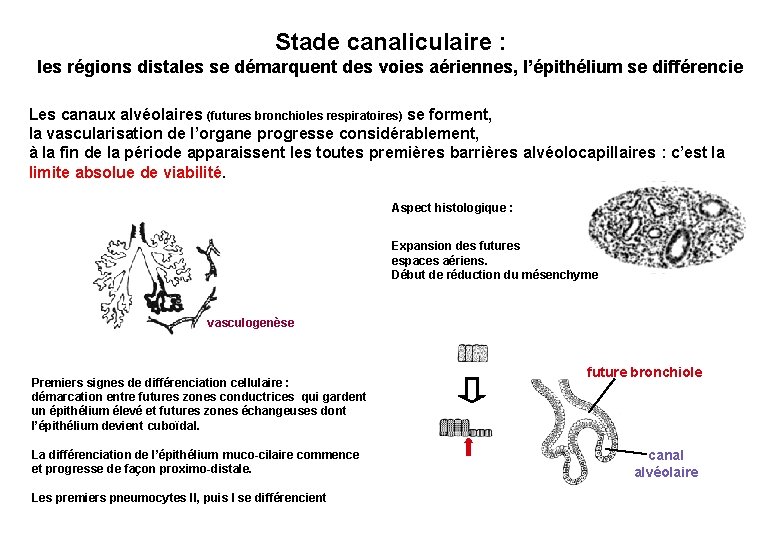
Stade canaliculaire : les régions distales se démarquent des voies aériennes, l’épithélium se différencie Les canaux alvéolaires (futures bronchioles respiratoires) se forment, la vascularisation de l’organe progresse considérablement, à la fin de la période apparaissent les toutes premières barrières alvéolocapillaires : c’est la limite absolue de viabilité. Aspect histologique : Expansion des futures espaces aériens. Début de réduction du mésenchyme vasculogenèse Premiers signes de différenciation cellulaire : démarcation entre futures zones conductrices qui gardent un épithélium élevé et futures zones échangeuses dont l’épithélium devient cuboïdal. La différenciation de l’épithélium muco-cilaire commence et progresse de façon proximo-distale. Les premiers pneumocytes II, puis I se différencient future bronchiole canal alvéolaire

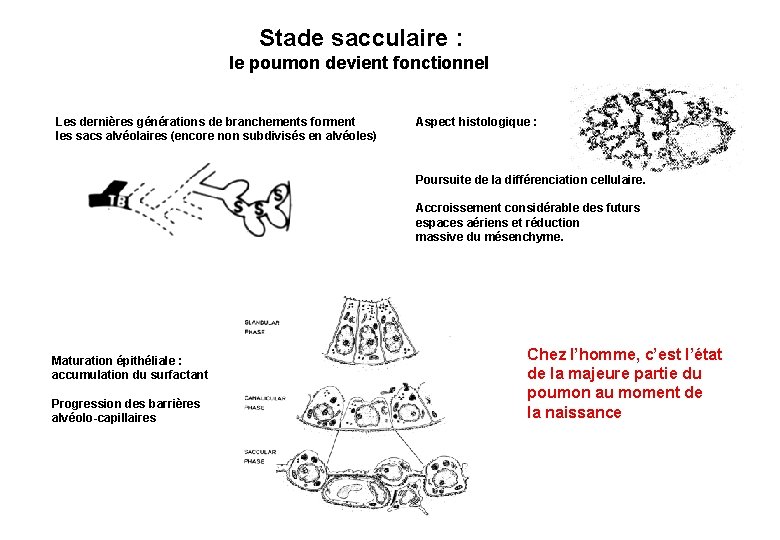
Stade sacculaire : le poumon devient fonctionnel Les dernières générations de branchements forment les sacs alvéolaires (encore non subdivisés en alvéoles) Aspect histologique : Poursuite de la différenciation cellulaire. Accroissement considérable des futurs espaces aériens et réduction massive du mésenchyme. Maturation épithéliale : accumulation du surfactant Progression des barrières alvéolo-capillaires Chez l’homme, c’est l’état de la majeure partie du poumon au moment de la naissance

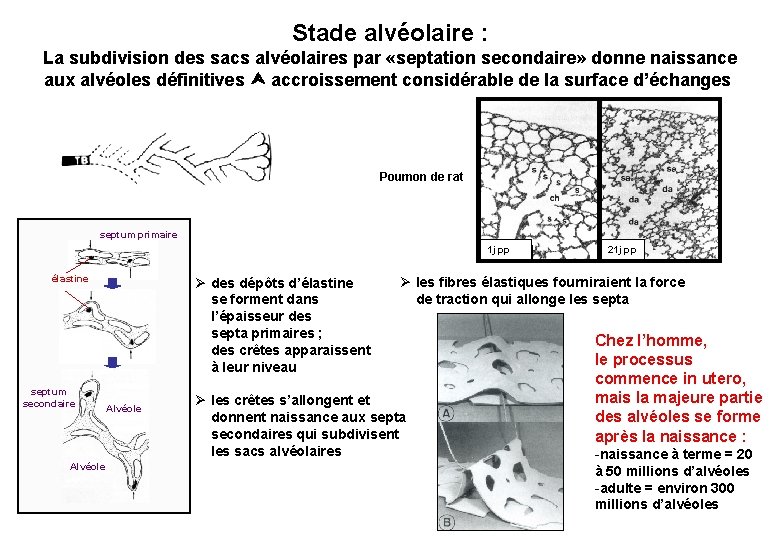
Stade alvéolaire : La subdivision des sacs alvéolaires par «septation secondaire» donne naissance aux alvéoles définitives accroissement considérable de la surface d’échanges Poumon de rat septum primaire 1 j pp élastine septum secondaire Alvéole Ø des dépôts d’élastine se forment dans l’épaisseur des septa primaires ; des crêtes apparaissent à leur niveau Alvéole 21 j pp Ø les fibres élastiques fourniraient la force de traction qui allonge les septa Ø les crêtes s’allongent et donnent naissance aux septa secondaires qui subdivisent les sacs alvéolaires Chez l’homme, le processus commence in utero, mais la majeure partie des alvéoles se forme après la naissance : -naissance à terme = 20 à 50 millions d’alvéoles -adulte = environ 300 millions d’alvéoles

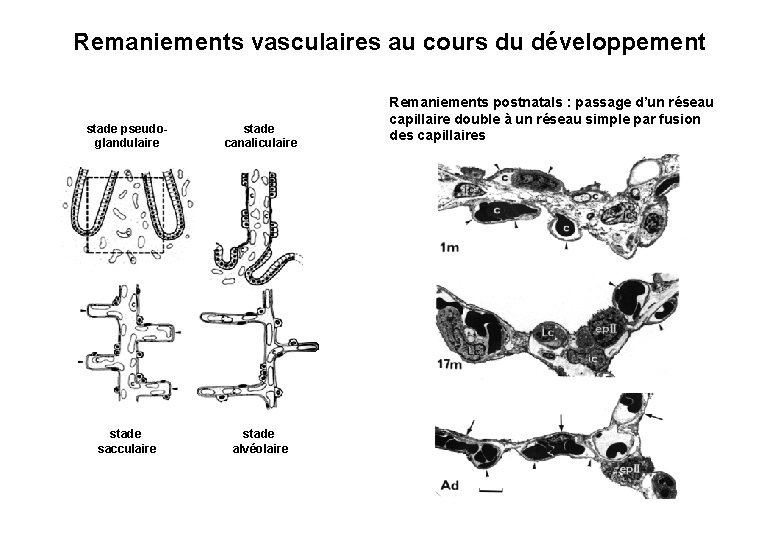
Remaniements vasculaires au cours du développement stade pseudoglandulaire stade canaliculaire stade sacculaire stade alvéolaire Remaniements postnatals : passage d’un réseau capillaire double à un réseau simple par fusion des capillaires

Spécificité tissulaire pulmonaire, rôle des facteurs de transcription

Détermination du territoire pulmonaire Intestin antérieur diverticule thyroïdien, diverticule respiratoire (trachée, bronches, poumon), appareil digestif (pharynx, œsophage, estomac / début du duodénum / foie, pancréas). Le poumon se développe dans un territoire endodermique qui co-exprime les facteurs de transcription TTF 1, Foxa 1 et Foxa 2 Pax-8 TTF-1 Fox a 2 Fox a 3 Thyroïde Poumon Tube digestif THYROID TRANSCRIPTION FACTOR (TTF-1) : Facteur de transcription à domaine de liaison à l’ADN de type homéotique (Homéodomaine: séquence conservée de 60 acides aminés, de structure hélice-tour-hélice, codée par 180 nucléotides qui constituent l’homeobox) Famille FORKHEAD BOX (Fox) : Facteurs de transcription à domaine de liaison à l’ADN de type "winged helix" (Winged helix: séquence conservée d’une centaine d’acides aminés dérivée du motif homéotique)

Facteurs de transcription indispensables au développement pulmonaire TTF-1 : le K. O. n’empêche pas la formation du bourgeon pulmonaire, mais supprime la ramification et la différenciation. Flèche : le poumon est réduit à un sac dilaté bordé par un épithélium indifférencié. TTF-1 est indispensable à l’expression de diverses protéines pulmonaires (protéines du surfactant, protéines de la cellule bronchiolaire de Clara). -/- +/+ Foxa 2 : - K. O. précocement létal - K. O. inductible ciblé sur poumon : différenciation épithéliale incomplète Foxj 1 : K. O. entraîne retard de croissance, anomalies de l’asymétrie G-D, absence de cils et de flagelles +/+ -/- Foxf 1 : K. O. (-/-) précocement létal, mais à l’état hétérozygote (+/-), provoque des défauts de lobation, une hypoplasie et une immaturité pulmonaire +/- +/+

Différenciation épithéliale : rôle du mésenchyme

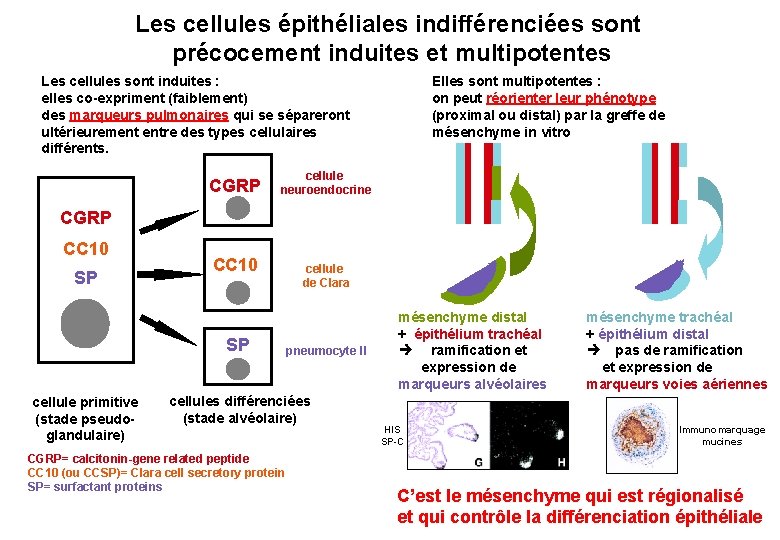
Les cellules épithéliales indifférenciées sont précocement induites et multipotentes Les cellules sont induites : elles co-expriment (faiblement) des marqueurs pulmonaires qui se sépareront ultérieurement entre des types cellulaires différents. CGRP Elles sont multipotentes : on peut réorienter leur phénotype (proximal ou distal) par la greffe de mésenchyme in vitro cellule neuroendocrine CGRP CC 10 SP cellule primitive (stade pseudoglandulaire) cellule de Clara pneumocyte II cellules différenciées (stade alvéolaire) CGRP= calcitonin-gene related peptide CC 10 (ou CCSP)= Clara cell secretory protein SP= surfactant proteins mésenchyme distal + épithélium trachéal ramification et expression de marqueurs alvéolaires HIS SP-C mésenchyme trachéal + épithélium distal pas de ramification et expression de marqueurs voies aériennes Immunomarquage mucines C’est le mésenchyme qui est régionalisé et qui contrôle la différenciation épithéliale

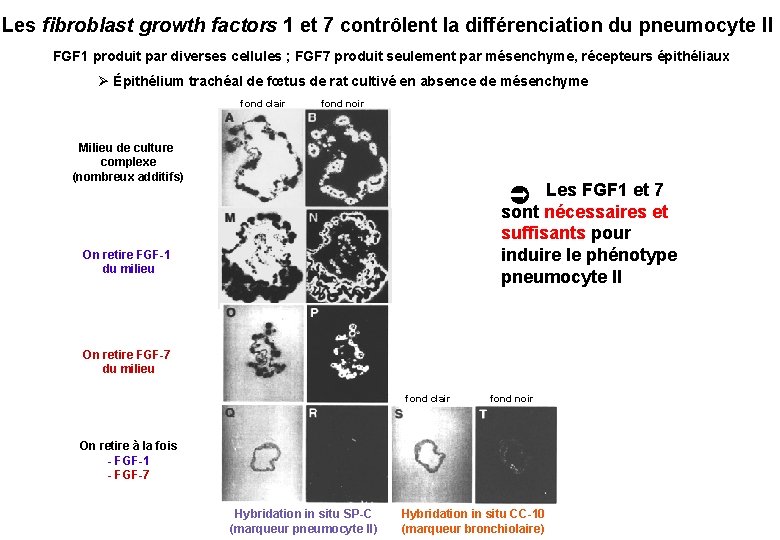
Les fibroblast growth factors 1 et 7 contrôlent la différenciation du pneumocyte II FGF 1 produit par diverses cellules ; FGF 7 produit seulement par mésenchyme, récepteurs épithéliaux Ø Épithélium trachéal de fœtus de rat cultivé en absence de mésenchyme fond clair fond noir Milieu de culture complexe (nombreux additifs) Les FGF 1 et 7 sont nécessaires et suffisants pour induire le phénotype pneumocyte II On retire FGF-1 du milieu On retire FGF-7 du milieu fond clair fond noir On retire à la fois - FGF-1 - FGF-7 Hybridation in situ SP-C (marqueur pneumocyte II) Hybridation in situ CC-10 (marqueur bronchiolaire)

Lignages cellulaires épithéliaux Ø Deux lignages principaux : voies de conduction et alvéoles Ø Pas de cellules souches indifférenciées dans l’épithélium pulmonaire : les cellules basales et sécrétrices sont capables de proliférer et de se transdifférencier en cellules en différenciation terminale

Le poumon fœtal sécrète un liquide qui joue un rôle essentiel dans le développement

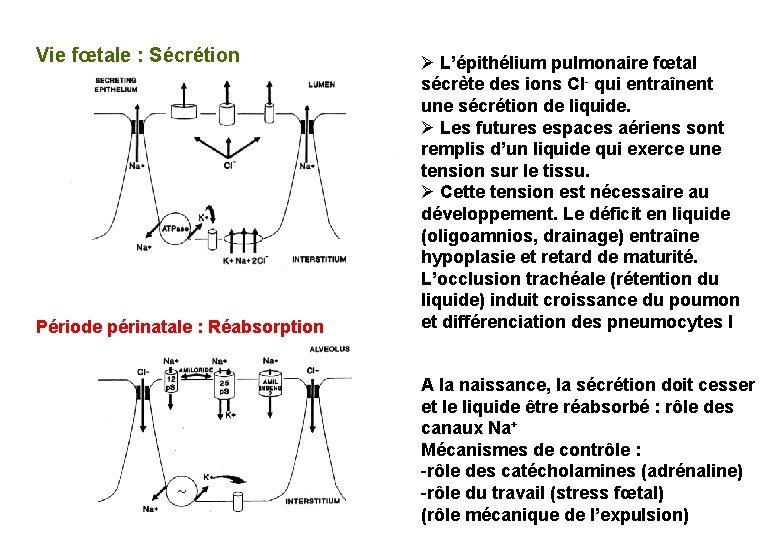
Vie fœtale : Sécrétion Période périnatale : Réabsorption Ø L’épithélium pulmonaire fœtal sécrète des ions Cl- qui entraînent une sécrétion de liquide. Ø Les futures espaces aériens sont remplis d’un liquide qui exerce une tension sur le tissu. Ø Cette tension est nécessaire au développement. Le déficit en liquide (oligoamnios, drainage) entraîne hypoplasie et retard de maturité. L’occlusion trachéale (rétention du liquide) induit croissance du poumon et différenciation des pneumocytes I A la naissance, la sécrétion doit cesser et le liquide être réabsorbé : rôle des canaux Na+ Mécanismes de contrôle : -rôle des catécholamines (adrénaline) -rôle du travail (stress fœtal) (rôle mécanique de l’expulsion)

Aspect pathologiques du développement pulmonaire

Principales pathologies du développement pulmonaire Origine ante-natale : Ø Hypoplasies pulmonaires d’origines diverses (dont hernie diaphragmatique congénitale) Ø Emphysème lobaire congénital et kystes adénomatoïdes Origine postnatale : Ø Maladie des Membranes Hyalines (MMH), ou Syndrome de Détresse Respiratoire néonatale (aiguë) Ø Dysplasie bronchopulmonaire (DBP) du prématuré (chronique)

Principales pathologies du développement pulmonaire Origine ante-natale : Ø Hypoplasies pulmonaires d’origines diverses (dont hernie diaphragmatique congénitale) Ø Emphysème lobaire congénital et kystes adénomatoïdes Origine postnatale : Ø Maladie des Membranes Hyalines (MMH), ou Syndrome de Détresse Respiratoire néonatale (aiguë) Ø Dysplasie bronchopulmonaire (DBP) du prématuré (chronique)

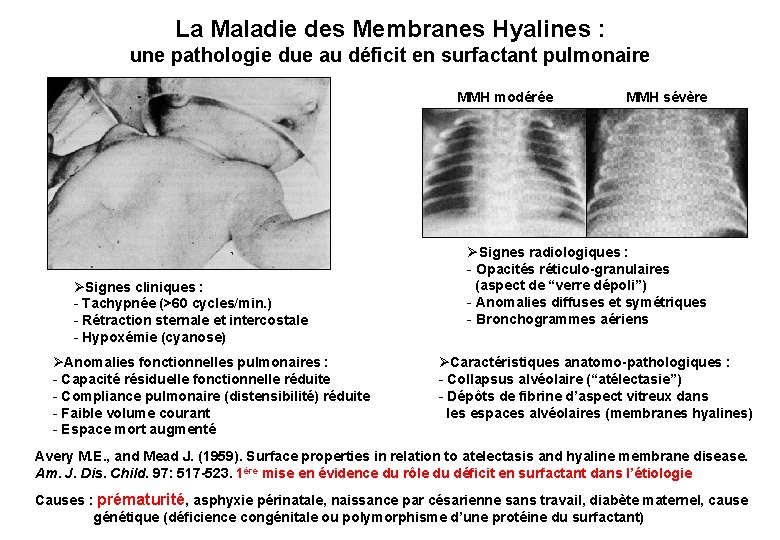
La Maladie des Membranes Hyalines : une pathologie due au déficit en surfactant pulmonaire MMH modérée ØSignes cliniques : - Tachypnée (>60 cycles/min. ) - Rétraction sternale et intercostale - Hypoxémie (cyanose) ØAnomalies fonctionnelles pulmonaires : - Capacité résiduelle fonctionnelle réduite - Compliance pulmonaire (distensibilité) réduite - Faible volume courant - Espace mort augmenté MMH sévère ØSignes radiologiques : - Opacités réticulo-granulaires (aspect de “verre dépoli”) - Anomalies diffuses et symétriques - Bronchogrammes aériens ØCaractéristiques anatomo-pathologiques : - Collapsus alvéolaire (“atélectasie”) - Dépôts de fibrine d’aspect vitreux dans les espaces alvéolaires (membranes hyalines) Avery M. E. , and Mead J. (1959). Surface properties in relation to atelectasis and hyaline membrane disease. Am. J. Dis. Child. 97: 517 -523. 1ère mise en évidence du rôle du déficit en surfactant dans l’étiologie Causes : prématurité, asphyxie périnatale, naissance par césarienne sans travail, diabète maternel, cause génétique (déficience congénitale ou polymorphisme d’une protéine du surfactant)

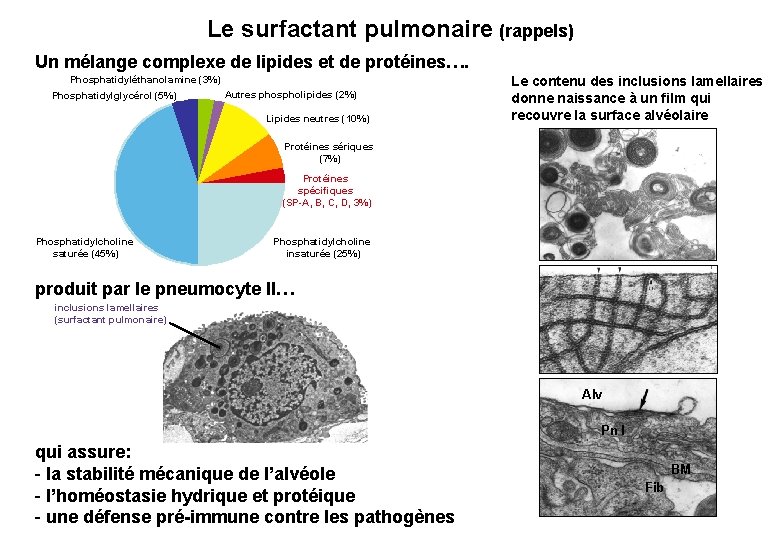
Le surfactant pulmonaire (rappels) Un mélange complexe de lipides et de protéines…. Phosphatidyléthanolamine (3%) Phosphatidylglycérol (5%) Autres phospholipides (2%) Lipides neutres (10%) Le contenu des inclusions lamellaires donne naissance à un film qui recouvre la surface alvéolaire Protéines sériques (7%) Protéines spécifiques (SP-A, B, C, D, 3%) Phosphatidylcholine saturée (45%) Phosphatidylcholine insaturée (25%) produit par le pneumocyte II… inclusions lamellaires (surfactant pulmonaire) Alv Pn I qui assure: - la stabilité mécanique de l’alvéole - l’homéostasie hydrique et protéique - une défense pré-immune contre les pathogènes BM Fib

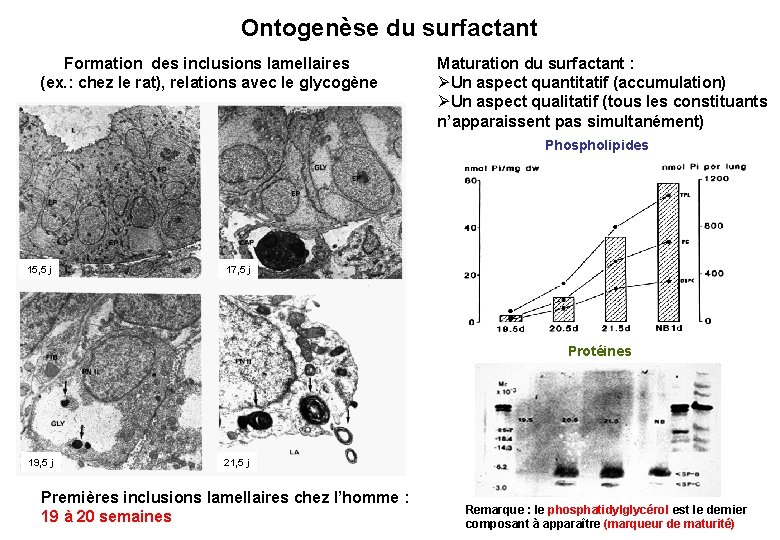
Ontogenèse du surfactant Formation des inclusions lamellaires (ex. : chez le rat), relations avec le glycogène Maturation du surfactant : ØUn aspect quantitatif (accumulation) ØUn aspect qualitatif (tous les constituants n’apparaissent pas simultanément) Phospholipides 15, 5 j 17, 5 j Protéines 19, 5 j 21, 5 j Premières inclusions lamellaires chez l’homme : 19 à 20 semaines Remarque : le phosphatidylglycérol est le dernier composant à apparaître (marqueur de maturité)

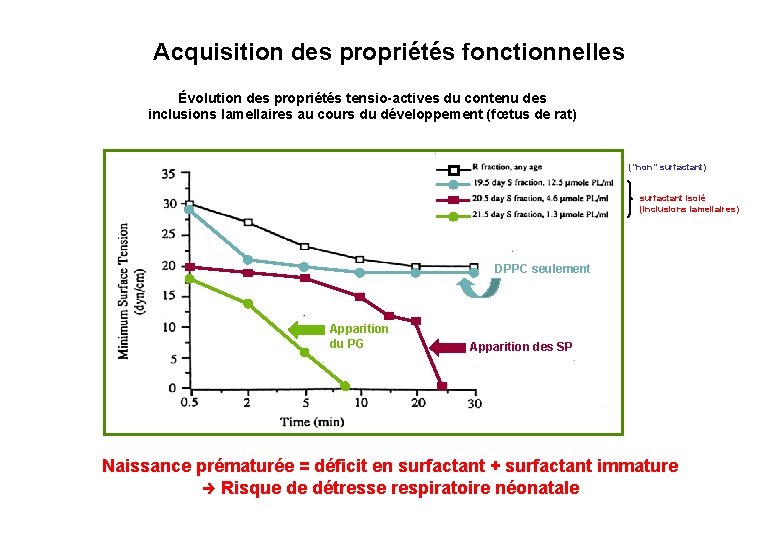
Acquisition des propriétés fonctionnelles Évolution des propriétés tensio-actives du contenu des inclusions lamellaires au cours du développement (fœtus de rat) ("non" surfactant) surfactant isolé (inclusions lamellaires) DPPC seulement Apparition du PG Apparition des SP Naissance prématurée = déficit en surfactant + surfactant immature Risque de détresse respiratoire néonatale

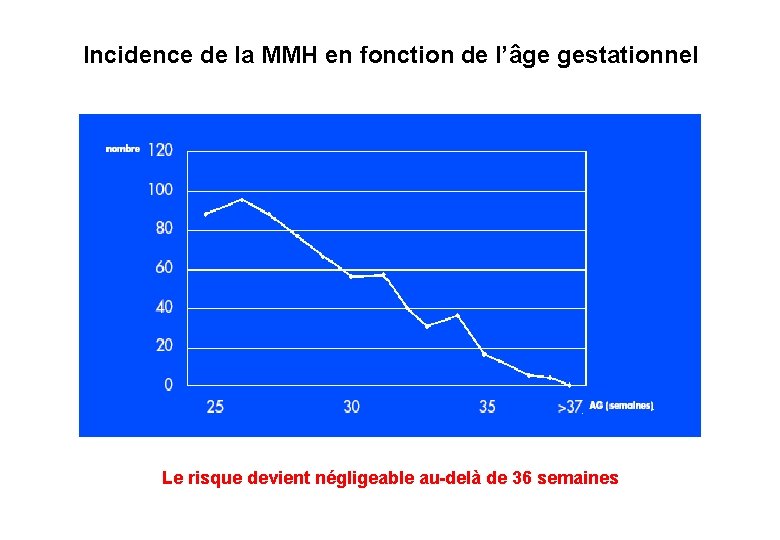
Incidence de la MMH en fonction de l’âge gestationnel Le risque devient négligeable au-delà de 36 semaines

Traitement de la MMH • Traitement "symptomatique" par la ventilation mécanique avec pression positive à l’expiration ( post-end expiratory pressure, PEEP) et oxygénothérapie (Fi. O 2>21%) • Traitement étiologique : administration de surfactant exogène (surfactant synthétique, surfactant naturel modifié) • Traitement préventif : corticoïdes à la mère en cas de menace d’accouchement prématuré (les corticoïdes accélèrent la maturation et stimulent la synthèse de tous les constituants du surfactant)

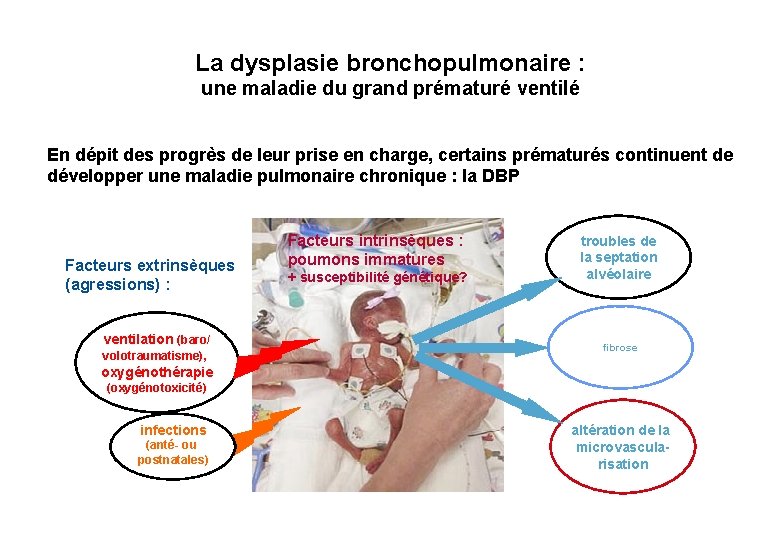
La dysplasie bronchopulmonaire : une maladie du grand prématuré ventilé En dépit des progrès de leur prise en charge, certains prématurés continuent de développer une maladie pulmonaire chronique : la DBP Facteurs extrinsèques (agressions) : ventilation (baro/ volotraumatisme), oxygénothérapie Facteurs intrinsèques : poumons immatures + susceptibilité génétique? troubles de la septation alvéolaire fibrose (oxygénotoxicité) infections (anté- ou postnatales) altération de la microvascularisation

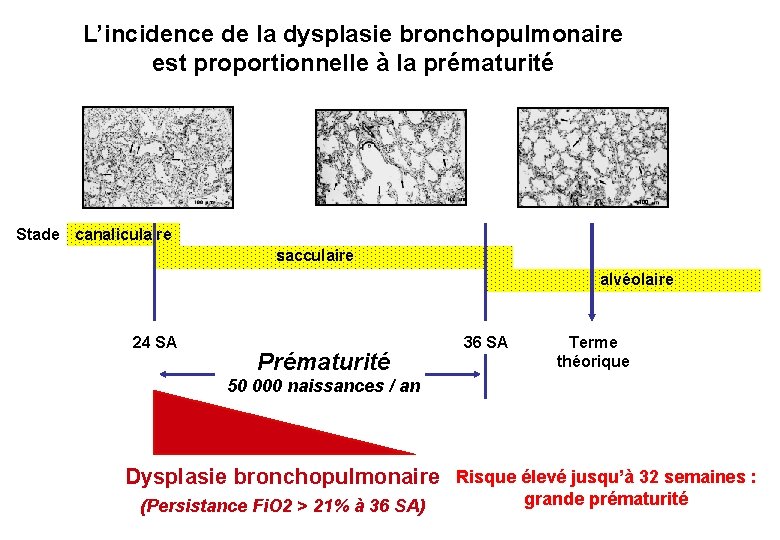
L’incidence de la dysplasie bronchopulmonaire est proportionnelle à la prématurité Stade canaliculaire sacculaire alvéolaire 24 SA Prématurité 36 SA Terme théorique 50 000 naissances / an Dysplasie bronchopulmonaire Risque élevé jusqu’à 32 semaines : (Persistance Fi. O 2 > 21% à 36 SA) grande prématurité

La dysplasie bronchopulmonaire : une physiopathologie qui a fortement évolué Prématurité « Ère pré-surfactant » (avant 1990) Évolution favorable sans DBP Surfactant exogène (+ corticostéroïdes, + progrès ventilation) "ancienne" DBP "nouvelle" DBP -lésions bronchiques -fibrose étendue -troubles de l’alvéolisation (septation, microvaisseaux) -troubles de l’alvéolisation prédominants -fibrose modérée

 Konvergensi option adalah
Konvergensi option adalah What is options
What is options Tripelpunkt des wassers
Tripelpunkt des wassers Slidetodoc.com
Slidetodoc.com Physiologie de la vision
Physiologie de la vision Vitamine d physiologie
Vitamine d physiologie Hypertone dehydratation amboss
Hypertone dehydratation amboss Georges dolisi
Georges dolisi Physiologie renale
Physiologie renale Simultankontrast physiologie
Simultankontrast physiologie Glandes conglomérées
Glandes conglomérées Physiologie des noyaux gris centraux
Physiologie des noyaux gris centraux Escola onze de setembre sant quirze
Escola onze de setembre sant quirze Sustantivo compuesto de papeles
Sustantivo compuesto de papeles Tms carrefour
Tms carrefour Karate sant cugat
Karate sant cugat Sant submamar harrison
Sant submamar harrison Sant tukaram vidyalaya dehu
Sant tukaram vidyalaya dehu Sant pere del vatica
Sant pere del vatica Sant'agostino chi canta prega due volte
Sant'agostino chi canta prega due volte Sappey veni
Sappey veni Sant'agostino prove dell'esistenza di dio
Sant'agostino prove dell'esistenza di dio Escola els quatre vents sant jaume dels domenys
Escola els quatre vents sant jaume dels domenys Sides sante
Sides sante Istituto comprensivo eduardo de filippo
Istituto comprensivo eduardo de filippo Sant'ivo compuesto
Sant'ivo compuesto Sant eller falskt om världen
Sant eller falskt om världen Collegio sant antonio
Collegio sant antonio Lopco
Lopco Peritoneovenöz şant
Peritoneovenöz şant Ic de filippo sant'egidio
Ic de filippo sant'egidio Escola les roquetes sant pere de ribes
Escola les roquetes sant pere de ribes Escola la floresta
Escola la floresta Direttore dipartimento pediatria sant' orsola
Direttore dipartimento pediatria sant' orsola Quercus sant joan de vilatorrada
Quercus sant joan de vilatorrada Varahamihira information
Varahamihira information Intranet sant'andrea
Intranet sant'andrea Centrale elettrica sant'elia
Centrale elettrica sant'elia Miracle of the repentant son
Miracle of the repentant son Wood downes ferres
Wood downes ferres