LP 8 A Trng THCS Trng An Gio














- Slides: 17

LỚP 8 A – Trường : THCS Tràng An Giáo viên : Nguyễn Thị Hồng Lê


Thí nghiệm: Cách tiến hành : - Lấy khoảng 4 ml dung dịch Bariclorua (Ba. Cl 2), và Natrisunphat (Na 2 SO 4) cho lần lượt vào ống nghiệm 1 và 2 - Đặt 2 ống nghiệm vào cốc và cho lên đĩa cân A. - Đặt các quả cân ở đĩa cân B sao cho kim cân thăng bằng - Đổ ống nghiệm (2) chứa dung dịch Natri sunfat (Na 2 SO 4) vào ống nghiệm (1) chứa dung dịch Bari clorua (Ba. Cl 2), rồi lắc cho hai dung dịch trộn lẫn vào nhau. - Quan sát và trả lời các câu hỏi.

Trước thí nghiệm (Ban đầu). Sau thí nghiệm.

Thảo luận nhóm : 1. Có phản ứng hóa học xảy ra không? Nếu có thì dựa vào dấu hiệu nào? * Có phản ứng hóa học xảy ra. - Dấu hiệu: Có chất rắn màu trắng xuất hiện, đó là bari sunfat(Ba. SO 4), chất này không tan. 2. Biết sau phản ứng tạo ra hai chất mới là: Bari sunfat và Natri clorua. Hãy viết phương trình chữ của phản ứng? *Phương trình chữ của phản ứng: Bari clorua + Natri sunfat Bari sunfat + Natri clorua

Trước thí nghiệm (Ban đầu). Sau thí nghiệm.

Lô-mônô-xôp (1711 -1765) La-voa-diê (1743 -1794) Hai nhà khoa học Lô-mô-nô-xôp (người Nga) và Lavoa-diê (người Pháp) đã tiến hành độc lập với nhau những thí nghiệm được cân đo chính xác, từ đó phát hiện ra định luật Bảo toàn khối lượng.

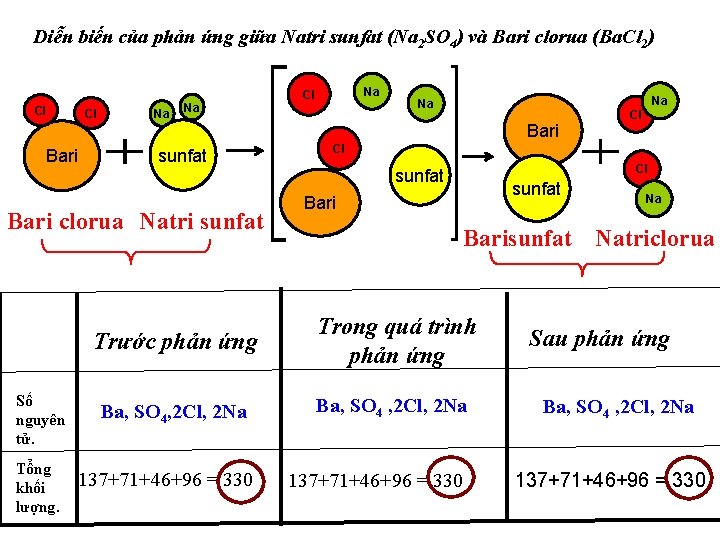
Diễn biến của phản ứng giữa Natri sunfat (Na 2 SO 4) và Bari clorua (Ba. Cl 2) Cl Cl Na Na Na Cl Na Bari sunfat Bari clorua Natri sunfat Số nguyên tử. Tổng khối lượng. Cl Cl sunfat Bari Na Barisunfat Natriclorua Trước phản ứng Trong quá trình phản ứng Ba, SO 4, 2 Cl, 2 Na Ba, SO 4 , 2 Cl, 2 Na 137+71+46+96 = 330 Na Cl 137+71+46+96 = 330 Sau phản ứng Ba, SO 4 , 2 Cl, 2 Na 137+71+46+96 = 330

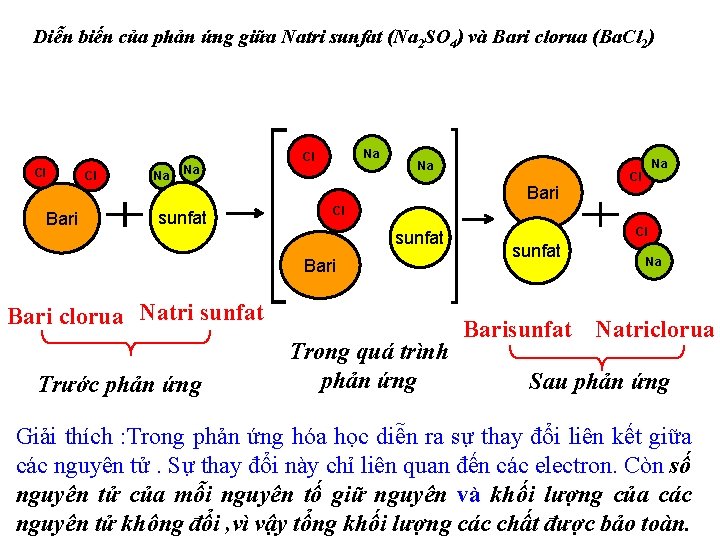
Diễn biến của phản ứng giữa Natri sunfat (Na 2 SO 4) và Bari clorua (Ba. Cl 2) Cl Cl Na Na Na Cl Na Bari sunfat Cl Cl sunfat Bari clorua Natri sunfat Trước phản ứng Na Trong quá trình phản ứng Cl sunfat Na Barisunfat Natriclorua Sau phản ứng Giải thích : Trong phản ứng hóa học diễn ra sự thay đổi liên kết giữa các nguyên tử. Sự thay đổi này chỉ liên quan đến các electron. Còn số nguyên tử của mỗi nguyên tố giữ nguyên và khối lượng của các nguyên tử không đổi , vì vậy tổng khối lượng các chất được bảo toàn.

Nếu áp dụng định luật bảo toàn khối lượng vào phản ứng của thí nghiệm trên, ta sẽ có biểu thức khối lượng nào? *Phương trình chữ của phản ứng: Bari clorua + Natri sunfat Bari sunfat + Natri clorua *Biểu thức về khối lượng: m. Bari clorua + m. Natri sunfat = m. Bari sunfat + m. Natri clorua Theo biểu thức của định luật bảo toàn khối lượng, ta sẽ tính được khối lượng của một chất còn lại nếu biết khối lượng của những chất kia.

* Áp dụng: Bài tập 1: Đốt cháy hoàn toàn 3, 1 gam phot pho trong không khí, ta thu được 7, 1 gam hợp chất đi photpho pentaoxit(P 2 O 5). a. Viết phương trình chữ của phản ứng. b. Tính khối lượng oxi đã tham gia phản ứng. Bài làm Tóm tắt: m. Phot pho=3, 1 g mĐiphotpho pentaoxxit= 7, 1 g moxi= ? a. Phương trình chữ của phản ứng: Photpho + oxi to Điphotpho pentaoxit b. Viết biểu thức định luật bảo toàn khối lượng : m photpho + m oxi => m oxi = m điphotpho pentaoxit - m photpho Vậy khối lượng của oxi tham gia phản ứng là : m oxi = 7, 1 – 3, 1 = 4 (g)

Bài tập 2: Đốt cháy sắt cần dùng 64 gam khí oxi. Thu được sản phẩm là oxit sắt từ nặng 232 gam a)Viết phương trình chữ của phản ứng. b)Tính khối lượng của sắt đã dùng. Bài làm Tóm tắt: m. Oxit sắt từ=232 g m oxi= 64 g a. Viết PT chữ? b. m. Sắt= ? a. Phương trình chữ của phản ứng: Sắt + oxi to Oxit sắt từ b. Viết biểu thức định luật bảo toàn khối lượng: m sắt + m oxi = m oxísắttừ =>m sắt= m oxítsắttừ - m oxi Vậy khối lượng của sắt đã dùng là : m Sắt = 232 - 64 = 168(g)

PHƯƠNG PHÁP Giải bài toán theo 3 bước cơ bản sau: Bước 1: Viết phương trình ( chữ ) của phản ứng hóa học: A + B C + D Bước 2: Áp dụng định luật bảo toàn khối lượng viết biểu thức về khối lượng của các chất trong phản ứng: m. A + m. B = m. C + m. D Bước 3: Tính khối lượng của chất cần tìm m. A = (m. C + m. D ) - m. B Kết luận

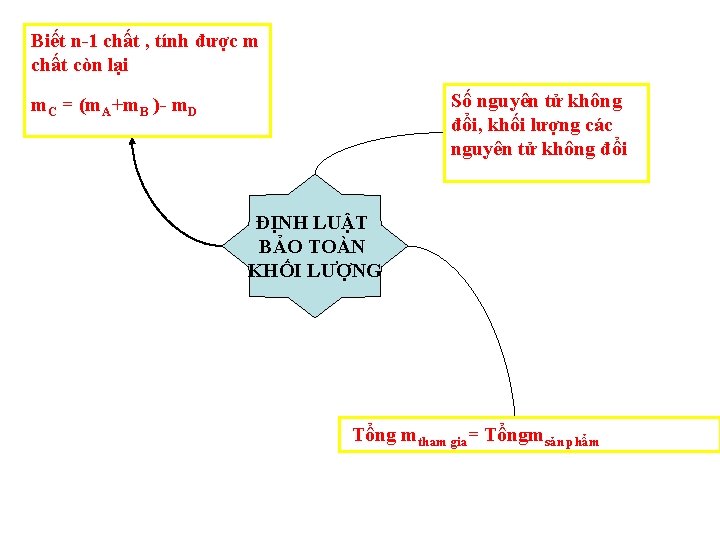
Biết n-1 chất , tính được m chất còn lại Số nguyên tử không đổi, khối lượng các nguyên tử không đổi m. C = (m. A+m. B )- m. D ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG Tổng mtham gia= Tổngmsản phẩm

*HƯỚNG DẪN VỀ NHÀ. - Học bài , làm bài tập SGK + SBT. - Xem lại cách làm các bài tập trên lớp để vận dụng làm bài tập về nhà. - Đọc trước bài “ Phương trình hóa học”. - Xem lại phản ứng giữa khí oxi với khí hiđro.

Chúc các thầy cô và các em học sinh mạnh khỏe, hạnh phúc !

* Áp dụng: Bài 2 : SGK- T 54: Trong phản ứng hóa học ở thí nghiệm trên, cho biết khối lượng của natri sunfat (Na 2 SO 4) là 14, 2 gam, khối lượng của các sản phẩm: bari sunfat (Ba. SO 4) là 23, 3 gam, natri clorua (Na. Cl) là 11, 7 gam. Hãy tính khối lượng của Bari clorua (Ba. Cl 2) đã phản ứng. Bài làm *Phương trình chữ của phản ứng: Tóm tắt: Bari clorua +Natri sunfat Bari sunfat +Natri clorua m. Natrisunfat =14, 2 g * Theo định luật bảo toàn khối lượng ta có: m. Barisunfat= 23, 3 g m. Bariclorua+ m Natrísunfat = m Barísunfat + m Naclorua m. Natriclua=11, 7 g m. Bariclorua= ? m. Bariclorua = (m Barisunfat + m Ntriclorua ) - m Natrisunfat * Vậy khối lượng của Bariclorua đã phản ứng là : => m Bariclorua = (23, 3 + 11, 7) - 14, 2 = 20, 8 (g)