LP 10 L KNH CHO QU THY C














- Slides: 22

LỚP 10 LÝ KÍNH CHÀO QUÝ THẦY CÔ GIÁO Giáo viên: Phạm Thị Thu Thảo Trường THPT Chuyên LQĐ Năm học 2019 -2020

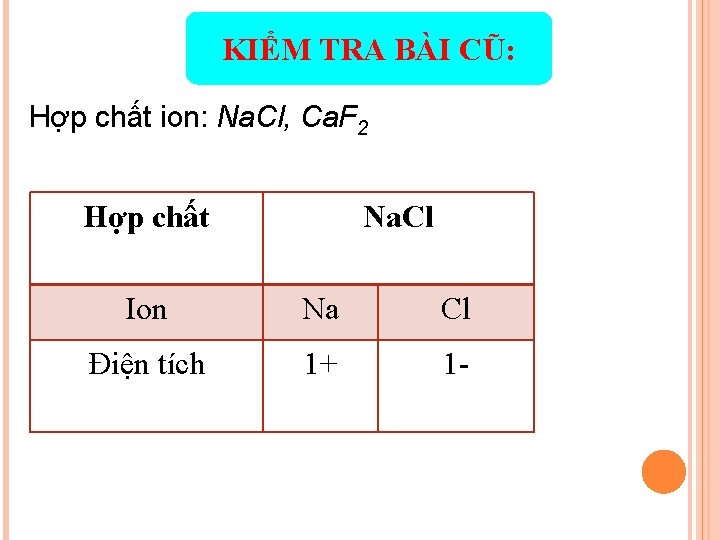
KIỂM TRA BÀI CŨ: Trong các hợp chất sau đây: Na. Cl, H 2 O. - Hợp chất nào là hợp chất ion? Xác định điện tích các ion trong các hợp chất đó. - Hợp chất nào là hợp chất cộng hóa trị? Viết công thức cấu tạo của hợp chất đó.

KIỂM TRA BÀI CŨ: Hợp chất ion: Na. Cl, Ca. F 2 Hợp chất Na. Cl Ion Na Cl Điện tích 1+ 1 -

KIỂM TRA BÀI CŨ: - Hợp chất cộng hóa trị: H 2 O H-O-H

Bài 16: HÓA TRỊ VÀ SỐ OXI HÓA

NỘI DUNG BÀI HỌC I. HÓA TRỊ II. SỐ OXI HÓA III. BÀI TẬP VẬN DỤNG

HÓA TRỊ TRONG HỢP CHẤT ION ĐIỆN HÓA TRỊ TRONG HỢP CHẤT CỘNG HÓA TRỊ

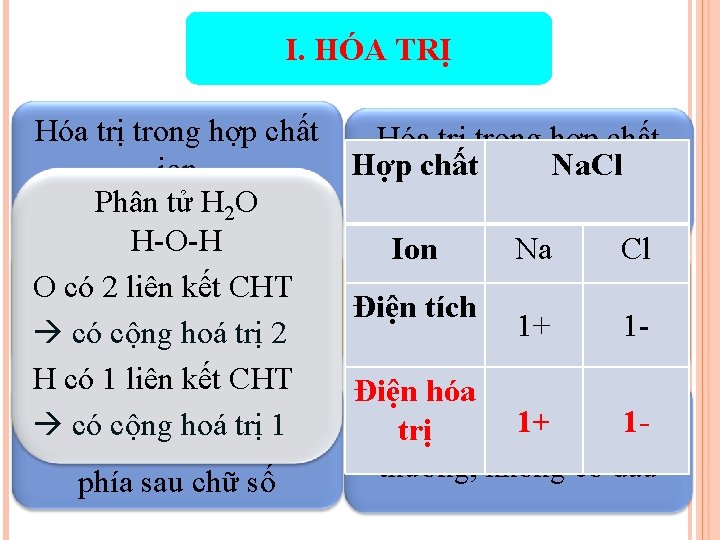
I. HÓA TRỊ Hóa trị trong hợp chất Hợp chất Na. Clhóa ion cộng hóa trị (cộng Phân tử (điện hóa. Htrị) 2 O trị) H-O-H Ion Na Cl O có 2 liên kết CHT Bằng số liên kết cộng Bằng điện tích của ion Điện tích 1 hóa 1+ trị có cộng hoá trị 2 H có 1 liên kết CHT Điện hóa Biểu diễn: chữ số 1+chữ số 1 có cộng hoá trị 1 Biểu diễn: trị thường, có dấu (+/-) thường, không có dấu phía sau chữ số

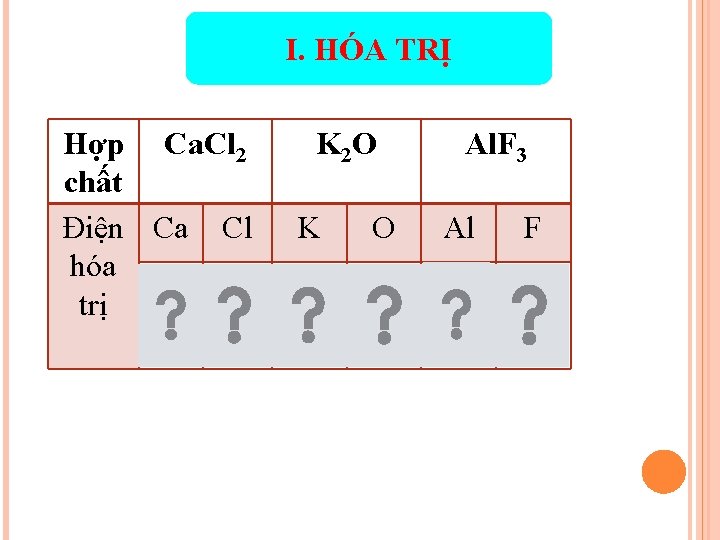
I. HÓA TRỊ Hợp Ca. Cl 2 chất Điện Ca Cl hóa trị 2+ 1 - K 2 O Al. F 3 K O Al F 1+ 2 - 3+ 1 -

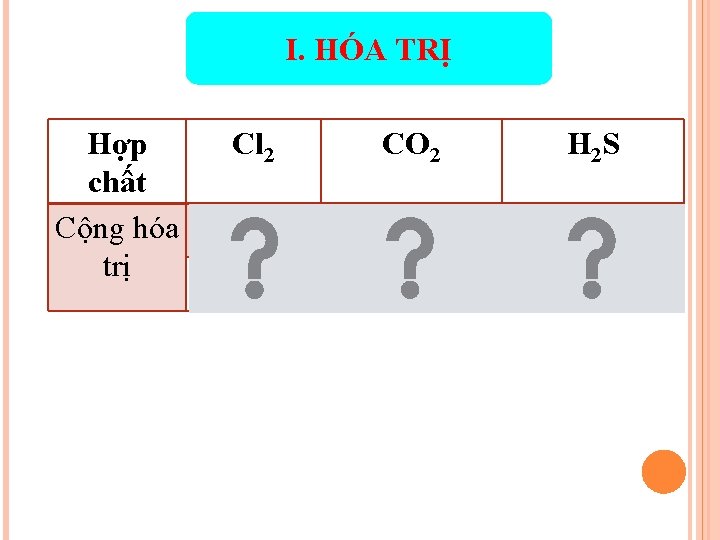
I. HÓA TRỊ Hợp chất Cộng hóa trị Cl 2 CO 2 H 2 S Cl C O H S 1 4 2 1 2

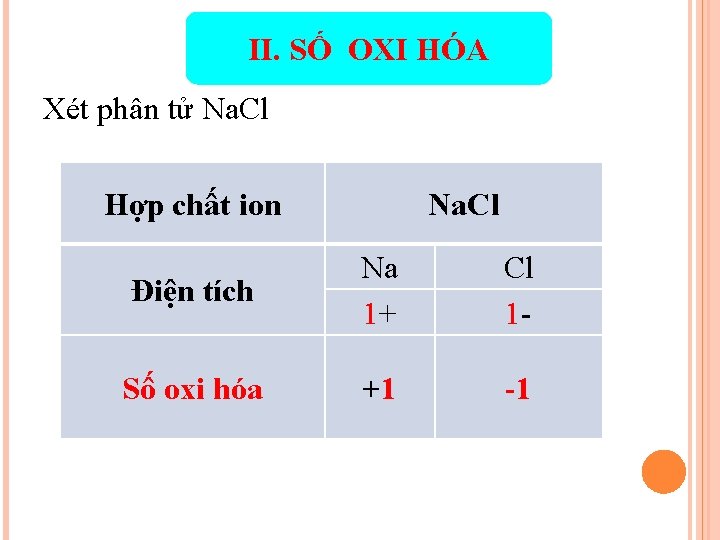
II. SỐ OXI HÓA Xét phân tử Na. Cl Hợp chất ion Na. Cl Điện tích Na 1+ Cl 1 - Số oxi hóa +1 -1

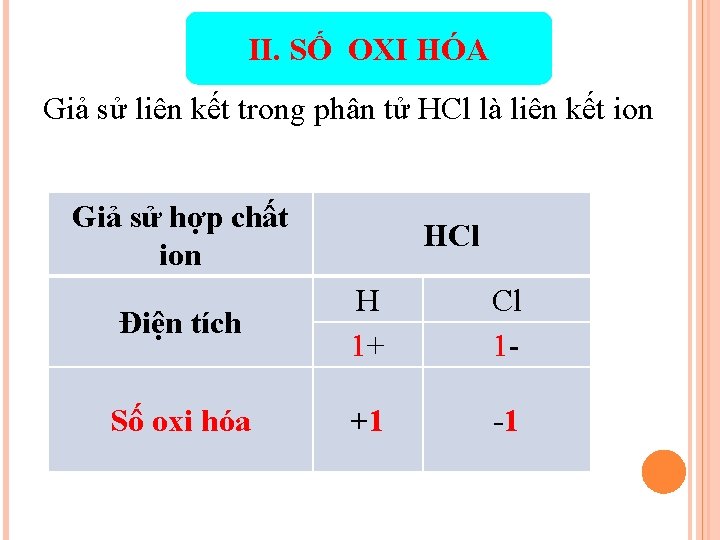
II. SỐ OXI HÓA Giả sử liên kết trong phân tử HCl là liên kết ion Giả sử hợp chất ion HCl Điện tích H 1+ Cl 1 - Số oxi hóa +1 -1

II. SỐ OXI HÓA Khái niệm: Nếu giả định rằng liên kết của các nguyên tử trong phân tử là liên kết ion, thì số oxi hóa là điện tích của nguyên tử nguyên tố đó trong phân tử.

II. SỐ OXI HÓA Cách biểu diễn: Chữ số thường, có dấu (+/-) trước chữ số, đặt phía trên kí hiệu nguyên tố. -3 +3 N Al

II. SỐ OXI HÓA Quy tắc 1: 0 0 Đơn chất Na; Al; H 2; O 2 Quy tắc 2: Trong hầu hết các hợp chất +1 -2 H, O Trừ hợp chất hiđrua kim loại: Na. H, Ca. H 2…. Trừ hợp chất OF 2; peoxit: H 2 O 2, K 2 O 2…, supeoxit: KO 2 , Na. O 2….

II. SỐ OXI HÓA Quy tắc 3: Ion: Na+; Fe 3+; +1 S 2 - +3 Số oxi hóa: Na Fe -2 S Ion: NH 4+ H có số oxi hoá +1, gọi số oxi hóa của N là x, ta có x + 4 * (+1) = +1 x = -3 -3 +1 NH 4+

II. SỐ OXI HÓA Quy tắc 4: Phân tử: +1 -2 H 2 O (+1) * 2 + (-2) = 0 x -2 Fe 2 O 3 x * 2 + (-2) * 3 = 0 x = +3

II. SỐ OXI HÓA

III. VẬN DỤNG – CỦNG CỐ Xác định hóa trị và số oxi hóa Hợp N 2 Al 2 O 3 CH 4 chất Điện hóa trị Cộng hóa trị Số oxi hóa KBr

III. VẬN DỤNG – CỦNG CỐ Trong các hợp chất: KMn. O 4; Mn. O 2; Mn. SO 4; K 2 Mn. O 4 số oxi hóa của Mn lần lượt là: A. +1 , +3 , +6 , +5 B. +3, +4 , +2 , +6 C. +7 , +4 , +2, +6 D. +5 , +6 , +3 , +7

III. VẬN DỤNG – CỦNG CỐ Xác định số oxi hóa của N và Cl trong các hợp chất sau: N 2 O 3, NH 3, N 2 H 4, NH 4 NO 3 KCl, KCl. O 3, Ca. OCl 2

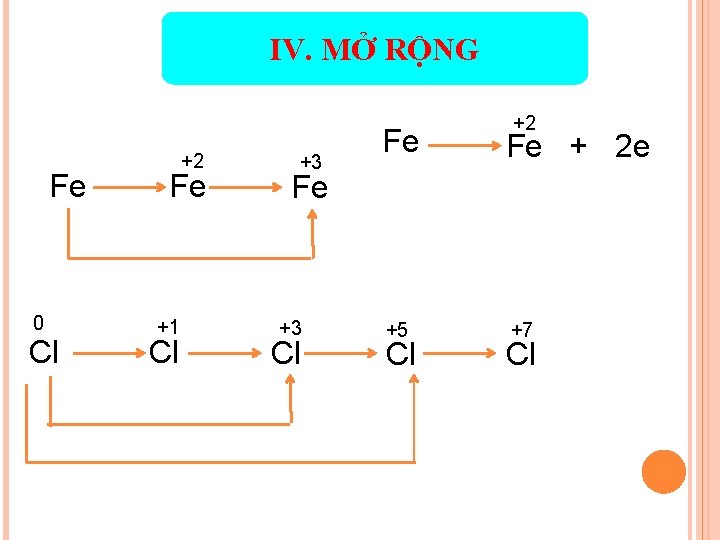
IV. MỞ RỘNG Fe 0 Cl +2 Fe +1 Cl +3 +2 Fe Fe + 2 e +5 +7 Fe +3 Cl Cl Cl