Los elementos qumicos Sustancias puras que no pueden



















- Slides: 24

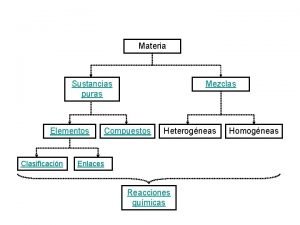
Los elementos químicos

Sustancias puras que no pueden dividirse en otras más simples Hierro cobre Plata Oro del latín aurum, aurora brillante

Los nombres de los elementos • En función de sus caracteres organolépticos o propiedades físicas: CLORO (Cl) PLOMO (Pb) del griego chloros, de color amarillo verdoso MERCURIO (Hg) del latín hidrargirium, plata liquida del latín plumbum, pesado

• En función de sus propiedades químicas: AZUFRE (S) FOSFORO (P) del sancrito sulphur, indica que altera al cobre del griego phosphoros, portador de luz HIDROGENO (H) del griego hydro gen, formador de agua

• Denominados en honor a destacados científicos: MENDELEVIO (Md) CURIO (Cm) Dimitri Ivanovich Mendeleiev EINSTENIO (Es) de Albert Einstein de Marie y Pierre Curie

• En homenajes a ciertos países o regiones geográficas: POLONIO (Po) de Polonia, país natal de Marie Curie GALIO (Ga) MAGNESIO (Mg) de Galia, antiguo nombre de Francia de Magnesia, antigua ciudad de Asia Menor

Con nombres vinculados a la mitología TANTALIO (Ta) NIOBIO (Nb) de Tántalo, mítico rey griego VANADIO (V) de Niobe, hija de Tántalo de Vanadis, diosa escandinava

Los seres vivos estamos formados por elementos Carbono Hidrogeno Oxigeno Nitrógeno

Pues bien, los millones de sustancias diversas, cada una con propiedades especificas que la caracterizan y permiten su identificación, son producto de la combinación de una cantidad reducida de elementos diferentes. Cada elemento corresponde a un tipo especial de átomo. Hasta ahora existen 112 elementos perfectamente identificables por el nombre. De ellos, 92 son naturales, esto significa que se encuentran en la naturaleza como tales, y el resto se ha sido obtenido por los científicos mediante técnicas de laboratorio, es decir son artificiales.

Como se distinguen los distintos elementos Cada elemento corresponde a un tipo especial de átomo. Los átomos se distinguen por su numero de protones presentes en el nucleo NUMERO ATOMICO (Z) hidrogeno Litio Helio 1 protón 2 protones 3 protones

En el núcleo junto con los protones también coexisten los neutrones. NUMERO MASICO (A) Numero de protones mas el de neutrones Z=1 A=1 hidrogeno Z=1 A=2 Deuterio ISOTOPOS Z=1 A =3 Tritio

Como ordenamos a los elementos químicos Dimitri Ivanovitch Mendeleiev (1834 - 1907) Las propiedades químicas de los elementos no son arbitrarias, sino que varían de acuerdo con la masa atómica de una manera periódica. En la actualidad, se considera que varían de acuerdo con el numero atómico. La versión moderna de la tabla periódica de los elementos consiste en el ordenamiento de los 112 elementos conocidos por numero atómicos creciente, en siete filas (periodos) y dieciocho columnas (familias o grupos), de tal forma que los elementos con propiedades análogos quedan encolumnadas. Los elementos de cada grupo tienen características parecidas y las propiedades de los elementos de un periodo cambian gradualmente.


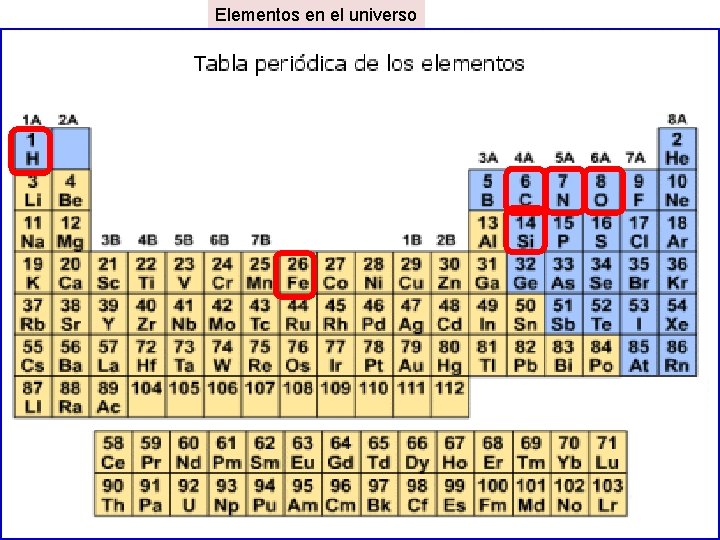
Elementos en el universo

Elementos en la materia viva

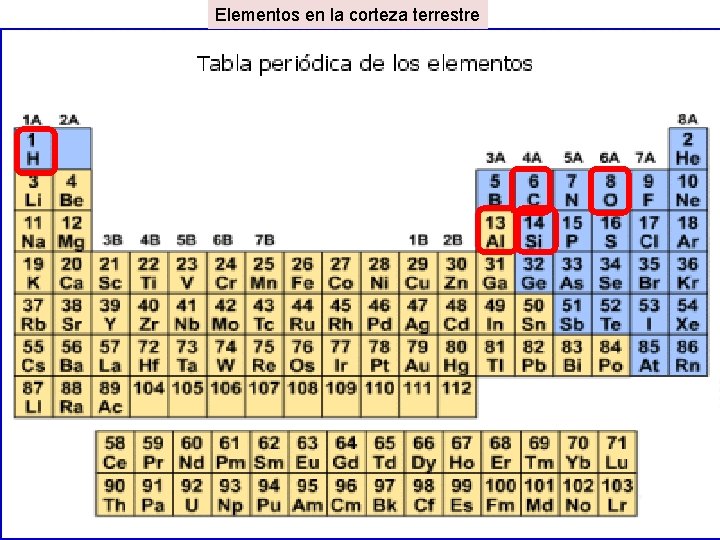
Elementos en la corteza terrestre

Entendiendo la tabla periódica IA VIII A IV A VII A Periodo Grupo

Entendiendo la tabla periódica Metaloides No Metales

Entendiendo la tabla periódica Metales Alcalinos térreos Elementos representativos Halógenos Elementos de transición Metales alcalinos Elementos de transición interna Gases nobles

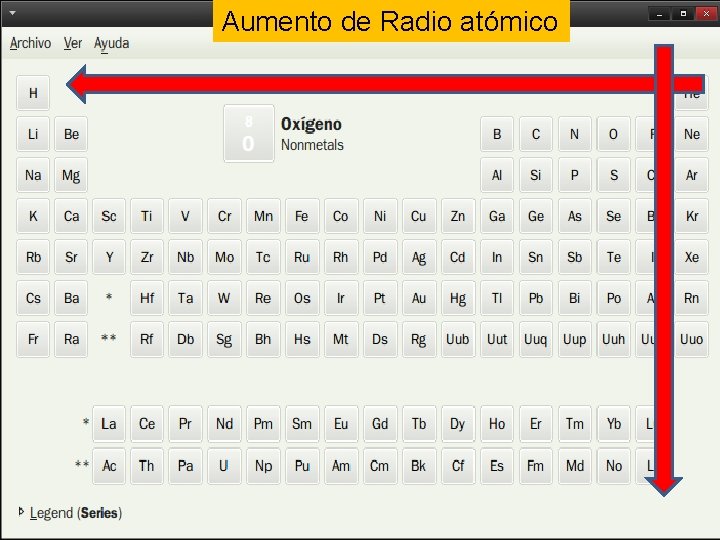
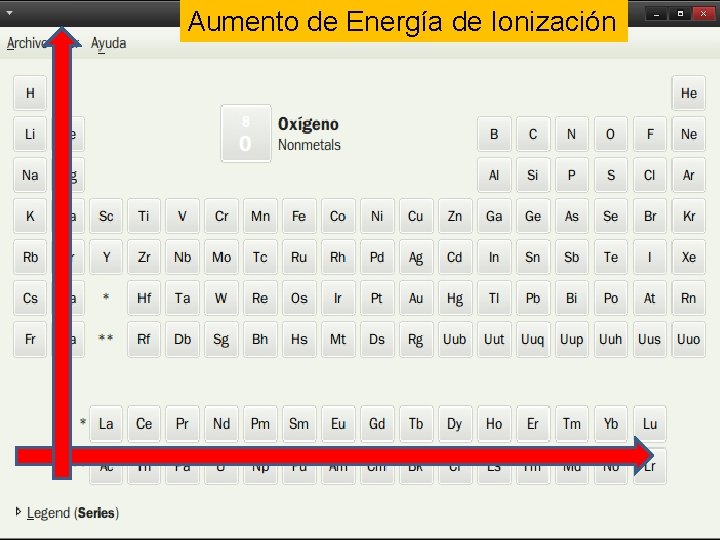
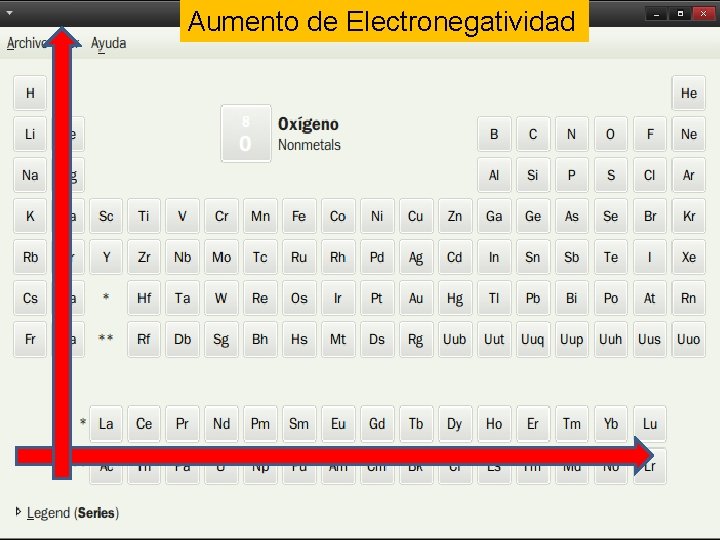
Propiedades periódicas Radio atómico Es la distancia que separa el electrón mas externo del núcleo Energía de ionización Es la energía necesaria para arrancar un electrón de un átomo neutro, gaseoso y en su estado fundamental Afinidad electrónica Es la energía necesaria para captar un electrón Electronegatividad Es la capacidad relativa de un átomo para atraer hacia sí los electrones de un enlace químico con otro átomo

Aumento de Radio atómico

Aumento de Energía de Ionización

Aumento de Afinidad electrónica

Aumento de Electronegatividad
 Sustancia puras elementos
Sustancia puras elementos Es la unión física de dos o más elementos o compuestos
Es la unión física de dos o más elementos o compuestos El yogur con frutas es una mezcla homogénea o heterogénea
El yogur con frutas es una mezcla homogénea o heterogénea Diagrama t-v de una sustancia pura
Diagrama t-v de una sustancia pura Site:slidetodoc.com
Site:slidetodoc.com Organizador grafico de sustancias puras y mezclas
Organizador grafico de sustancias puras y mezclas Vapor saturado
Vapor saturado Actividades de sustancias puras y mezclas
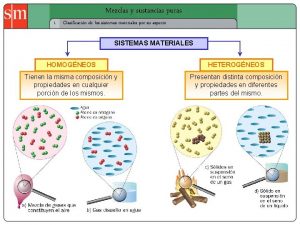
Actividades de sustancias puras y mezclas Sistema material
Sistema material Sustancia cobre
Sustancia cobre Sustancias puras
Sustancias puras Sustancias puras
Sustancias puras Mezclas homogeneas
Mezclas homogeneas Conjuntos por extensión
Conjuntos por extensión Porque los sacerdotes pueden perdonar los pecados
Porque los sacerdotes pueden perdonar los pecados Permutaciones de 3
Permutaciones de 3 Oracion para los que no pueden comulgar
Oracion para los que no pueden comulgar Con que criterios se pueden clasificar los mercados
Con que criterios se pueden clasificar los mercados Contratansporte
Contratansporte Que sustancias transporta el transporte activo
Que sustancias transporta el transporte activo Cotransporte o simporte
Cotransporte o simporte Conjunciones
Conjunciones Dibujos de espejos planos y curvos
Dibujos de espejos planos y curvos De cuantas formas pueden colocarse los 11 jugadores
De cuantas formas pueden colocarse los 11 jugadores Los tiburones pueden ser grandes predadores
Los tiburones pueden ser grandes predadores