LORRAINECHAMPAGNE tude de limpact du type de plasma
















- Slides: 18

LORRAINE-CHAMPAGNE Étude de l’impact du type de plasma utilisé sur l’évolution clinique des patients atteints de purpura thrombotique thrombocytopénique (PTT) traités par échanges plasmatiques Étude observationnelle de cohorte, rétrospective, multicentrique, nationale du 1 er janvier 2000 au 30 juin 2010

Étude collaborative EFS/ Centre National de Référence des MAT Étude coordonnée par EFS Lorraine Champagne Investigateur Coordonnateur : Dr Thierry SCHNEIDER, Directeur EFS Lorraine Champagne Co-Investigateur Coordonnateur, Dr Suzanne MATHIEU-NAFISSI, Unité d'hémaphérèse thérapeutique Directeur scientifique EFS LC Pr Thomas LECOMPTE, Service d'Hématologie Biologique Hôpitaux de Brabois, PU-PH 47 -01 Faculté de Médecine Nancy Université (UHP) Inserm U 961 Responsable scientifique, Dr Marie TOUSSAINT-HACQUARD, Service d'Hématologie Biologique Hôpitaux de Brabois / EFS LC Attachée de Recherche Clinique, Lysiane CHEVREUX, EFS Lorraine champagne CNR-MAT Coordonnateur : Professeur Paul Coppo Hôpital Saint Antoine - Assistance publique - Hôpitaux de Paris Service d'hématologie clinique Professeur Agnès Veyradier Hôpital Antoine Béclère - Assistance publique - Hôpitaux de Paris Service d'hématologie biologique, INSERM U 770 Technicienne de recherche clinique : Sandrine Malot Centre d’Epidémiologie Clinique, CIC-EC Inserm, Service d’Epidémiologie et Evaluation Clinique, CHU de Nancy Méthodologie, Pr Francis GUILLEMIN, Ensemble des centres de compétence Ensemble des centres de soin

Contexte scientifique (1/2) Traitement de référence du PTT = échanges plasmatiques Efficacité démontrée avec du plasma frais congelé sécurisé (Rock et al. 1991 ; Henon P. 1992 ; Coppo et al. 2003) Depuis Septembre 2008, en France, utilisation quasi-exclusive de plasmas thérapeutiques viro-atténués

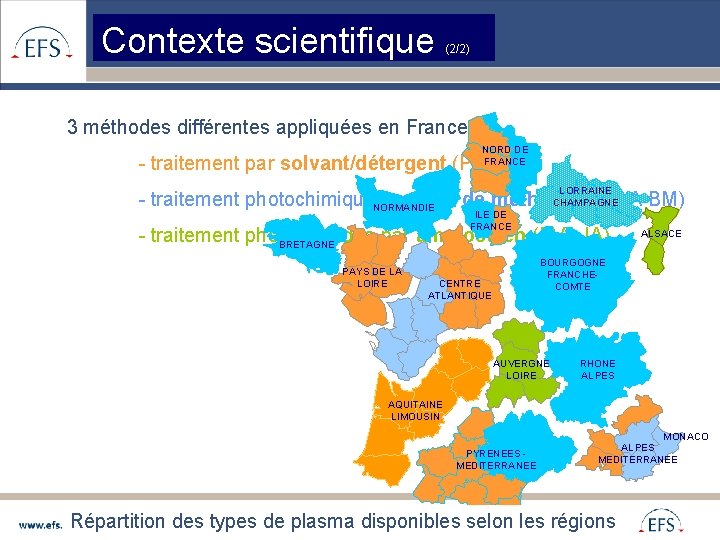
Contexte scientifique (2/2) 3 méthodes différentes appliquées en France : NORD DE FRANCE - traitement par solvant/détergent (PVA SD) LORRAINE CHAMPAGNE - traitement photochimique. NORMANDIE par bleu de méthylène (PVA BM) ILE DE FRANCE - traitement photochimique par amotosalen (PVA IA) BRETAGNE PAYS DE LA LOIRE ALSACE BOURGOGNE FRANCHECOMTE CENTRE ATLANTIQUE AUVERGNE LOIRE RHONE ALPES AQUITAINE LIMOUSIN PYRENEES MEDITERRANEE MONACO ALPES MEDITERRANEE Répartition des types de plasma disponibles selon les régions

Contexte scientifique (2/2) Existe-t-il des différences entre les préparations disponibles en France en terme d’efficacité dans le traitement du PTT ?

Données de la littérature A ce jour: aucune étude clinique randomisée en double aveugle comparant l’efficacité de ces trois plasmas dans le traitement du PTT Données disponibles: • petites séries de patients avec des critères d’efficacité variables selon les études et puissance statistique insuffisante pour conclure (Brunskill et al. 2007) • PVA SD vs PFC Horowitz et al. 1998, essai contrôlé: PVA SD = PFC • PVA IA vs PFC Mintz et al. 2006, étude randomisée contrôlée double aveugle: PVA IA = PFC • PVA BM vs PFC De la Rubia et al. 2001, étude rétrospective monocentrique Alvarez-Larran et al. 2004, étude rétrospective multicentrique Del Rio Garma et al. 2008, étude prospective de cohorte PFC > PVA BM

Données de la littérature Etude Alvarez-Larran et al BJH 2004 Analyse retrospective multicentrique 1990 – 2003 8 hôpitaux Espagne 56 épisodes (43 patients) de PTT idiopathique PVABM (n= 27) vs PFCse (n=29) après 1997 avant 1998 Pas de protocole « standard » de traitement Traitement associés (corticoides, vincristine, splénectomie)

Données de la littérature Etude del Rio Garma et al BJH 2008 Etude prospective de cohorte multicentrique oct 2004 – oct 2007 31 centres Espagne 102 épisodes (90 patients) de PTT idiopathique Traitement protocolisé : PVABM (n= 63) vs PFCse (n=39) [ 1 EP/j avec au moins 30 m. L/kg plasma + 1, 5 mg/kg/j de prednisone jusqu’à remontée de la numération plaquettaire > 150 G/L pendant 3 jours consécutifs puis 1 EP 1 j/2 pendant 1 ou 2 semaine puis arrêt Critère de jugement principal : Statut de rémission atteint au bout de 8 j Critères secondaires : réévolution alors que des EP sont en cours nombre d’échanges volume total de plasma utilisé pour atteindre la rémission.

Problématique Équivalence d’efficacité entre les différents plasmas disponibles ? Etude clinique randomisée en double aveugle permettant de comparer les 3 types de plasmas: pas envisageable actuellement du fait de l’effectif nécessaire et du recrutement possible par rapport à l’incidence de la pathologie Estimation du nombre de sujets nécessaire: entre 600 et 1000 sujets Influence du type de plasma sur le pronostic des patients? Etude observationnelle de cohorte, rétrospective, qui recueillera les données cliniques et biologiques des patients traités pour un PTT entre le 1 er juin 2000 et le 31 mars 2010, sur la base du registre du CNR-MAT

Design de l’étude Il s’agit d’une étude observationnelle de cohorte, rétrospective: • entre le 1 er janvier 2000 et le 31 mars 2010: - permet d’établir une référence historique en terme de délai de réponse avec le PVASD et le PFCse (période 2000 -2008) - évaluer les différents types de PVA (SD, BM, IA) (période 2008 -2010) • Patients de plus de 18 ans traités pour un épisode initial de PTT acquis idiopathique • Recueil des données cliniques et biologiques sur la base du registre du CNR-MAT complété par les données EFS

Objectifs et critères de jugement Objectif principal : Déterminer si le type de plasma utilisé lors des échanges plasmatiques est un facteur prédictif de l’évolution clinique du patient sur la base des critères de jugement suivants : • le délai de réponse au traitement, en considérant comme critère principal la normalisation de la numération plaquettaire (> 150 x 109/L pendant au moins 48 H), • le nombre total d’échanges plasmatiques, • le volume total de plasma, • les taux d’états réfractaires, de ré-évolutivité précoce (< 30 jours) et de rechutes (≥ 30 jours) du PTT

Critères d’inclusion et de non inclusion Inclusion § Homme ou femme d’âge ≥ 18 ans § Episode de PTT acquis idiopathique survenu entre le 1 er janvier 2000 et le 31 mars 2010 Le diagnostic repose sur les signes suivants : anémie hémolytique avec schizocytes, thrombopénie, présence d’auto-Ac anti-ADAMTS 13* et présence ou non de fièvre, d’une atteinte neurologique, d’une atteinte rénale (*): en cas d'absence de dosage d'ADAMTS 13, pour confirmer le diagnostic de PTT acquis idiopathique, il sera possible de prédire l'activité ADAMTS 13 grâce à un score prédictif basé sur la créatinine et la numération plaquettaire Non inclusion §Patient présentant une MAT ou un PTT associé à toutes causes identifiables telles que : une greffe d’organes, une allogreffe de cellules souches hématopoïétiques, un cancer, une CIVD, une HTA maligne, une infection VIH, une grossesse… §Patient présentant anémie hémolytique auto immune (test de Coombs direct positif)

Nombre de patients attendus Effectif attendu (sur la base des données du registre CNR-MAT) pour la période d’étude retenue) 359 patients environ

MODALITÉS DE COLLABORATION ENTRE L’EFS ET LE CENTRE DE REFERENCE MAT - Elaboration d’une liste investigateurs sous forme de binôme Clinicien/Médecin EFS des CDS - Recueil des données complémentaires concernant le plasma dans la base de données préexistante du CNR-MAT - Exploitation statistique en collaboration avec le CIC-EC Nancy sur le site de l’hôpital St-Antoine.

Les données recueillies épisode initial: § les données démographiques § les données cliniques § données biologiques § le traitement instauré au diagnostic § la réponse au traitement § le bilan du traitement par EP § la survenue d’épisodes (ré-évolutivité précoce, rechute, état réfractaire) épisode ultérieur § le type et la date de l’épisode § la réponse au traitement de l’épisode (pour un épisode de ré-évolutivité précoce ou une rechute) § les données biologiques à la survenue de l’épisode § le bilan du traitement de l’épisode

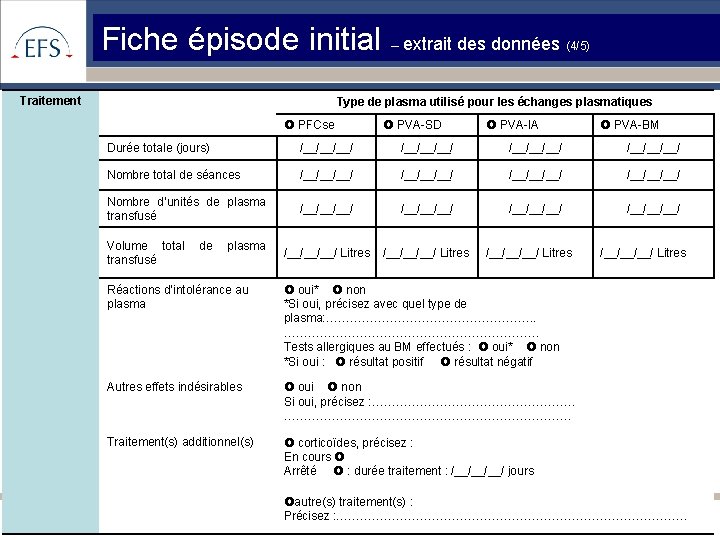
Fiche épisode initial – extrait des données Traitement (4/5) Type de plasma utilisé pour les échanges plasmatiques PFCse PVA-SD PVA-IA PVA-BM Durée totale (jours) /__/__/__/ Nombre total de séances /__/__/__/ Nombre d’unités de plasma transfusé /__/__/__/ /__/__/__/ Litres Volume total transfusé de plasma /__/__/__/ Litres Réactions d’intolérance au plasma oui* non *Si oui, précisez avec quel type de plasma: ………………………. . ……………………………. Tests allergiques au BM effectués : oui* non *Si oui : résultat positif résultat négatif Autres effets indésirables oui non Si oui, précisez : ……………………………………………………………… Traitement(s) additionnel(s) corticoïdes, précisez : En cours Arrêté : durée traitement : /__/__/__/ jours /__/__/__/ Litres autre(s) traitement(s) : Précisez : ………………………………

Règle relative aux communications Tous les investigateurs ayant inclus des patients auront un auteur cité.

Merci d’avance pour votre collaboration