Lois de Pauling Ces rgles permettent de dfinir
















- Slides: 26
Lois de Pauling

Ces régles permettent de définir la stabilité des composés à liaisons ioniques ou iono-covalentes. Dans ces composés, un cation s’entoure d’anions et vice-versa. La distance d’équilibre entre un cation A et un anion B est la distance interatomique. Elle est notée d(A-B) en nm ou en Å (10 -9 et 10 -10 m). On considère des sphères idéales en contact tangentiellement (peu ou pas de recouvrement des orbitales).

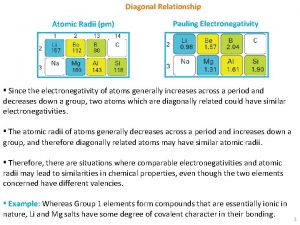
Ces règles ont été codifiées par Linus Pauling, chimiste américain, en 1960. Dans la structure d’un minéral à liaison ionique ou iono-covalente, un certain nombre d’anions va entourer un cation. Comment connaître la valeur de ce nombre? Il dépend de la structure du minérale, mais surtout des rayons ioniques des cations et des anions considérés. Ces rayons dépendent de la taille du noyau et du nombre d’électrons

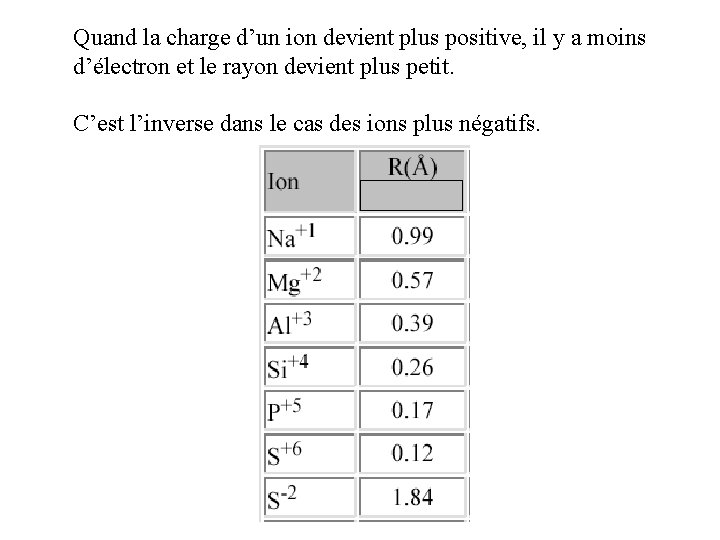
Quand la charge d’un ion devient plus positive, il y a moins d’électron et le rayon devient plus petit. C’est l’inverse dans le cas des ions plus négatifs.

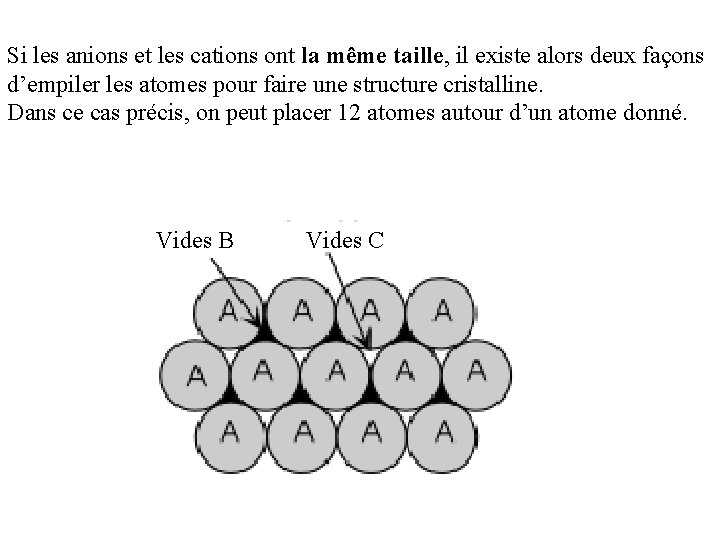
Si les anions et les cations ont la même taille, il existe alors deux façons d’empiler les atomes pour faire une structure cristalline. Dans ce cas précis, on peut placer 12 atomes autour d’un atome donné. Vides B Vides C

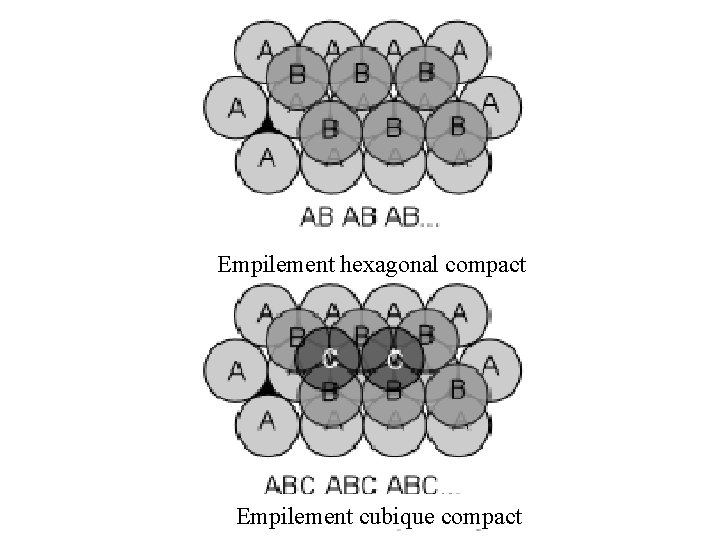
Empilement hexagonal compact Empilement cubique compact

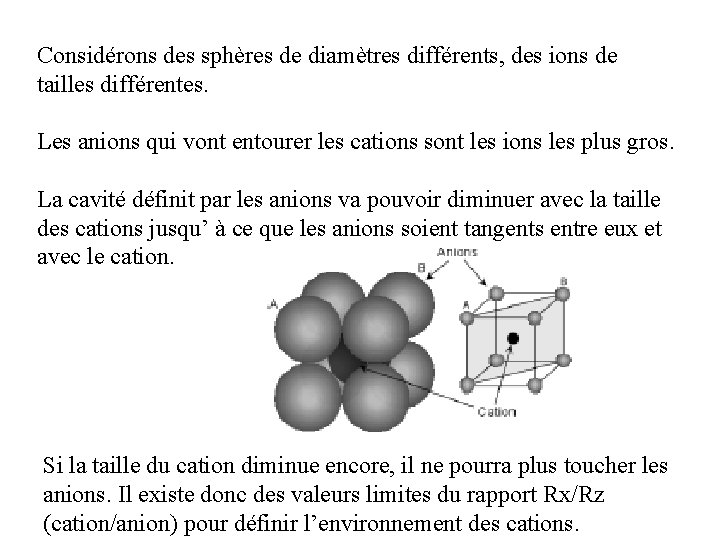
Considérons des sphères de diamètres différents, des ions de tailles différentes. Les anions qui vont entourer les cations sont les ions les plus gros. La cavité définit par les anions va pouvoir diminuer avec la taille des cations jusqu’ à ce que les anions soient tangents entre eux et avec le cation. Si la taille du cation diminue encore, il ne pourra plus toucher les anions. Il existe donc des valeurs limites du rapport Rx/Rz (cation/anion) pour définir l’environnement des cations.

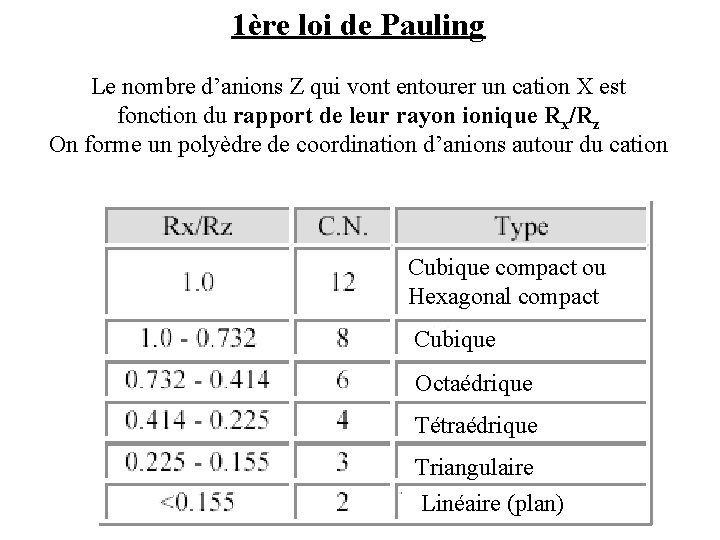
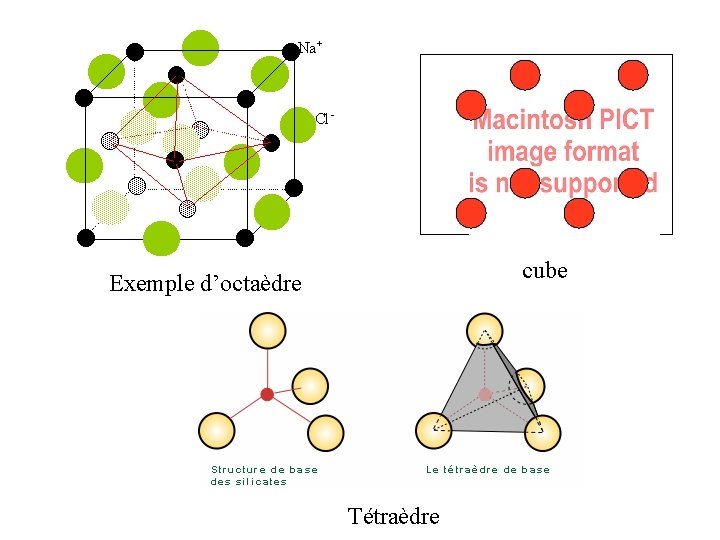
1ère loi de Pauling Le nombre d’anions Z qui vont entourer un cation X est fonction du rapport de leur rayon ionique Rx/Rz On forme un polyèdre de coordination d’anions autour du cation Cubique compact ou Hexagonal compact Cubique Octaédrique Tétraédrique Triangulaire Linéaire (plan)

cube Exemple d’octaèdre Tétraèdre

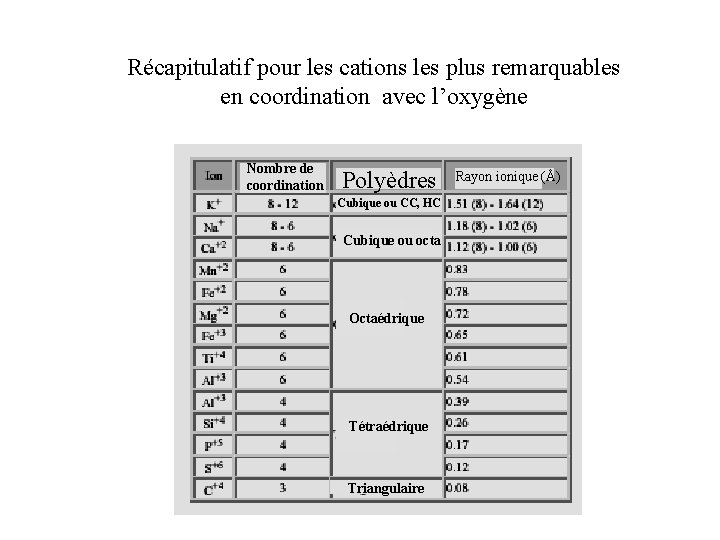
Récapitulatif pour les cations les plus remarquables en coordination avec l’oxygène Nombre de coordination Polyèdres Cubique ou CC, HC Cubique ou octa Octaédrique Tétraédrique Triangulaire Rayon ionique (Å)

2ème loi de Pauling Chaque anion d’une structure minérale (ionique ou iono-covalente) est entouré de cations (et vice versa). Chaque cation va donné une fraction de sa charge (F) pour compenser la charge de l’anion (et vice versa). Pour que la structure soit stable, il faut que la somme des charges fournies par les cations à l’anion qu’ils entourent soit égale à la valence de l’anion (et vice versa). F = Charge(ion) / Nombre de Coordination SF = Valence de l’ion

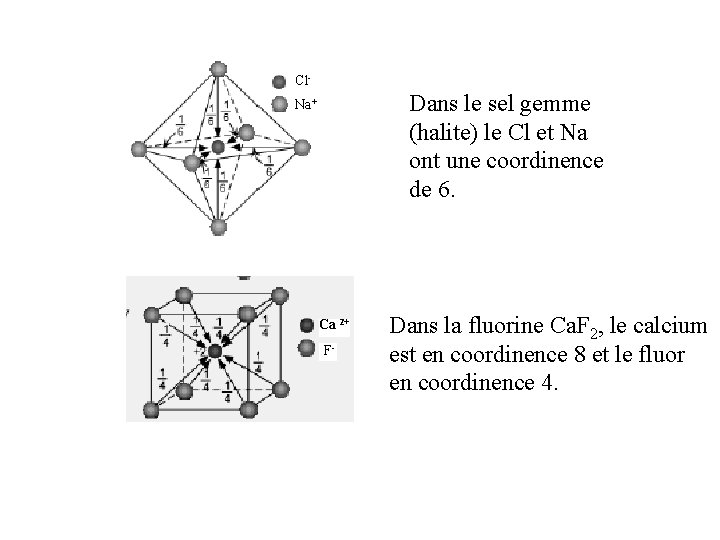
Cl- Dans le sel gemme (halite) le Cl et Na ont une coordinence de 6. Na+ Ca 2+ F- Dans la fluorine Ca. F 2, le calcium est en coordinence 8 et le fluor en coordinence 4.

Exercices 1) Calculer la fraction de charge donnée par les cations suivants connaissant leur rayon ionique pour compenser la charge de l’oxygène (r = 1. 40Å): Li+ Be 2+ Al 3+ Si 4+ Nb 5+ r = 0. 68Å r = 0. 35Å r = 0. 51Å r = 0. 42Å r = 0. 69Å

Exercices 2) Calculer la coordinence du silicium et de l’oxygène dans le quartz (Si. O 2). Quelle est la fraction de charge apportée par le silicium pour compenser la charge de l’oxygène? Schéma de la structure Du quartz alpha (basse T)

Exercices 3) Calculer la coordinence du titane et de l’oxygène dans l’anatase (Ti. O 2). Quelle différence remarquez vous avec Si. O 2? On donne r (Ti 4+) = 0. 68Å On voit à partir des exercices précédents que certains minéraux ne possèdent qu’un seul type d’anion (dans les cas précédents: l’oxygène) pour lequel l’environnement cationique est identique pour tous les anions de la structure. La distribution des charges des cations est unique et tous les anions de la structure sont équivalents.

Exercices Calculer les coordinences des cations dans la structure de l’olivine sous sa forme fayalite et sous sa forme forstérite Données: r. Mg = 0. 66Å r. Fe=0. 74Å r. Si=O. 42Å r 0=1. 40Å

Exercices 4) Le grenat Mn 3 Al 2 Si 3 O 12 est un minéral du manteau qui est stable à haute pression et haute température. Trouver la coordinence des cations et de l’oxygène dans ce minéral Données (mesurés à Temp. Ambiante) : Mn 2+ r = 0. 96Å Al 3+ r = 0. 51Å Si 4+ r = 0. 42Å

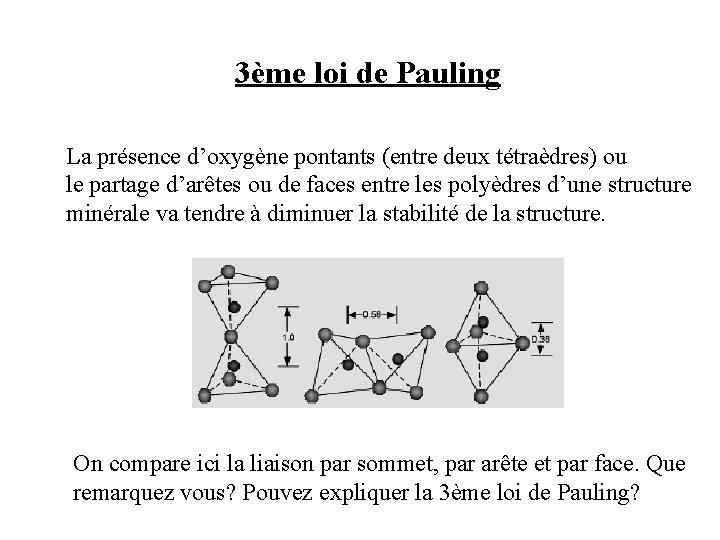
3ème loi de Pauling La présence d’oxygène pontants (entre deux tétraèdres) ou le partage d’arêtes ou de faces entre les polyèdres d’une structure minérale va tendre à diminuer la stabilité de la structure. On compare ici la liaison par sommet, par arête et par face. Que remarquez vous? Pouvez expliquer la 3ème loi de Pauling?

-Les minéraux possédant des oxygènes pontants ou dont les polyèdres partagent des arêtes ou des faces vont avoir un environnement cationique différent pour un même type d’anion. -Les minéraux qui contiennent deux ou plusieurs types d’anions vont avoir des environnements cationiques différents autour des différents types d’anions.

Exercices Oxygène non pontant Oxygène pontant 5) La thorvéitite possèdent un oxygène pontant entre deux tétraèdres de silice et un oxygène non pontant. Quel sont les environnements de ces deux types d’oxygènes? On donne: Sc 3+ r = 0. 81Å Thorvéitite: Sc 2 Si 2 O 7

4ème loi de Pauling Lorsque la charge d’un cation est supérieure ou égale à 4+, les polyèdres qui contiennent ces cations vont se comporter comme des anions indépendants (les polyanions). [Si. O 4]4[PO 4]3[CO 3]2[SO 4]2 - Si 4+ P 5+ C 4+ S 6+ Ces « pseudo-anions » ne sont pas de forme sphérique.

Exercices 6) Quel est l’environnement cationique qui permet de neutraliser la charge de l’oxygène dans Ca. CO 3? Le calcium est en coordinence 6, le carbone en coordinence 3. -Quelle est la coordinence du polyanion [CO 3]2 - ? Calcite Ca. CO 3

Exercices 7) Dans le diopside (Ca. Mg. Si 2 O 6), il existe plusieurs types d’oxygènes notés O (1), O (2) et O (3) suivant leurs environnements. O (1) est lié à 1 silicium, 2 magnésiums et 1 calcium O (2) est lié à 1 silicium, 1 magnésium et 1 calcium O (3) est lié à 2 siliciums et 2 calciums Sachant que le calcium est en site cubique, calculer la compensation de charge apportée par les cations à O (1), O (2) et O (3).

Il arrive que lorsque les environnements d’un même anion dans un minéral sont trop différents, la charge ne puisse pas être compensée localement. Il faut alors considérer une zone plus importante pour que la neutralité soit maintenue (cas du diopside). Dans ces minéraux, on observe que les cations n’occupent pas le centre de leur polyèdre de coordination.

Le postulat de Zachariasen En 1963, Zachariasen montre que pour comprendre un cas comme celui du diopside, il faut prendre en compte une possible distorsion des polyèdres de coordination, donc prendre en compte les variations de distances interatomiques qui ne sont pas considérées dans les lois de Pauling. Il définit donc la fraction de charge donnée par un cation pour compenser la charge d’un anion (et vice versa) comme: Fi = exp [(Rij -dij) / b)] V=SFi Avec Rij la distance interatomique théorique et dij la distance interatomique expérimentale (réelle). B est une constante: b = 0. 37Å

Recalculer la compensation des trois types d’oxygènes dans le diopside en prenant en compte le postulat de Zachariasen on donne: Tableau 1 Distances Si-O(1) Si-O(2) Si-O(3)a Si-O(3)b Mg-O(1)a Mg-O(1)b Mg-O(2) 1. 6Å 1. 59Å 1. 66Å 1. 69Å 2. 12Å 2. 06Å 2. 08Å (Si-O)T = 1. 624Å (Mg-O)T = 1. 693Å (Ca-O)T = 1. 967Å Ca-O(1) Ca-O(2) Ca-O(3)a Ca-O(3)b b=0. 37Å 2. 36Å 2. 35Å 2. 56Å 2. 72Å
 Dfinir
Dfinir Como se calcula el radio ionico
Como se calcula el radio ionico Rezeptionsbeispiele
Rezeptionsbeispiele Diagonales de pauling
Diagonales de pauling Diagrama de pauling
Diagrama de pauling Limiting radius ratio
Limiting radius ratio Linus pauling diagrama
Linus pauling diagrama Pauling's rules for oxoacids
Pauling's rules for oxoacids Loi de pauling
Loi de pauling Defectos superficiales
Defectos superficiales Carga nuclear efetiva tabela
Carga nuclear efetiva tabela Substancies ioniques
Substancies ioniques Linus pauling diagrama
Linus pauling diagrama Programmviren
Programmviren Diagrama de linus pauling
Diagrama de linus pauling Qui sont ces gens
Qui sont ces gens Ces columbus ohio
Ces columbus ohio 341 ces
341 ces Cette
Cette Dans ces murs voués aux merveilles
Dans ces murs voués aux merveilles Funkcja ces
Funkcja ces Ces communications
Ces communications Mrtslk
Mrtslk Webftp2011
Webftp2011 Plan de interventie personalizat ces liceu
Plan de interventie personalizat ces liceu Centralized examination station
Centralized examination station Ces edupack
Ces edupack