LOGO Persamaan Reaksi Irnin Agustina Dwi Astuti M









































- Slides: 42

LOGO Persamaan Reaksi Irnin Agustina Dwi Astuti, M. Pd

Click to edit text styles Contents Edit your company slogan KONSEP MOL RUMUS KIMIA PERSAMAAN REAKSI Jenis – Jenis Reaksi Kimia

Konsep Mol § Satuan jumlah zat dalam ilmu kimia disebut mol. § 1 mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C– 12, yaitu 6, 0221367 × 1023 partikel. Jumlah partikel ini disebut sebagai bilangan Avogadro (L). § 1 mol atom = L buah atom, massanya = Ar atom tersebut. 1 molekul = L buah molekul massanya = Mr molekul tersehut

Massa Molar Massa 1 mol zat dinyatakan dalam gram Contoh: 1 mol Fe Ar = 56 massa = 56 g 2 mol H 2 O Mr = 18 Massa = 36 g

Massa atom relatif dan massa molekul relatif § Untuk atom • Untuk senyawa

Volume Molar Gas § Pada Keadaan Standar (STP) Dari eksperimen, 1 L O 2 (g) pada suhu 0 o. C dan 1 atm mempunyai massa = 1, 429 gram, jadi dalam 1 L O 2 terdapat = 0, 04466 mol O 2. Jadi, 1 mol O 2 mempunyai volume 1/0, 04466 x 1 L = 22, 4 L Sehingga Rumus umum: Volume gas X = mol X x 22, 4 L

Volume Molar Gas § Pada Keadaan tidak standar P V = n R T Ket: P : Tekanan (atm) V : Volume (L) n : mol gas R : Tetapan gas 0, 082 L. atm/mol. K T : Suhu (Kelvin)

Hubungan Mol dengan Jumlah Partikel X = n x 6, 02 x 1023 § Keterangan : n = jumlah mol X = jumlah partikel § 1 mol besi (Fe) mengandung 6, 02 × 1023 atom besi (partikel unsur besi adalah atom) § 5 mol CO 2 mengandung 5 × 6, 02 × 1023 = 3, 01 × 1024 molekul CO 2 § 1 mol Na+ mengandung 6, 02 × 1023 ion Na+ (partikel ion Na+ adalah ion)

Hubungan Mol dengan Volume Gas V = n x 22, 4 L Keterangan : n = jumlah mol v = Volume gas

Hubungan Mol dengan Massa M = mol x mr Ket: M= Massa Mr = Molekul relatif

Rumus Kimia § menunjukkan jenis atom unsur dan jumlah relatif masing-masing unsur yang terdapat dalam zat. Banyaknya unsur yang terdapat dalam zat ditunjukkan dengan angka indeks § Dapat berupa rumus empiris dan rumus molekul § Konsep mol dapat digunakan untuk menentukan rumus suatu senyawa

Rumus Empiris Vs Molekul § Rumus empiris rumus kimia yang menyatakan rasio perbandingan terkecil dari atom-atom pembentuk sebuah senyawa § Rumus molekul, rumus yamg menyatakan jumlah atom-atom dari unsur-unsur yang menyusun satu molekul senyawa § Rumus Molekul = ( Rumus Empiris )n Mr Rumus Molekul = n x ( Mr Rumus Empiris ) § n= bilangan bulat

Penentuan Rumus Empiris dan Molekul § 1. Cari massa (persentase) tiap unsur penyusun senyawa § 2. Ubah ke satuan mol § 3. Perbandingan mol tiap unsur merupakan rumus empiris § 4. Untuk mencari rumus molekul dengan cara : ( Rumus Empiris ) n = Mr n dapat dihitung § 5. Kemudian kalikan n yang diperoleh dari hitungan, dengan rumus empiris.

Contoh Suatu senyawa C dan H mengandung 6 gram C dan 1 gram H. Tentukanlah rumus empiris dan rumus molekul senyawa tersebut bila diketahui Mr nya= 28! Jawab: mol C : mol H = 6/12 : 1/1 = 1/2 : 1 = 1 : 2

Contoh Jawab: Jadi rumus empirisnya adalah: (CH 2)n Bila Mr senyawa tersebut adalah 28, maka 12 n + 2 n = 28 14 n = 28 n = 2 Jadi Rumus Molekulnya (CH 2)2 = C 2 H 4

Pereaksi pembatas zat (pereaksi) yang membatasi jumlah produk yang dihasilkan pada suatu reaksi. Contoh : 2 H 2 + O 2 → 2 H 2 O 2 : 1 : 2 2 mol H 2 + 1 mol O 2 → 2 mol H 2 O 4 mol H 2 + 1 mol O 2 → 2 mol H 2 O H 2 yang tidak bereaksi = 4 mol - 2 mol = 2 mol O 2 adalah pereaksi pembatas

Komposisi Zat (% Massa) §

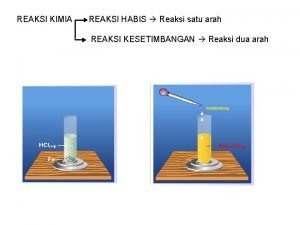
Reaksi Kimia Chemical Reaction § Suatu proses di mana zat (atau senyawa) diubah menjadi satu atau lebih senyawa baru § Reaksi kimia mengubah zat-zat asal (pereaksi = reaktan ) menjadi zat baru (produk)

Persamaan Reaksi Chemical Equation § Penggunaan lambang (simbol) kimia untuk menunjukkan apa yang terjadi saat reaksi kimia berlangsung § N 2(g) + 3 H 2(g) → 2 NH 3(g) § Tanda + berarti “bereaksi dengan” dan tanda berarti “menghasilkan”.

Persamaan Reaksi Chemical Equation § Reaksi tersebut dapat dibaca sebagai berikut : satu molekul gas nitrogen bereaksi dengan tiga molekul gas hidrogen menghasilkan dua molekul gas amonia.

Persamaan Reaksi Chemical Equation § Jenis unsur-unsur sebelum dan sesudah reaksi selalu sama § Jumlah masing-masing atom sebelum dan sesudah reaksi selalu sama § Perbandingan koefisien reaksi menyatakan perbandingan mol (khusus yang berwujud gas perbandingan koefisien juga menyatakan perbandingan volume asalkan suhu den tekanannya sama)

Reaksi kimia Menggunakan 1. Rumus Kimia zat Pereaksi ditulis dikiri, product/ hasil ditulis dikanan dihubungkan dengan tanda panah 2. Koefisien Reaksi Menyatakan jumlah partikel dari setiap pereaksi dan product. Jumlah atom dari setiap unsur diruas kanan = jumlah atom dari setiap unsur diruas kiri

Reaksi kimia 3. Wujud zat (tidak wajib) Padat (solid) s Cair (liquid) l Gas g Larut dalam air (aqueous) aq

Persamaan Reaksi Chemical Equation HNO 3 (aq) + H 2 S (g) NO (g) + S (s) + H 2 O (l) § a HNO 3 + b H 2 S c NO + d S + e H 2 O § atom N : a = c (sebelum dan sesudah reaksi) atom O : 3 a = c + e 3 a = a + e e = 2 a atom H : a + 2 b = 2 e = 2(2 a) = 4 a 2 b = 3 a b = 3/2 a atom S : b = d = 3/2 a

Persamaan Reaksi Chemical Equation Maka agar terselesaikan kita ambil sembarang harga misalnya a = 2 berarti: b = d = 3, dan e = 4 sehingga persamaan reaksinya : 2 HNO 3 + 3 H 2 S 2 NO + 3 S + 4 H 2 O

Contoh soal § Karbid (kalsium karbida) adalah padatan putih yang pada umumnya digunakan orang untuk mengelas. Karbid dihasilkan dari pemanasan kalsium oksida dan karbon dalam tanur listrik dengan hasil samping gas karbon dioksida. Tuliskan persamaan reaksi yang terjadi : Ca. O(s) + C(s) Ca. C 2(s) + CO 2(g) 2 Ca. O(s) + 5 C(s) 2 Ca. C 2(s) + CO 2(g)

Jenis – Jenis Reaksi Kimia 1. Reaksi Penggabungan Dalam reaksi penggabungan dua atau lebih zat tergabung membentuk zat lain. Contoh § 2 H 2 (g) + O 2 (g) § N 2 + 3 H 2 2 H 2 O (l) 2 NH 3

Jenis – Jenis Reaksi Kimia 2. Reaksi Penguraian § Reaksi penguraian merupakan reaksi kebalikan daripada reaksi penggabungan. Dalam reaksi ini satu zat terpecah atau terurai menjadi dua atau lebih zat yang lebih sederhana. § § § AB 2 H 2 O 2 NH 3 H 2 CO 3 Ca. CO 3 A + B 2 H 2 + O 2 N 2 + 3 H 2 H 2 O + CO 2 Ca. O +CO 2

Jenis – Jenis Reaksi Kimia 3. Reaksi Penggantian/Pertukaran a. Tunggal, Bila satu unsur menggantikan unsur lain dalam satu senyawa A + BC B + AC (A Menggantikan B) D +BC C + BD (D Menggantikan C) Cu(s) + 2 Ag. NO 3(aq) 2 Ag(s) + Cu(NO 3)2(aq)

Jenis – Jenis Reaksi Kimia 3. Reaksi Penggantian/Pertukaran b. Ganda AB + CD CB + BA Ba. Cl 2 + Na 2 SO 4 2 Na. Cl + Ba. SO 4

Jenis – Jenis Reaksi Kimia 4. Reaksi Netralisasi adalah reaksi penetralan asam oleh basa dan menghasilkan air HCl + Na. OH Na. Cl + H 2 O

Jenis – Jenis Reaksi Kimia 5. Reaksi Pembakaran adalah reaksi dari unsur maupun senyawa dengan Oksigen 2 Fe + 3 O 2 2 Fe. O 3 www. themegallery. com

Latihan soal 1. Hitung massa 2 mol Al (Ar Al =27) 2. Hitung massa 0, 5 mol H 2 O (Ar H=1, O=16) 3. 2, 24 g besi direaksikan dengan 0, 96 g oksigen menghasilkan senyawa besi oksida. Tentukan rumus empiris senyawa tersebut 4. Suatu senyawa mengandung 80% carbon dan 20% hidrogen. Jika massa atom relatif (Mr) senyawa tersebut 30, tentukan rumus molekul dan rumus empirisnya

Latihan Soal 5. Hitung Volume 5, 6 g gas CO pada keadaan standar 6. Hitunglah prosentase unsur s yang terdapat dalam senyawa Fe 2(SO 4)3 (Ar s = 32, Fe = 56, O = 16)

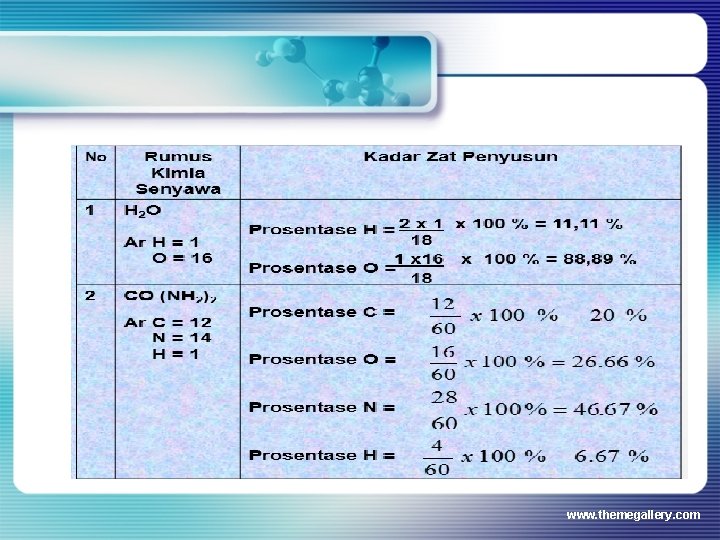
Penentuan Kadar Zat Kadar zat dalam suatu senyawa ditetapkan berdasarkan hasil percobaan analisis kimia. Tetapi jika rumus senyawa dan Ar masing-masing zat penyusun diketahui maka kadar zat penyusun dalam senyawa tersebut dapat dihitung www. themegallery. com

www. themegallery. com

contoh Berapa % Na, % N dan % O dalam senyawa Na. NO 3? Na = 23, N = 14, O = 16 % Na = 23/85 * 100% = 27, 06 % % N = 14/85 * 100% = 16, 47% % O = 48/85 * 100% = 56, 47 % www. themegallery. com

Berapa massa Na, N, dan O dalam senyawa Na. NO 3 ( 5 gram)? N = 14/85 *5 = 0, 82 gram Na = 23/85 * 5 = 1, 35 gram O = 48/85 * 5 = 2, 82 gram www. themegallery. com

Latihan soal § Setarakan reaksi kimia berikut : 1. 2. 3. 4. 5. C 8 H 18 + 02 CO 2+H 2 O Al + H 2 SO 4 Al 2(SO 4)3 + H 2 P 4 O 10 + H 2 O H 3 PO 4 Al + Fe 3 O 4 Al 2 O 3 + Fe Na 2 S 2 O 3 +I 2 Na. I + Na 2 S 4 O 6

1. Setarakan persamaan reaksi dibawah ini: a. Ca. O(s) + NH 4 Cl(s) → NH 3(g) + H 2 O(g) + Ca. Cl 2(s) b. Na 2 CO 3(s)+ HCl(aq) → Na. Cl(aq)+ H 2 O(l) + CO 2(g)

2. Tulis persamaan reaksi yang setara a. Amonium Sulfat direaksikan dengan larutan natrium hidroksida membentuk natrium sulfat, amonia dan air b. Besi (III) Oksida direaksikan dengan asam sulfat membentuk besi (III) sulfat dan air c. Kalsium karbonat direaksikan dengan asam klorida membentuk kalsium klorida, air dan carbon dioksida

4. 12, 5 g sampel suatu senyawa yang hanya mengandung fosfor dan sulfur, dianalisis dan ternyata mengandung 7, 04 g fosfor dan 5, 46 g sulfur. Bagaimana komposisi persentase senyawa ini? Tuliskan rumus empirisnya!
 Irnin
Irnin Irnin
Irnin Dwi koordinat
Dwi koordinat Rini juni astuti
Rini juni astuti Astuti yudo
Astuti yudo Indwiani astuti ugm
Indwiani astuti ugm Sri astuti indriyati
Sri astuti indriyati Gugus penarik elektron
Gugus penarik elektron Reaksi redoks adalah gabungan dari reaksi.... *
Reaksi redoks adalah gabungan dari reaksi.... * Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi
Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi Kelimpahan unsur gas mulia di udara
Kelimpahan unsur gas mulia di udara Persamaan dari reaksi proses fotosintesis adalah
Persamaan dari reaksi proses fotosintesis adalah Notasi sel volta
Notasi sel volta María agustina sarmiento de sotomayor
María agustina sarmiento de sotomayor Agustina bouza
Agustina bouza Contoh true alkaloid
Contoh true alkaloid Agustina shinta
Agustina shinta Agustina mempunyai banyak kertas
Agustina mempunyai banyak kertas Agustina setiawati
Agustina setiawati Agustina dominguez
Agustina dominguez Dr tri ratih agustina
Dr tri ratih agustina Dr. agustina sjenny sp.kj
Dr. agustina sjenny sp.kj Prof rosa agustina
Prof rosa agustina Agustina bermejo
Agustina bermejo Dr. agustina sjenny sp.kj
Dr. agustina sjenny sp.kj Grafik persamaan polar
Grafik persamaan polar Bentuk umum persamaan kuadrat adalah …
Bentuk umum persamaan kuadrat adalah … Biokimia
Biokimia Crow's foot erd
Crow's foot erd Dwi puji pangesti
Dwi puji pangesti Harno dwi pranowo
Harno dwi pranowo Yahoo
Yahoo Dwi hartanto
Dwi hartanto Mapa adc o que significa
Mapa adc o que significa Psak 69 dwi martani
Psak 69 dwi martani Psak 16 dwi martani
Psak 16 dwi martani Psak14
Psak14 Contoh penerapan retrospektif
Contoh penerapan retrospektif Psak 71 instrumen keuangan pengakuan dan pengukuran
Psak 71 instrumen keuangan pengakuan dan pengukuran Drg dwi imbang lestari
Drg dwi imbang lestari Contoh soal dwi koordinat
Contoh soal dwi koordinat Dwi retno andriani
Dwi retno andriani Dwi martani blog
Dwi martani blog