LOGAM STRUKTUR LOGAM SUSUNAN ATOMATOM DALAM KRISTAL LOGAM

















- Slides: 34

LOGAM STRUKTUR LOGAM

SUSUNAN ATOM-ATOM DALAM KRISTAL LOGAM • Susunan 2 dimensi antara lain : 1. Bujur sangkar 2. heksagonal

• DALAM 2 DIMENSI • SUSUNAN BUJUR SANGKAR : – Setiap atom logam bersingungan dengan 4 atom sejenis – Bukan susunan rapat • SUSUNAN HEKSAGONAL – Setiap atom logam bersinggungan dengan 6 atom sejenis – susunan rapat (close packing atau closest packed) – lebih rapat dibandingkan bujursangkar • Pada struktur diatas terdapat tempat 2 lowong yang disebut interstitial site (tempat selilitan)

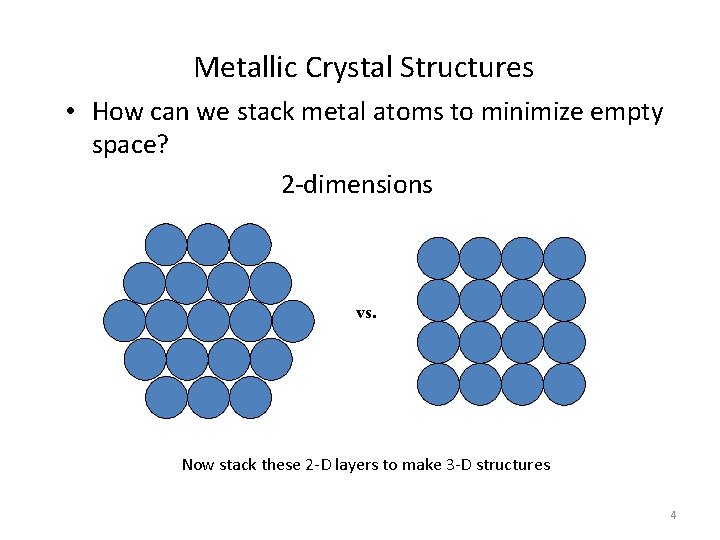
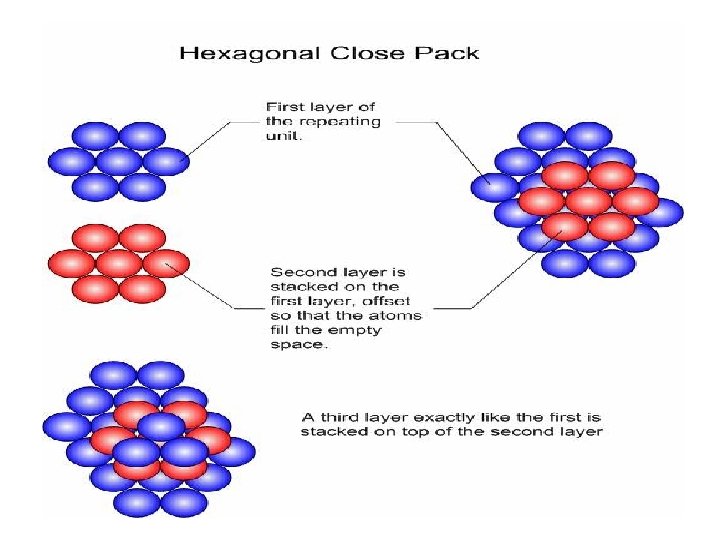
Metallic Crystal Structures • How can we stack metal atoms to minimize empty space? 2 -dimensions vs. Now stack these 2 -D layers to make 3 -D structures 4

• Atom-atom logam dalam susunan hcp 2 dimensi membentuk suatu lapisan • Lapisan akan menempati selilitan • Pada susunan rapat 3 dimensi ada 2 macam: 1. Hcp = hexagonal close packed 2. Ccp = cubic close packed


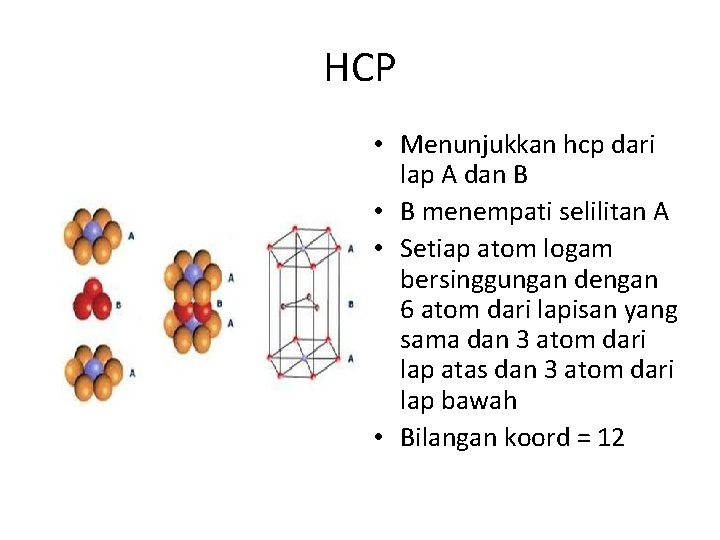
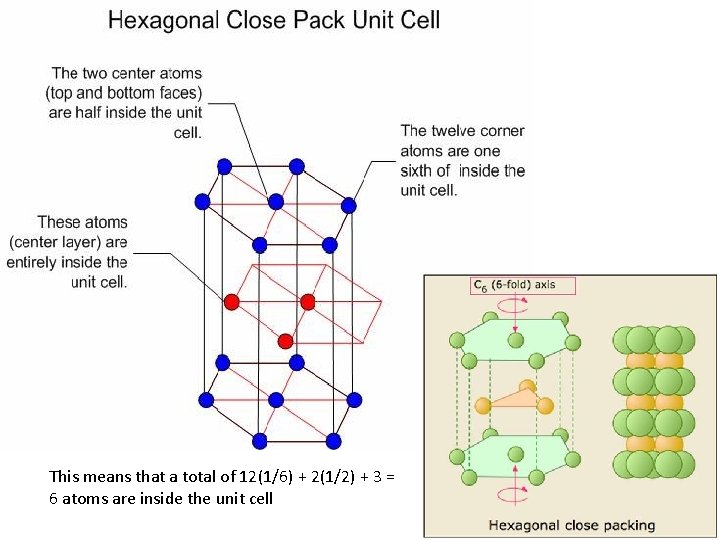
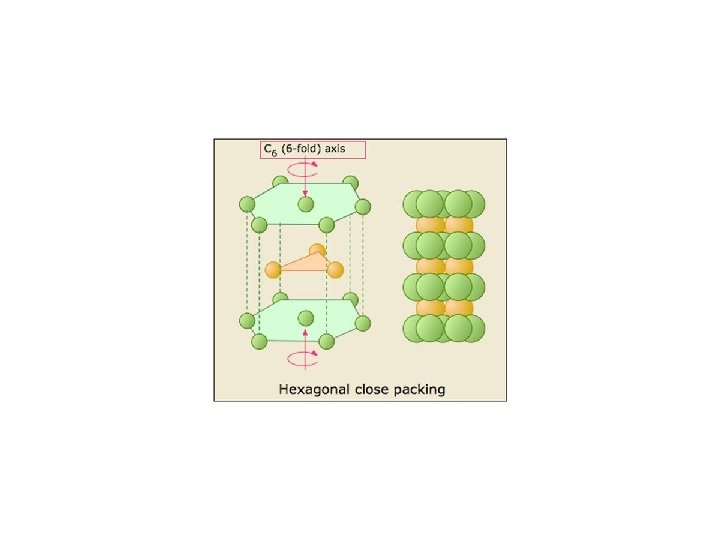
HCP • Menunjukkan hcp dari lap A dan B • B menempati selilitan A • Setiap atom logam bersinggungan dengan 6 atom dari lapisan yang sama dan 3 atom dari lap atas dan 3 atom dari lap bawah • Bilangan koord = 12


This means that a total of 12(1/6) + 2(1/2) + 3 = 6 atoms are inside the unit cell


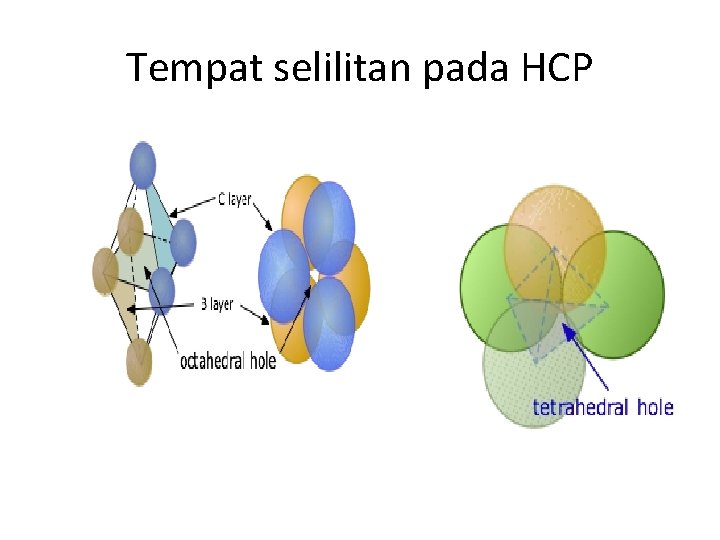
Tempat Selilitan HCP 1. Tempat selilitan Tetrahedral (T) – Terbentuk 3 atom pada lapisan A dan 1 atom pada lap B 2. Tempat selilitan Oktahedral – Terbentuk dari 3 atom pada lap A dan 3 atom pada lap B

Tempat selilitan pada HCP




• Dari susunan hcp dapat dibuat sel satuan heksagonal dengan c = 1, 633 a • Bila c ‡ 1, 633 a sel satuannya tetap heksagonal tapi bukan susunan rapat


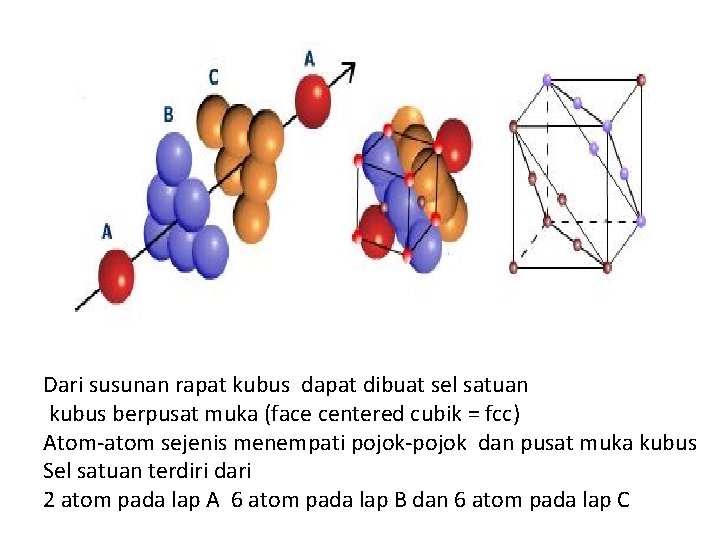
SUSUNAN RAPAT KUBUS • Gambar dibawah merupakan pembentukan susunan rapat kubus dari lap A, B, C • Tempat selilitan dari lap A diisi oleh atom-atom pada lap B • Tempat selilitan pada lap B diisi oleh atom-atom lap C • Tempat selilitan pada lap C diisi oleh atom-atom lap A • Dst ……ABCABCBC…. • susunan berulang ini disebut susunan rapat kubus • Bil koordinasi 12 • Terdapat 2 macam tempat selilitan Tetrahedral dan oktahedral




Dari susunan rapat kubus dapat dibuat sel satuan kubus berpusat muka (face centered cubik = fcc) Atom-atom sejenis menempati pojok-pojok dan pusat muka kubus Sel satuan terdiri dari 2 atom pada lap A 6 atom pada lap B dan 6 atom pada lap C

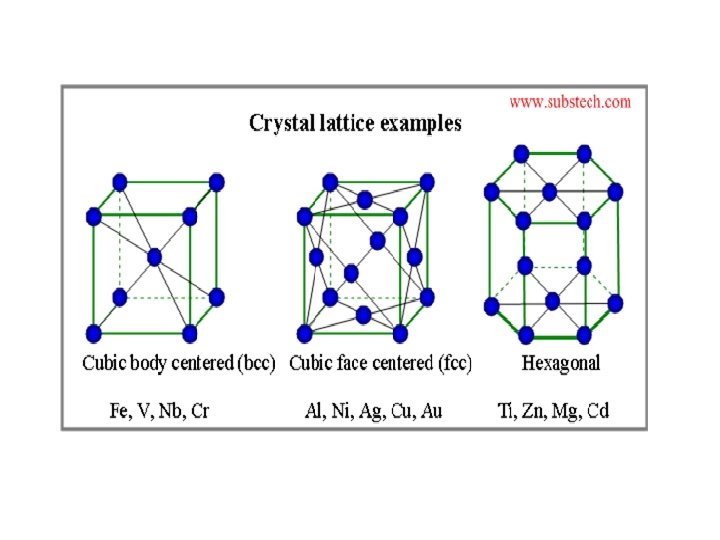
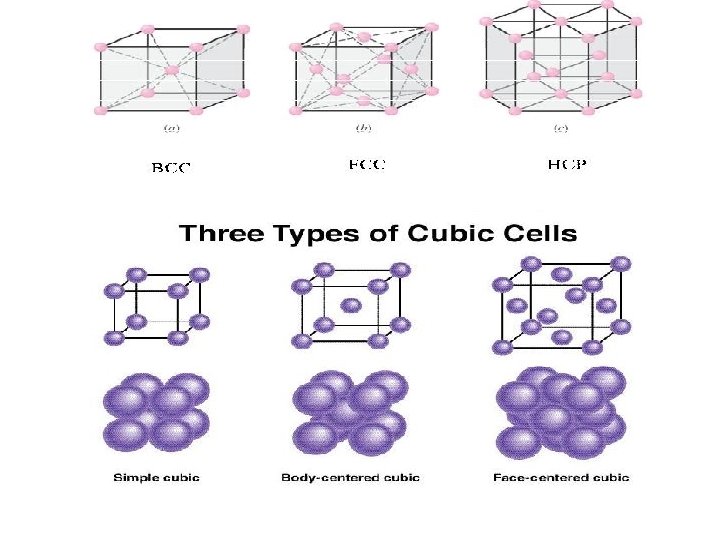
Susunan logam kubus yang bukan susunan rapat 1. Bcc 2. Sc = pc



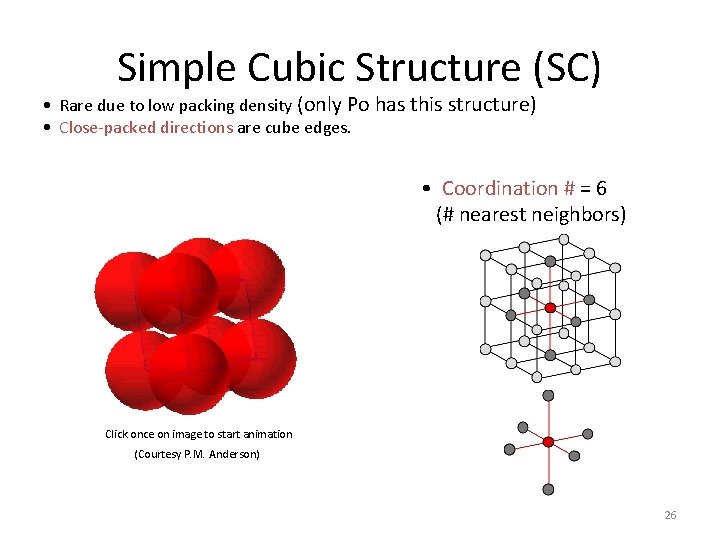
Simple Cubic Structure (SC) • Rare due to low packing density (only Po has this structure) • Close-packed directions are cube edges. • Coordination # = 6 (# nearest neighbors) Click once on image to start animation (Courtesy P. M. Anderson) 26


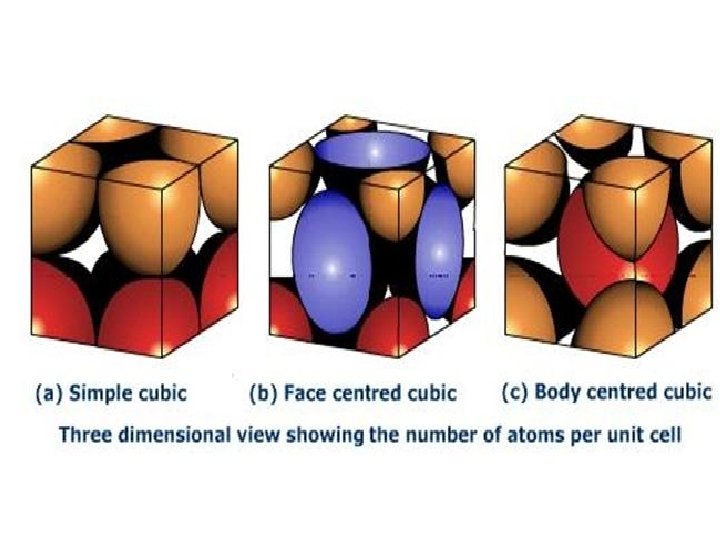
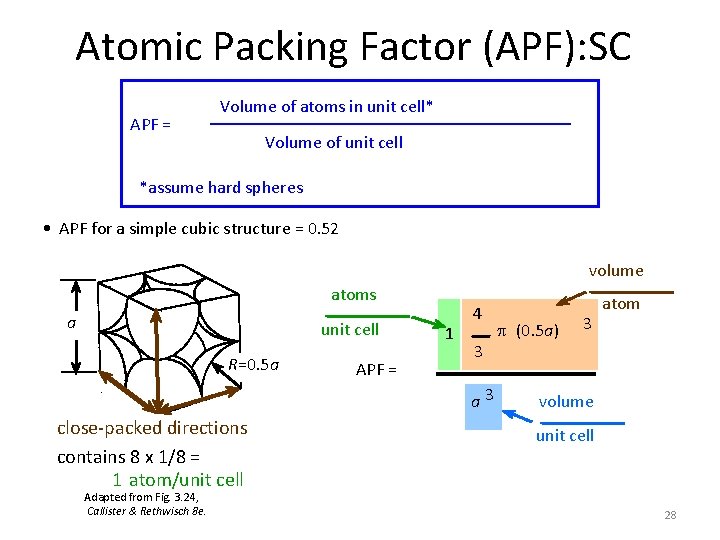
Atomic Packing Factor (APF): SC APF = Volume of atoms in unit cell* Volume of unit cell *assume hard spheres • APF for a simple cubic structure = 0. 52 volume atoms a unit cell R=0. 5 a APF = 1 4 3 a 3 close-packed directions contains 8 x 1/8 = 1 atom/unit cell Adapted from Fig. 3. 24, Callister & Rethwisch 8 e. p (0. 5 a) 3 atom volume unit cell 28

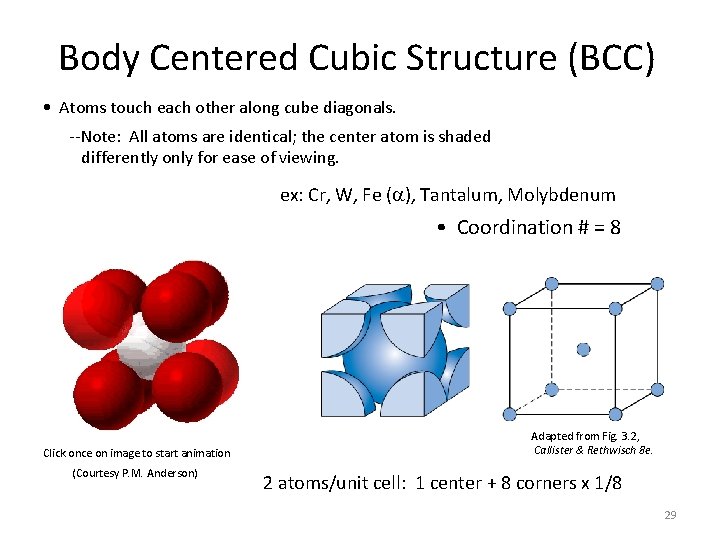
Body Centered Cubic Structure (BCC) • Atoms touch each other along cube diagonals. --Note: All atoms are identical; the center atom is shaded differently only for ease of viewing. ex: Cr, W, Fe ( ), Tantalum, Molybdenum • Coordination # = 8 Click once on image to start animation (Courtesy P. M. Anderson) Adapted from Fig. 3. 2, Callister & Rethwisch 8 e. 2 atoms/unit cell: 1 center + 8 corners x 1/8 29

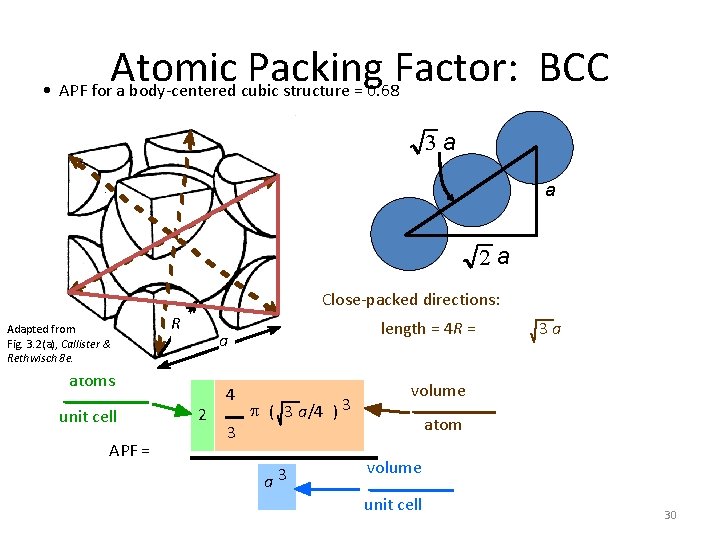
Atomic Packing Factor: BCC • APF for a body-centered cubic structure = 0. 68 3 a a 2 a Close-packed directions: Adapted from Fig. 3. 2(a), Callister & Rethwisch 8 e. R atoms unit cell APF = length = 4 R = a 2 4 3 p ( 3 a/4 ) 3 a 3 3 a volume atom volume unit cell 30


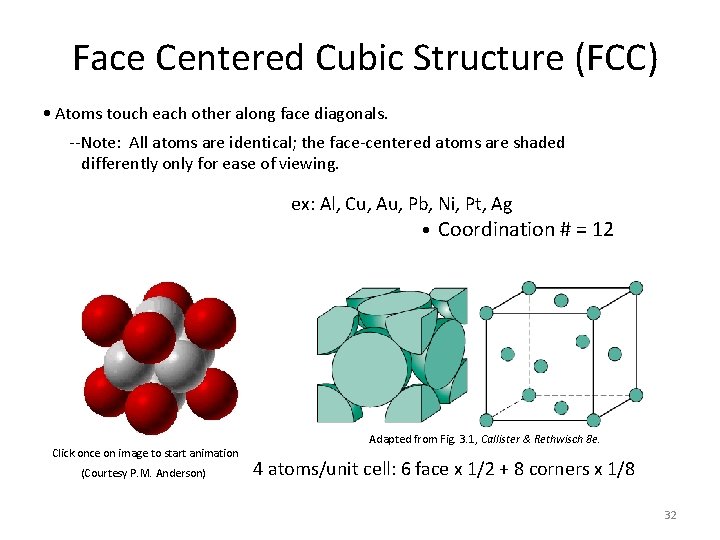
Face Centered Cubic Structure (FCC) • Atoms touch each other along face diagonals. --Note: All atoms are identical; the face-centered atoms are shaded differently only for ease of viewing. ex: Al, Cu, Au, Pb, Ni, Pt, Ag • Click once on image to start animation (Courtesy P. M. Anderson) Coordination # = 12 Adapted from Fig. 3. 1, Callister & Rethwisch 8 e. 4 atoms/unit cell: 6 face x 1/2 + 8 corners x 1/8 32

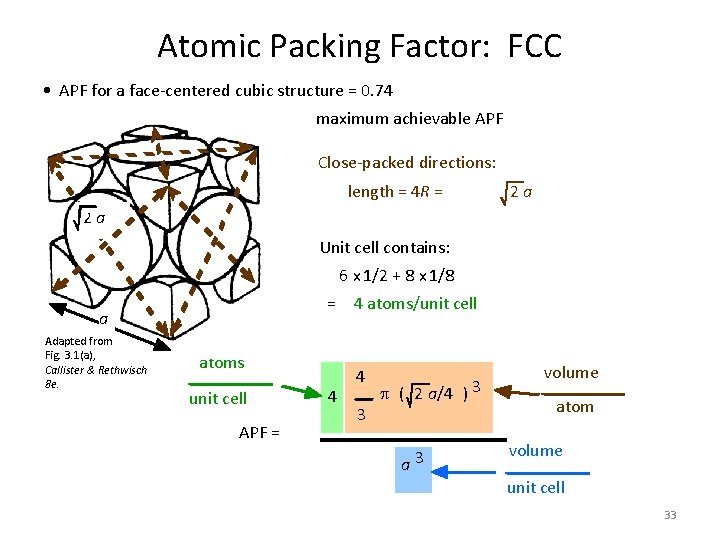
Atomic Packing Factor: FCC • APF for a face-centered cubic structure = 0. 74 maximum achievable APF Close-packed directions: length = 4 R = 2 a 2 a Unit cell contains: 6 x 1/2 + 8 x 1/8 = 4 atoms/unit cell a Adapted from Fig. 3. 1(a), Callister & Rethwisch 8 e. atoms unit cell APF = 4 4 3 p ( 2 a/4 ) 3 a 3 volume atom volume unit cell 33

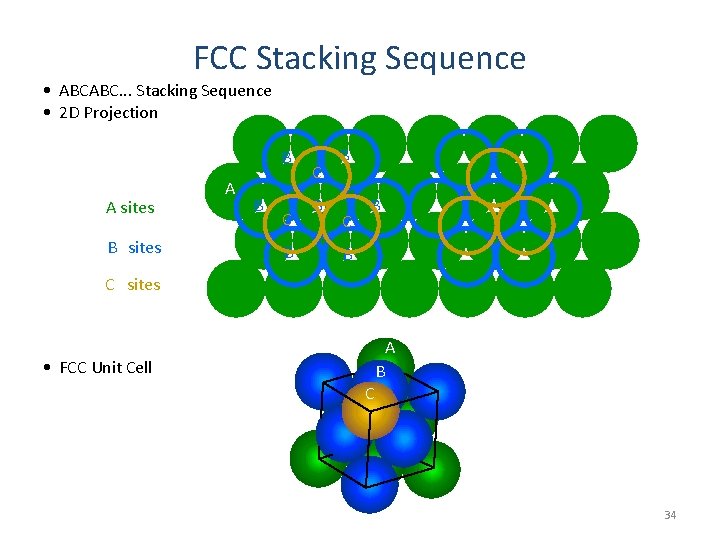
FCC Stacking Sequence • ABCABC. . . Stacking Sequence • 2 D Projection B A sites B sites A B C B B C sites A • FCC Unit Cell B C 34
 Ayat biasa dan ayat songsang latihan
Ayat biasa dan ayat songsang latihan Apa itu kisi kristal
Apa itu kisi kristal Struktur kristal material teknik
Struktur kristal material teknik Spu logam non logam
Spu logam non logam Jelaskan kelengkapan struktur fisik kedua puisi tersebut
Jelaskan kelengkapan struktur fisik kedua puisi tersebut Klasifikasi struktur berdasarkan material pembentuknya
Klasifikasi struktur berdasarkan material pembentuknya Judul- lead- dateline
Judul- lead- dateline Protokol dan etiket
Protokol dan etiket Contoh ayat adat istiadat
Contoh ayat adat istiadat Kedudukan zarah subatom
Kedudukan zarah subatom Dalam gambar hierarki memori susunan teratas adalah
Dalam gambar hierarki memori susunan teratas adalah Kelemahan teori medan kristal
Kelemahan teori medan kristal Je lève les yeux vers les montagnes maranatha
Je lève les yeux vers les montagnes maranatha Taktisite
Taktisite Amorf cisimler
Amorf cisimler Kristal artropati nedir
Kristal artropati nedir Kumpulan tetesan air kristal
Kumpulan tetesan air kristal Pseudogut
Pseudogut Mineral triklin
Mineral triklin Sembol
Sembol Molekül yapılı modeller
Molekül yapılı modeller Konoskopija
Konoskopija Kristal yap
Kristal yap Bentuk kristal
Bentuk kristal Triklinik
Triklinik Definisi struktur kontrol percabangan dalam pemrograman
Definisi struktur kontrol percabangan dalam pemrograman Struktur pengulangan adalah
Struktur pengulangan adalah Substansi kurikulum 2004
Substansi kurikulum 2004 Pengulangan pascal
Pengulangan pascal Struktur dalam wawancara
Struktur dalam wawancara Contoh integrasi vertikal
Contoh integrasi vertikal Jenis penulisan akademik
Jenis penulisan akademik Ciri ciri bangunan tamadun rom
Ciri ciri bangunan tamadun rom Structure of mis
Structure of mis Hal-hal yang diperhatikan dalam menulis teks iklan
Hal-hal yang diperhatikan dalam menulis teks iklan