Lleis del gasos Durant els segles XVII i













- Slides: 14

Lleis del gasos. Durant els segles XVII i XVIII, es van anar establint les lleis que expliquen el comportament dels gasos. � Aquestes lleis no es compleixen mai exactament, donat que els gasos reals no es comporten en general com a gasos ideals. � Però si les extrapolem a baixes pressions i temperatures elevades, on els gasos són poc densos, podem veure que el comportament dels gasos s’aproxima notablement a un gas ideal. � De fet si considerem que els gasos estan formats per partícules amb estructura, podem veure que es pot justificar el seu comportament com si fos un gas ideal. � El coeficient de dilatació adiabàtic γ depèn de l’estructura de la molècula del gas. Així un gas ideal monoatòmic tindria un coeficient de 5/3, però això només o compleixen els gasos nobles. Si considerem que l’aire està composat per substàncies amb molècules diatòmiques, veiem que el resultat experimental. d’ 1, 40 a 20ºC, dona igual que el de 7/5, que és el que surt a partir de l’expressió teòrica. En aquest gràfic es veu que el volum que ocupa l’oxigen i l’aire es desvia notablement del comportament de gas ideal, a altes pressions, però a baixes pressions tots tres coincideixen.

Llei de Boyle-Mariotte. Aquesta va ser la primera llei dels gasos en ser descoberta. � Va ser formulada en 1660 per Robert Boyle i en 1676 per Edme Mariote. � La llei de Boyle estableix que en condicions isotermes (temperatura constant), la pressió que presenta una massa de gas és inversament proporcional al seu volum. � Robert Boyle, 1627 -1691. Llei de Boyle. A mesura que augmentem el pes sobre l’èmbol aquest redueix el seu volum, la qual cosa indica que són inversament proporcionals, el seu producte és constant. Edme Mariotte, 1620 -1684.

Cas pràctic, el barotraumatisme pulmonar. � � � Una aplicació pràctica d’això ens la trobem durant la pràctica del submarinisme. Suposem un bussejador que està respirant aire a 30 m de profunditat, la pressió a que està respirant l’aire és de 4 atm. Quan puja a la superfície, la pressió ambient disminueix a 1 atm. Per tant si la pressió es fa 4 vegades més petita, el volum de l’aire que es troba als seus pulmons es farà 4 vegades més gran. Com a conseqüència el bussejador ha de treure aire dels seus pulmons, per evitar que s’hi expandeixi dintre i provoqui l’explosió dels pulmons, lesió que es coneix com a Barotraumatisme Pulmonar.

Llei de Charles Gay-Lussac. Una vegada que ja havia quedat establert el comportament dels gasos a temperatura constant, quedava establir el comportament dels gasos quan variava la temperatura. � Com que quan varia la temperatura pot augmentar tant la pressió com el volum es va optar per treballar mantenint una d’aquestes dues variables constant. � Així es va estudiar la dilatació dels gasos en dues condicions: � ◦ Condicions isòbares, a pressió constant. ◦ Condicions isòcores, a volum constant. Jacques Charles, 1746 -1823. La llei de Charles Gay-Lussac va ser publicada per aquest últim en 1803, però fent referència a un treball de Charles de 1787, per la qual cosa es consideren coautors de les dues lleis de dilatació dels gasos. � Charles va estudiar el comportament dels gasos a pressió constant, mentre que Gay-Lussac va estudiar tots dos casos. Louis Joseph Gay-Lussac, � 1778 -1860.

Dilatació dels gasos. � Per estudiar la dilatació de qualsevol substància es defineix el coeficient de dilatació, a pressió constant. En el cas dels gasos es defineix el coeficient de dilatació volumètric, donat que poden expandir-se en totes les direccions de l’espai. � El coeficient de dilatació en principi és característic de cada substància, però com que els gasos tenen tots la mateixa estructura, tots tenen el mateix: � � Aquest fet va ser la primera evidència que es va tenir de l’existència del 0 absolut.

Dilatació dels gasos. Llei de Charles Gay-Lussac. � Considerem ara la dilatació tèrmica, a pressió constant, entre els punts 0ºC i qualsevol temperatura: � Per tant en el cas dels gasos, la llei de dilatació queda reduïda a aquesta expressió tan senzilla: � D’aquesta expressió en diem Llei de Charles Gay-Lussac.

Llei de Gay-Lussac. Una vegada establerta la relació existent entre el volum d’un gas i la seva temperatura, a pressió constant, Gay-Lussac va continuar amb la relació entre la pressió d’un gas i la seva temperatura, a volum constant. � Per deduïr aquesta relació va partir del coeficient de variació relativa de la pressió. � � Igualment que amb el coeficient de dilatació tèrmica, va trobar que tots els gasos tenien el mateix coeficient: de variació relativa de la pressió: � Per tant com que va obtenir el mateix resultat que pel cas de la dilatació a pressió constant, es va aïllar de la mateixa manera que amb el cas anterior.

Variació relativa de la pressió. Llei de Gay-Lussac. � Considerem ara la variació relativa de la pressió, a volum constant, entre els punts 0ºC i qualsevol temperatura: � Per tant igualment que amb la llei de dilatació queda reduïda a una expressió molt senzilla: � D’aquesta expressió en diem Llei de Gay-Lussac.

Formulació de la Llei de Charles Gay-Lussac. � Aquestes dues lleis es van formular amb els següents enunciats: ◦ El volum d’un gas, que s’escalfa a pressió constant, és proporcional a la seva temperatura absoluta (Llei de Charles Gay-Lussac). ◦ La pressió d’un gas, que s’escalfa a volum constant, és proporcional a la seva temperatura absoluta (Llei de Gay-Lussac). � Heu de tenir pressent en tot moment que la proporcionalitat de la Llei de Charles Gay-Lussac, es manté entre la pressió, o el volum, i la temperatura absoluta, no en graus Celsius. Tant si es treballa a volum constnat, com a pressió constant, el quocient entre pressió i temperatura, o entre volum i temperatura es manté constant.

Llei general dels gasos ideals. Si combinem les tres lleis dels gasos que hem formulat per separat en una sola llei podrem relacionar P, V i T en qualsevol procés. � Tenim que les tres lleis dels gasos indiquen relacions de proporcionalitat entre P, V i T. � A partir d’aquí podem aïllar V i P de la llei de Charles Gay-Lussac. � Veiem que si multipliquem P i V entre elles s’obté una expressió molt semblant a la llei de Boyle, llevat que hi ha una T 2 en lloc d’una constant. � � Multipliquem ara per la llei de Boyle-Mariotte. Ara tenim tot expressat en funció d’una constant, per tant, fem l’arrel quadrada i queda. � A partir d’aquesta Llei general dels gasos ideals ja podrem relacionar P, V, i T en qualsevol procés, sempre que sapiguem P, V i T en unes condicions inicials donades. �

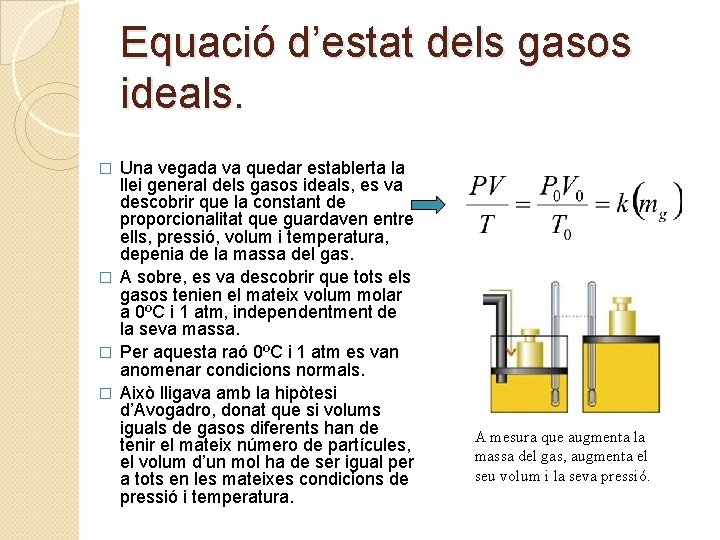
Equació d’estat dels gasos ideals. Una vegada va quedar establerta la llei general dels gasos ideals, es va descobrir que la constant de proporcionalitat que guardaven entre ells, pressió, volum i temperatura, depenia de la massa del gas. � A sobre, es va descobrir que tots els gasos tenien el mateix volum molar a 0ºC i 1 atm, independentment de la seva massa. � Per aquesta raó 0ºC i 1 atm es van anomenar condicions normals. � Això lligava amb la hipòtesi d’Avogadro, donat que si volums iguals de gasos diferents han de tenir el mateix número de partícules, el volum d’un mol ha de ser igual per a tots en les mateixes condicions de pressió i temperatura. � A mesura que augmenta la massa del gas, augmenta el seu volum i la seva pressió.

Constant dels gasos ideals. A 0ºC de temperatura i 1 atm de pressió tots els gasos tenen el volum molar de 22, 4 dm 3. � Per tant si introduïm aquestes condicions a la llei general dels gasos ideals sortirà: � Aquesta és la constant dels gasos ideals. � Com que té unitats els seu valor dependrà de les unitats en que prenem la pressió i el volum. � Amb aquesta constant ens quedarà la següent expressió per a la llei dels gasos ideals. � � On R és la constant dels gasos ideals i n el nombre de mols gasosos.

Valor de la constant dels gasos en el sistema internacional d’unitats. Podem obtenir el valor corresponent en el sistema internacional d’unitats si tenim present l’equivalència entre atm i Pa. � Sabem que una columna de 760 mm de mercuri es troba en equilibri amb l’atmosfera, per tant, segons el principi fonamental de la hidrostàtica: � � I si prenem el valor de la densitat del mercuri i l’alçada de la columna de mercuri en equilibri amb l’atmosfera, s’obté: � Amb aquestes dades podem ara obtenir el valor de la constant dels gasos en el sistema internacional d’unitats:

Valor de la constant dels gasos en altres sistemes d’unitats. Com veiem la constant dels gasos té unitats d’energia. � Si recordem l’equivalent mecànic de el calor podem obtenir el valor d’aquesta constant en calories: � � Aquesta constant per tant estarà present en qualsevol procés on hi hagi un intercanvi energètic d’una massa gasosa. ◦ Capacitat calorífica a volum constant. ◦ Capacitat calorífica a pressió constant. ◦ Velocitat quadràtica mitjana de les molècules d’un gas. ◦ Velocitat del so en un medi gasós.
 Tres lleis de newton
Tres lleis de newton Les lleis de mendel
Les lleis de mendel Constant dels gasos ideals
Constant dels gasos ideals Paraules amb diftongs creixents
Paraules amb diftongs creixents Tipus triangles
Tipus triangles Sally durant
Sally durant Bob durant
Bob durant Je nais et meurs dans l'eau. qui suis-je
Je nais et meurs dans l'eau. qui suis-je What is a database?
What is a database? Durant motors stock 1920s
Durant motors stock 1920s 1920s stock market simulation
1920s stock market simulation Durant cette semaine
Durant cette semaine Lecturas domingo xvii tiempo ordinario ciclo b
Lecturas domingo xvii tiempo ordinario ciclo b Mapa de europa siglo xviii
Mapa de europa siglo xviii El teatro en el siglo xvii
El teatro en el siglo xvii