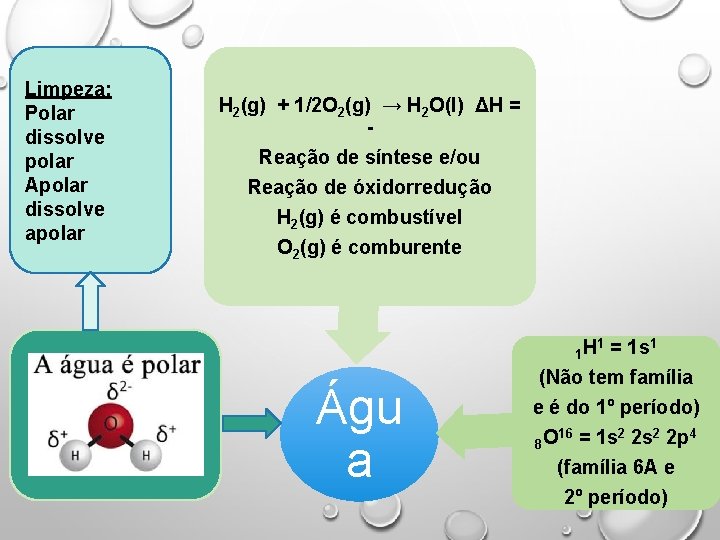
Limpeza Polar dissolve polar Apolar dissolve apolar H

![Pode-se afirmar que a estrutura [C 11 H 23 COO-]Na+(laurato de sódio) a) apresenta Pode-se afirmar que a estrutura [C 11 H 23 COO-]Na+(laurato de sódio) a) apresenta](https://slidetodoc.com/presentation_image_h2/3e6c50462fa7a6b5829eb8d942f49eab/image-4.jpg)









- Slides: 16


Limpeza: Polar dissolve polar Apolar dissolve apolar H 2(g) + 1/2 O 2(g) → H 2 O(l) ΔH = Reação de síntese e/ou Reação de óxidorredução H 2(g) é combustível O 2(g) é comburente 1 H Águ a = 1 s 1 (Não tem família e é do 1º período) 16 = 1 s 2 2 p 4 8 O (família 6 A e 2º período) 1

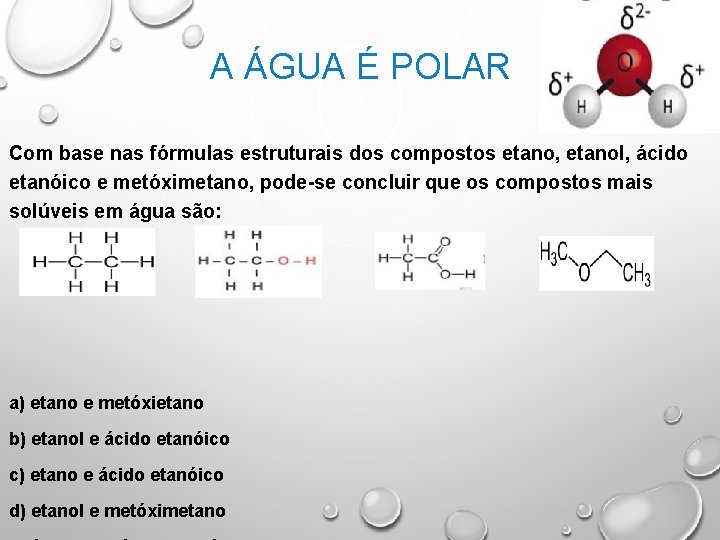
A ÁGUA É POLAR Com base nas fórmulas estruturais dos compostos etano, etanol, ácido etanóico e metóximetano, pode-se concluir que os compostos mais solúveis em água são: a) etano e metóxietano b) etanol e ácido etanóico c) etano e ácido etanóico d) etanol e metóximetano
![Podese afirmar que a estrutura C 11 H 23 COONalaurato de sódio a apresenta Pode-se afirmar que a estrutura [C 11 H 23 COO-]Na+(laurato de sódio) a) apresenta](https://slidetodoc.com/presentation_image_h2/3e6c50462fa7a6b5829eb8d942f49eab/image-4.jpg)
Pode-se afirmar que a estrutura [C 11 H 23 COO-]Na+(laurato de sódio) a) apresenta uma extremidade polar e uma apolar, a primeira remove a gordura e a segunda se dissolve na água. b) apresenta uma extremidade polar e uma apolar, a primeira se dissolve na água e a segunda remove a gordura. c) não apresenta extremidades polares. d) apresenta duas extremidades apolares, uma dissolve a gordura e a outra se dissolve na água. e) apresenta duas extremidades polares, uma dissolve a gordura e a outra se dissolve na água.

CLASSSIFICAÇÃO DAS REAÇÕES QUÍMICAS: ZN + 2 HCl → Zn. Cl 2 + H 2 P 2 O 5+ 3 H 2 O → 2 H 3 PO 4 Ag. NO 3 + NACl → Ag. Cl + Na. NO 3 Ca. O + CO 2 → Ca. CO 3 N 2 O 4 → 2 NO 2 Representam, respectivamente, reações de: a) dupla troca, adição, análise, deslocamento e decomposição. b) dupla troca, adição, análise, simples troca e decomposição. c) simples troca, dupla troca, síntese, análise e deslocamento. d) deslocamento, síntese, dupla troca, adição e análise. e) síntese, dupla troca, simples troca, análise e adição.

TABELA PERIÓDICA LEIA ATENTAMENTE OS ITENS ABAIXO E CONSIDERE OS SEGUINTES ASPECTOS: I. Quanto maior a tendência do átomo de perder elétrons, maior será sua eletronegatividade. II. Quanto maior a tendência do átomo de ganhar elétrons, maior será seu caráter metálico. III. Nos 2 primeiros períodos da tabela periódica, a eletronegatividade cresce dos metais alcalinos para os halogênios. Assinale a alternativa correta. a. somente I é verdadeira. b. somente II é verdadeira. c. somente III é verdadeira. d. somente I e II são verdadeiras.

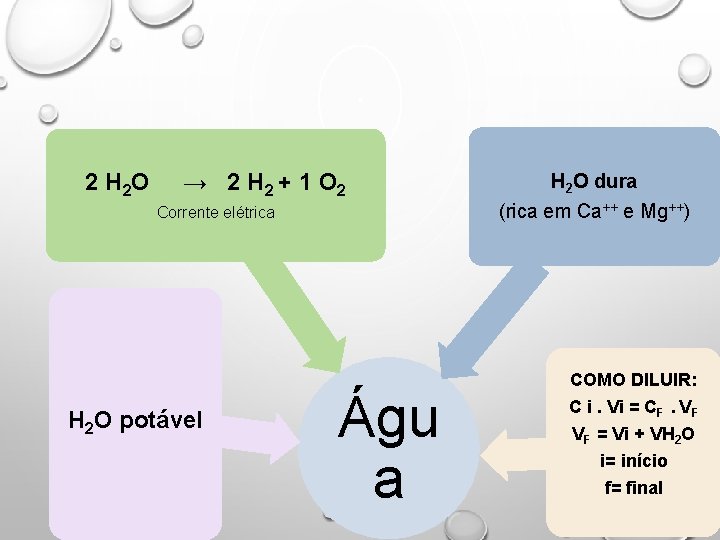
2 H 2 O → 2 H 2 + 1 O 2 Corrente elétrica H 2 O potável Águ a H 2 O dura (rica em Ca++ e Mg++) COMO DILUIR: C i. Vi = CF. VF VF = Vi + VH 2 O i= início f= final

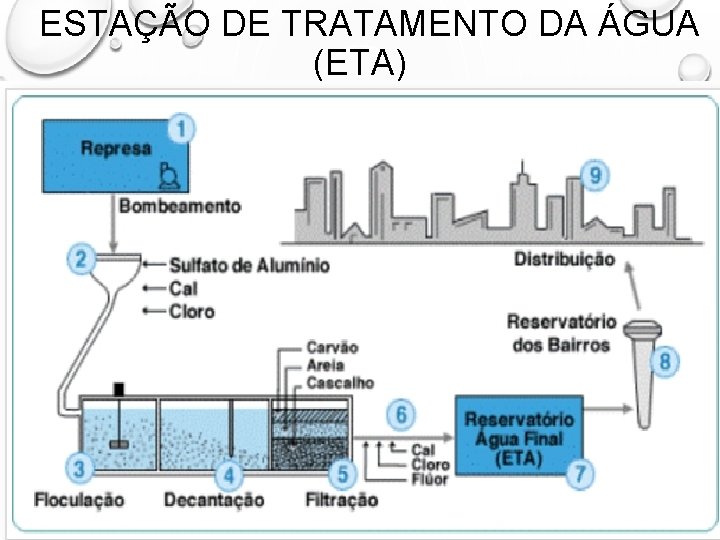
ESTAÇÃO DE TRATAMENTO DA ÁGUA (ETA)

ELETRÓLISE Considere a eletrólise do brometo de cálcio (Ca. Br 2(aq)), feita com eletrodos inertes, em solução aquosa. Determine os cátions e os ânions, respectivamente, que se descarregam primeiro: A)Ca 2+(AQ) E Br-(AQ) B)Ca 2+(AQ) E OH-(AQ) C)H 3 O+(AQ) E Br-(AQ) D)H 3 O+(AQ) E OH-(AQ) E) Ca 2+(AQ) E H 3 O+(AQ)

DUREZA DA ÁGUA Uma "água dura" contém íons Ca 2+ e Mg 2+, que interferem na ação do sabão e deixam um resíduo nas paredes de tanques e caldeiras. É possível "amolecer" uma "água dura" adicionando substâncias que retiram estes íons e liberam, em seu lugar, íons Na+. Se uma "água dura" contém 0, 010 mol/l de Ca 2+ e 0, 005 mol/l de Mg 2+, quantos mols de Na+ são necessários para substituir os íons de cálcio e magnésio em 1000 litros desta água? a. 10 b. 15 c. 20 d. 30 E. 40

DILUIÇÃO Qual será o volume de água que deve ser acrescentado a 300 ml de uma solução 1, 5 mol/l de ácido clorídrico (HCl) para torná-la 0, 3 mol/l? A) 1000 m. L B) 1500 m. L C) 1200 m. L D) 1800 m. L E) 500 m. L

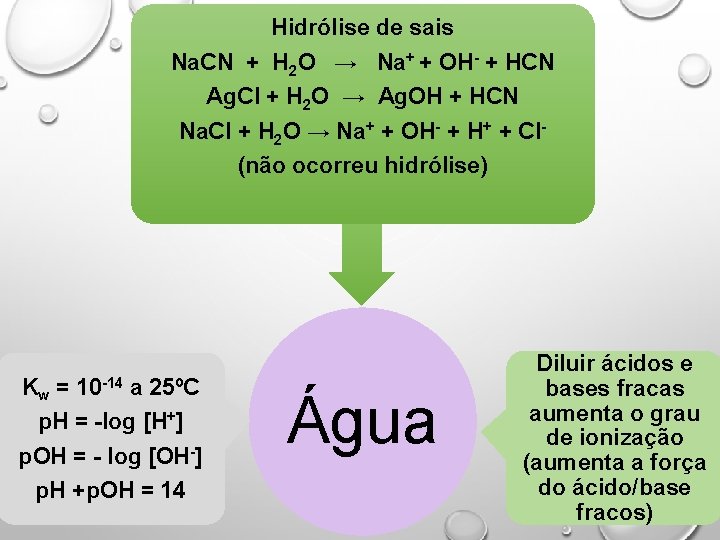
Hidrólise de sais Na. CN + H 2 O → Na+ + OH- + HCN Ag. Cl + H 2 O → Ag. OH + HCN Na. Cl + H 2 O → Na+ + OH- + H+ + Cl(não ocorreu hidrólise) Kw = 10 -14 a 25ºC p. H = -log [H+] p. OH = - log [OH-] p. H +p. OH = 14 Água Diluir ácidos e bases fracas aumenta o grau de ionização (aumenta a força do ácido/base fracos)

HIDRÓLISE DE SAIS Qual dos compostos fornecidos abaixo, se dissolvido em água, forma uma solução com p. H maior que 7? a) Na 2 S b) Na. Cl c) (NH 4)2 SO 4 d) KNO 3 e) NH 4 Br

HIDRÓLISE DE SAIS O fermento em pó e o sal de fruta tem como principal componente a substância de fórmula Na. HCO 3, cujo nome é: a. amoníaco. b. carbonato de sódio. c. carbureto. d. bicarbonato de sódio. e. carbonato básico de sódio.

O DESEJO É QUE FAÇAS UMA EXCELENTE PROVA

CONCURSOS DA UNEMAT – QUÍMICA • 2016: RECONHECIMENTO DE FUNÇÕES ORG NICAS, FÓRMULAS (ÁCIDOS, BASES, SAIS E ÓXIDOS) E DILUIÇÕES. • 2015: RADIOATIVIDADE, ELETROQUÍMICA, CONCENTRAÇÃO EM MG/L E TABELA PERIÓDICA. • 2014: RECONHECIMENTO DE FUNÇÕES ORG NICAS, ELETROQUÍMICA, REATIVIDADE DOS METAIS, FÓRMULAS DE COMPOSTOS INORG NICOS E REAÇÕES DE COMBUSTÃO. • 2013: FÓRMULAS DE COMPOSTOS INORG NICOS, ELETROQUÍMICA, TABELA PERIÓDICA E RECONHECIMENTO DE FUNÇÕES ORG NICAS. • 2012: ESTADOS FÍSICOS, MUDANÇAS DE ESTADO FÍSICO, DILUIÇÃO, FÓRMULAS DE COMPOSTOS DE USO COMUM, EQUAÇÃO DE CLAPEYRON, PH, HIDRÓLISE DE SAIS E BIOQUÍMICA.