Leyes fsicas Estructura atmica de la materia Ondas












- Slides: 19

Leyes físicas Estructura atómica de la materia Ondas Electromagnéticas La tabla periódica

U 10 |Leyes físicas Teoría de la relatividad de Einstein Teoría cuántica

U 10 |Teoría de la relatividad de Einstein Según la teoría de la relatividad de Einstein, la masa puede transformarse en energía y viceversa. Defecto de masa: Diferencia de masa entre la suma de las masas de las partículas que constituyen el núcleo atómico y la masa real del núcleo. Esta diferencia se debe a la energía del enlace entre las partículas nucleares. Albert Einstein. Físico alemán premio Nobel de física en 1921.

U 10 |Teoría cuántica Según la teoría cuántica se considera que la materia emite o absorbe energía radiante de manera discontinua mediante corpúsculos elementales. Cada uno de estos corpúsculos se demomina quantum de energía, o también fotón. Max Planck (1858 -1947). Fundador de la teoría cuántica y uno de los mayores físicos del siglo XX. Premio Nobel de Física de 1918.

U 10 |Estructura atómica de la materia Modelos atómicos: - Thomson - Rutherford - Bohr - Nube de carga: - Orbitales - Niveles de energía - Configuración electrónica La masa de los átomos

U 10 |Modelo atómico de J. J. Thomson sugirió que el átomo es una esfera uniforme de electricidad positiva donde se encuentran inmersos los electrones, muy separados los unos de los otros a causa de las fuerzas de repulsión. Este modelo explica perfectamente por qué los átomos son neutros y por qué, cuando se pierden algún o algunos electrones, el átomo se ioniza. Modelo atómico de J. J. Thomson (1904).

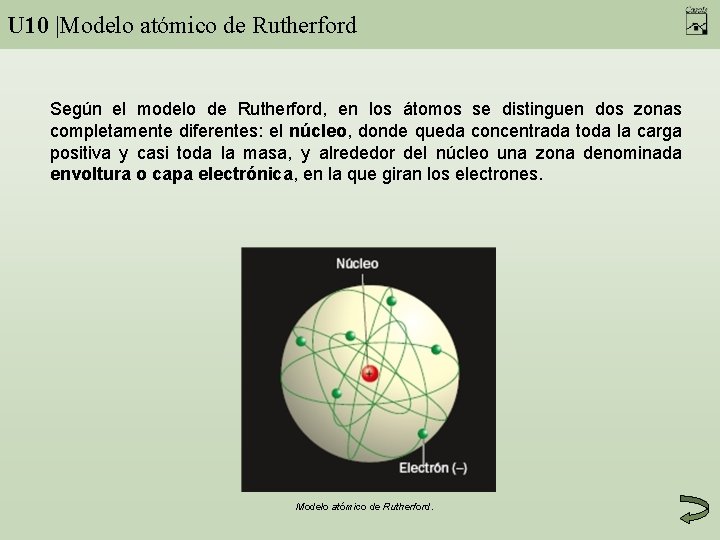
U 10 |Modelo atómico de Rutherford Según el modelo de Rutherford, en los átomos se distinguen dos zonas completamente diferentes: el núcleo, donde queda concentrada toda la carga positiva y casi toda la masa, y alrededor del núcleo una zona denominada envoltura o capa electrónica, en la que giran los electrones. Modelo atómico de Rutherford.

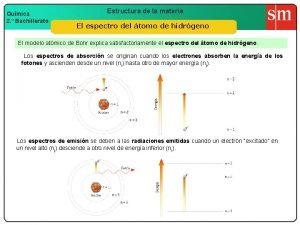
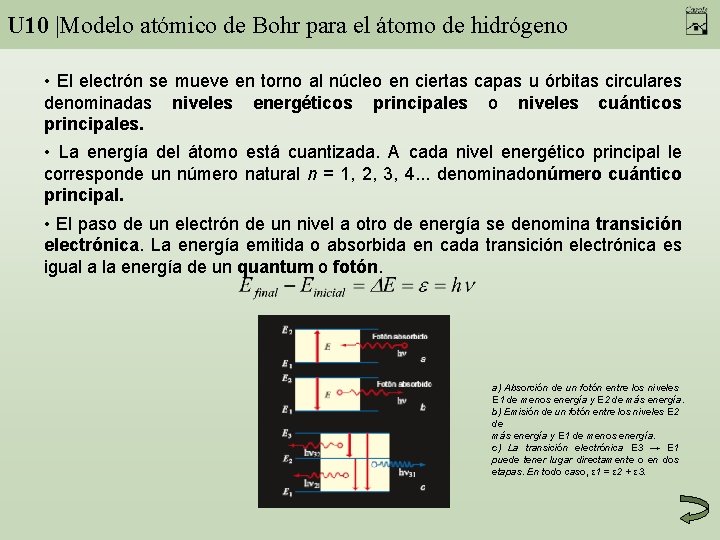
U 10 |Modelo atómico de Bohr para el átomo de hidrógeno • El electrón se mueve en torno al núcleo en ciertas capas u órbitas circulares denominadas niveles energéticos principales o niveles cuánticos principales. • La energía del átomo está cuantizada. A cada nivel energético principal le corresponde un número natural n = 1, 2, 3, 4. . . denominadonúmero cuántico principal. • El paso de un electrón de un nivel a otro de energía se denomina transición electrónica. La energía emitida o absorbida en cada transición electrónica es igual a la energía de un quantum o fotón. a) Absorción de un fotón entre los niveles E 1 de menos energía y E 2 de más energía. b) Emisión de un fotón entre los niveles E 2 de más energía y E 1 de menos energía. c) La transición electrónica E 3 → E 1 puede tener lugar directamente o en dos etapas. En todo caso, ε 1 = ε 2 + ε 3.

U 10 |Modelo atómico de la nube de carga -el orbital. Se denomina orbital del electrón a la región del espacio donde con más probabilidad se halla el electrón, es decir, donde la densidad electrónica es máxima. Un orbital se representa por medio de una nube de puntos. Es un orbital puede haber, como máximo, la carga total de dos electrones. Representación por medio de una nube electrónica de la posición del electrón del átomo de hidrógeno alrededor del núcleo positivo.

U 10 | Modelo atómico de la nube de carga –niveles de energía- Esquema para recordar el orden en que se van llenando los orbitales atómicos por orden creciente de energía. Energías relativas de los orbitales en los átomos neutros. Los electrones ocupan el orbital disponible de menor energía. Cada orbital está representado por un cuadrado.

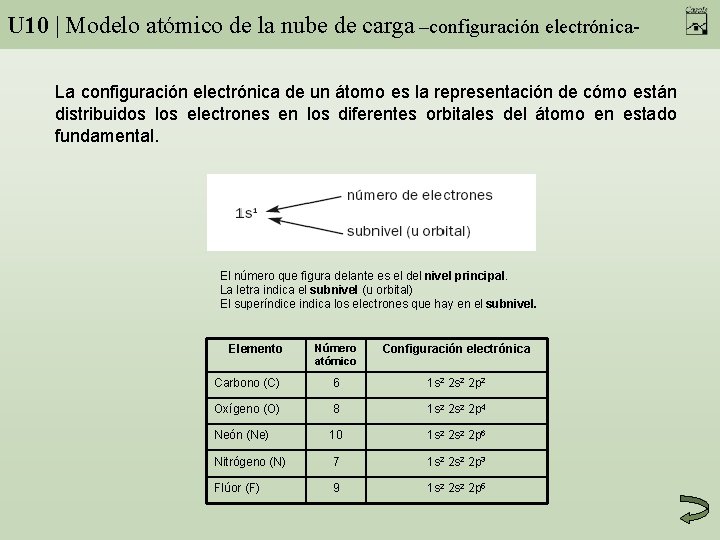
U 10 | Modelo atómico de la nube de carga –configuración electrónica. La configuración electrónica de un átomo es la representación de cómo están distribuidos los electrones en los diferentes orbitales del átomo en estado fundamental. El número que figura delante es el del nivel principal. La letra indica el subnivel (u orbital) El superíndice indica los electrones que hay en el subnivel. Número atómico Configuración electrónica Carbono (C) 6 1 s 2 2 p 2 Oxígeno (O) 8 1 s 2 2 p 4 Neón (Ne) 10 1 s 2 2 p 6 Nitrógeno (N) 7 1 s 2 2 p 3 Flúor (F) 9 1 s 2 2 p 5 Elemento

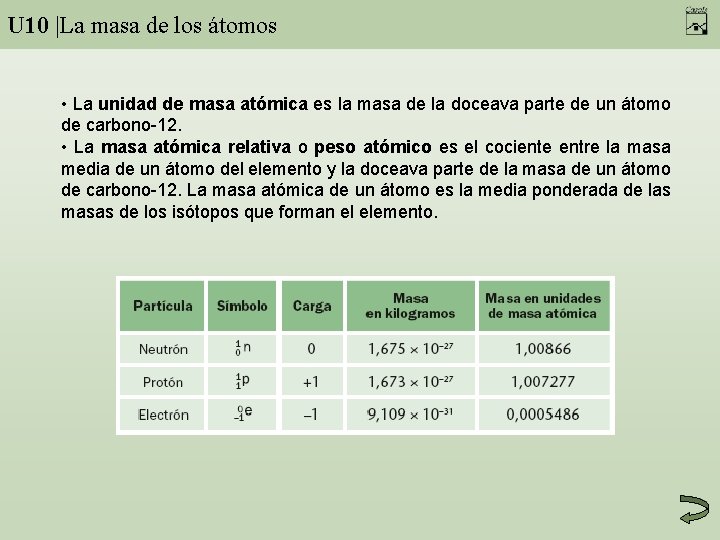
U 10 |La masa de los átomos • La unidad de masa atómica es la masa de la doceava parte de un átomo de carbono-12. • La masa atómica relativa o peso atómico es el cociente entre la masa media de un átomo del elemento y la doceava parte de la masa de un átomo de carbono-12. La masa atómica de un átomo es la media ponderada de las masas de los isótopos que forman el elemento.

U 10 |Ondas electromagnéticas Conceptos básicos Los espectros Espectro electromagnético

U 10 |Ondas electromagnéticas: Conceptos básicos • La longitud de onda λ es la distancia entre dos puntos consecutivos de una onda que se encuentran en fase. • El período T es el tiempo que tarda una onda en recorrer una longitud de onda. • La frecuencia ν es el número de ciclos u oscilaciones por unidad de tiempo. • La velocidad de propagación de una onda se calcula por el cociente La propagación en forma de ondas transversales de un campo eléctrico y un campo magnético que vibran perpendicularmente entre ellos, originados por una carga eléctrica acelerada, constituye una radiación electromagnética.

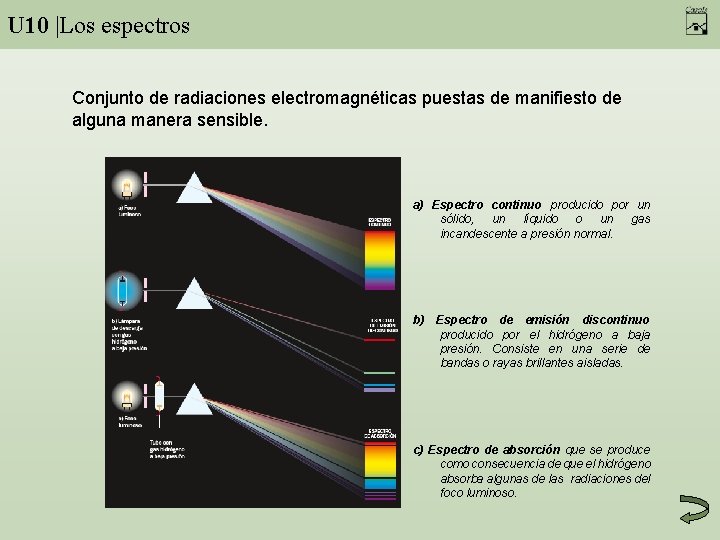
U 10 |Los espectros Conjunto de radiaciones electromagnéticas puestas de manifiesto de alguna manera sensible. a) Espectro continuo producido por un sólido, un líquido o un gas incandescente a presión normal. b) Espectro de emisión discontinuo producido por el hidrógeno a baja presión. Consiste en una serie de bandas o rayas brillantes aisladas. c) Espectro de absorción que se produce como consecuencia de que el hidrógeno absorba algunas de las radiaciones del foco luminoso.

U 10 |Espectro electromagnético Los diferentes tipos de ondas electromagnéticas se caracterizan por su frecuencia (o longitud de onda). Espectro de las ondas electromagnéticas y franja correspondiente a la luz visible.

U 10 |La tabla periódica Descripción Periodicidad y configuración electrónica

U 10 |Descripción de la tabla periódica Períodos Filas horizontales numeradas del 1 al 7 en las que se alinean los elementos. Grupos de elementos o familias Grupos de elementos que presentan ciertas similitudes contenidos en columnas numeradas del 1 al 18. Grupo 1 Metales alcalinos Grupo 2 Metales alcalinotérreos Grupos 3 al 12 Metales de transición Grupo 13 Familia del Boro Grupo 14 Familia del Carbono Grupo 15 Familia del Nitrógeno Grupo 16 Familia de los Calcógenos Grupo 17 Halógenos Grupo 18 Gases Nobles

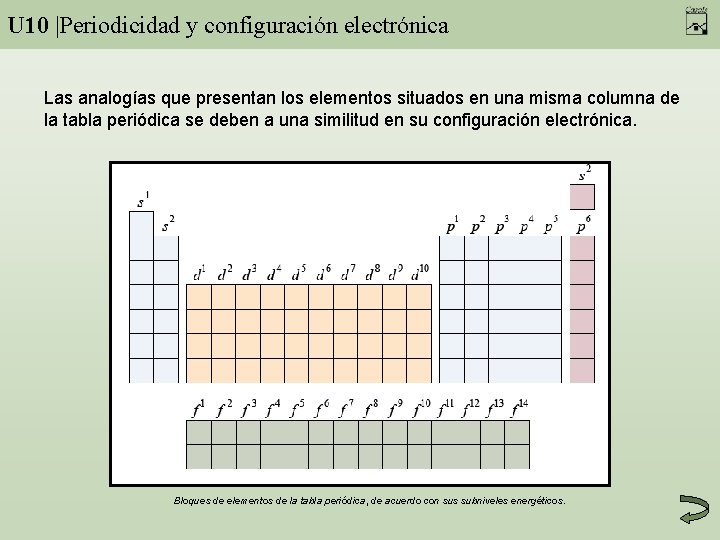
U 10 |Periodicidad y configuración electrónica Las analogías que presentan los elementos situados en una misma columna de la tabla periódica se deben a una similitud en su configuración electrónica. Bloques de elementos de la tabla periódica, de acuerdo con sus subniveles energéticos.
 Masa atomica absoluta
Masa atomica absoluta Atmica
Atmica Comisin
Comisin Relacion molar
Relacion molar Atmica
Atmica Atmica
Atmica Modelo atomico de dalton
Modelo atomico de dalton Atmica
Atmica Atmica
Atmica Atomizadores continuos
Atomizadores continuos Redes bravais
Redes bravais Estructura de la materia
Estructura de la materia Propagacion de un pulso
Propagacion de un pulso Ondas troposfericas
Ondas troposfericas Que es una onda
Que es una onda Clasificación de las ondas mecánicas
Clasificación de las ondas mecánicas Equações de lagrange
Equações de lagrange Clasificacion de las ondas
Clasificacion de las ondas Interferencia de ondas
Interferencia de ondas Movimiento ondulatorio ejemplos
Movimiento ondulatorio ejemplos