LES METHODES DETUDE DE LA CELLULE La cellule













- Slides: 23

LES METHODES D’ETUDE DE LA CELLULE

La cellule est l’unité structurale et fonctionnelle fondamentales des organismes vivants et en raison de sa petite taille, la biologie cellulaire à, tout d’abord, besoin d’en obtenir une image agrandie de bonne qualité. Les microscopes utilisent la déviation d’un flux ondulatoire de particules, soit les photons soit les électrons au travers d’un système de lentilles de manière à former d’un objet à étudier une image agrandie. , Afin d’observer des détails encore plus fins, il faut augmenter la résolution, qui est généralement proportionnelle à la longueur d’onde de la radiation utilisés pour interférer avec les structures étudiées.

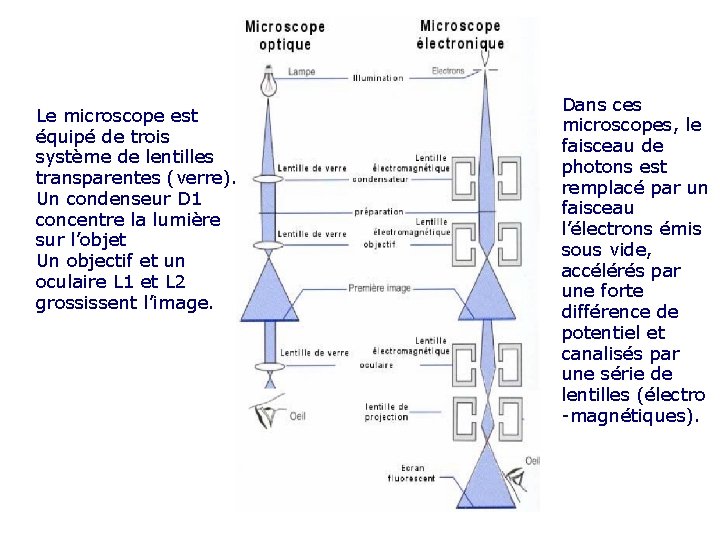
La microscopie optique Les microscopes optiques (à lumière ou photoniques) permettent l’observation de cellules vivantes ou mortes, grâce à des coupes très fines de préparations fixées. Les microscopes optiques utilisent de la lumière visible. Son pouvoir séparateur ou limite de résolution est de 0, 2 μm. On obtient un grossissement x 1000 Le pouvoir séparateur est la capacité de distinguer deux points adjacents comme distincts. L’œil a la capacité de distinguer des particules d'un diamètre pouvant atteindre 0. 1 μm. Toutefois, elles doivent être séparées entre elles d'une distance d'au moins 5 μm. Le pouvoir séparateur de l’œil est de 5μm.

Microscope électronique Les microscopes électroniques utilisent des faisceaux d’électrons qui sont chargés, possèdent une masse et se comportent comme une onde. Plus les électrons sont accélérés et plus la résolution augmente. On obtient ici un grossissement x 100 000. Le pouvoir séparateur du microscope électronique est de 0, 2 nm et est 1 000 fois plus élevé que pour le microscope optique.

Le microscope est équipé de trois système de lentilles transparentes (verre). Un condenseur D 1 concentre la lumière sur l’objet Un objectif et un oculaire L 1 et L 2 grossissent l’image. Dans ces microscopes, le faisceau de photons est remplacé par un faisceau l’électrons émis sous vide, accélérés par une forte différence de potentiel et canalisés par une série de lentilles (électro -magnétiques).

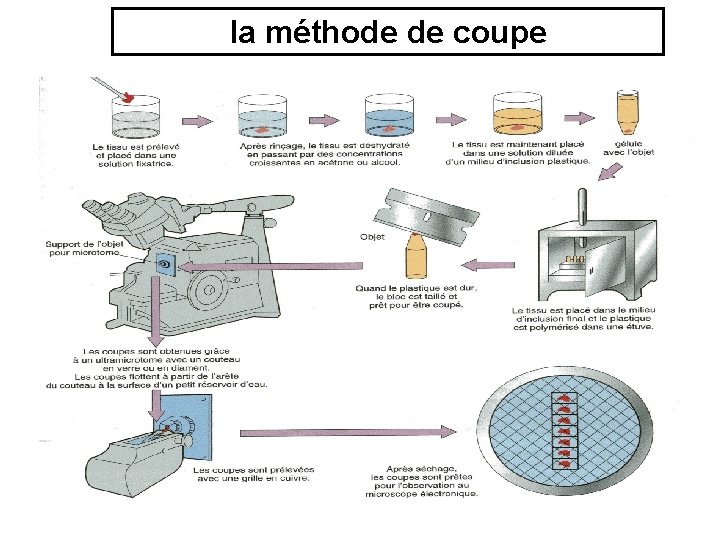
Observation microscopique de la cellule Techniques de préparation des coupes : En microscopie optique ou électronique, la préparation comporte généralement 4 étapes: • Fixation • Déshydratation • Inclusion • Coupe

la méthode de coupe

LA FIXATION Préserve la structure de la cellule morte Les méthodes de fixation : Fixateurs ·Tuent la cellule en gardant en place ses constituants ·Formaldéhyde ou glutaraldéhyde, tétroxyde d'osmium, moyens physiques (ex: basses températures)

DESHYDRATATION L'eau est retirée de la cellule au cours de passages successifs dans des bains d'alcool de plus en plus concentré.

INCLUSION · Le milieu d'enrobage, ou d'inclusion est miscible avec la solution servant à la déshydratation · Milieu intermédiaire: xylène, toluène…… · Le milieu d'enrobage plastiques de type paraffine ou résine époxy (remplace complètement le toluène) · Le milieu d'inclusion doit passer de l'état liquide à l'état solide avant d'être coupé (cette solidification s'effectue par polymérisation).

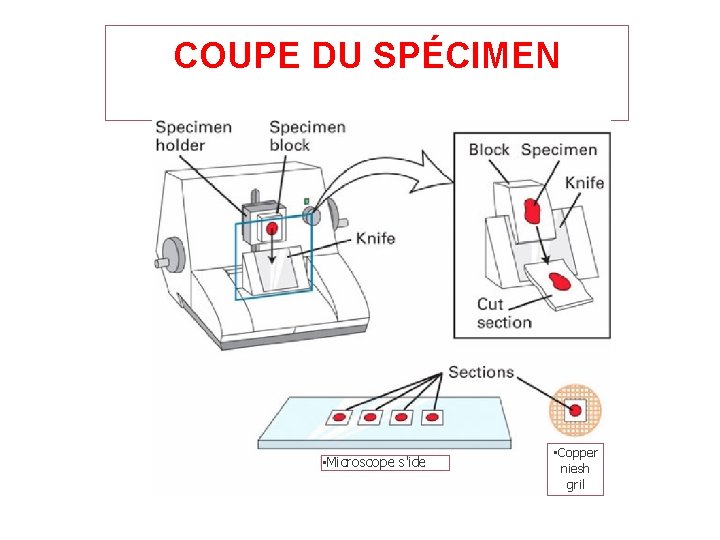
COUPE DU SPÉCIMEN • Microscope s'ide • Copper niesh gril

OMBRAGE METALLIQUE Charpente cellulosique de la paroi végétale Virus de la Mosaique du tabac

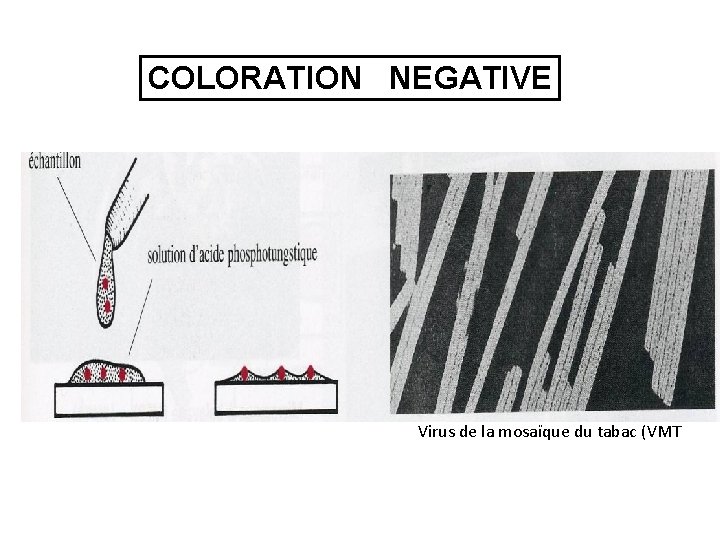
COLORATION NEGATIVE Virus de la mosaïque du tabac (VMT

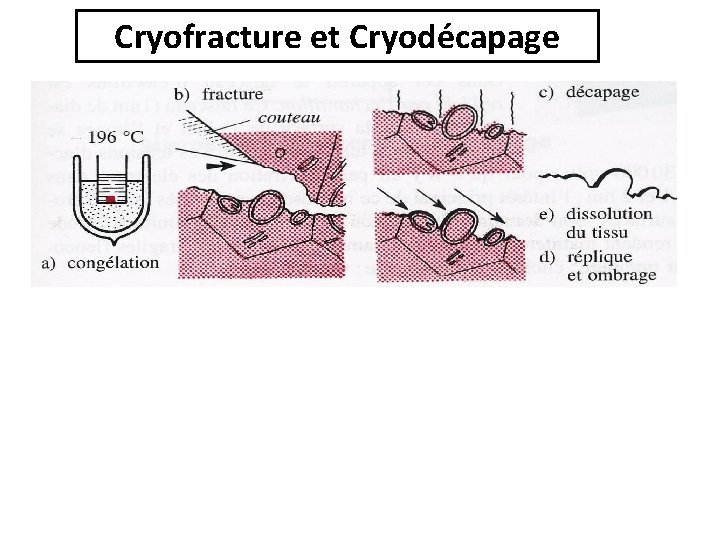
Cryofracture et Cryodécapage

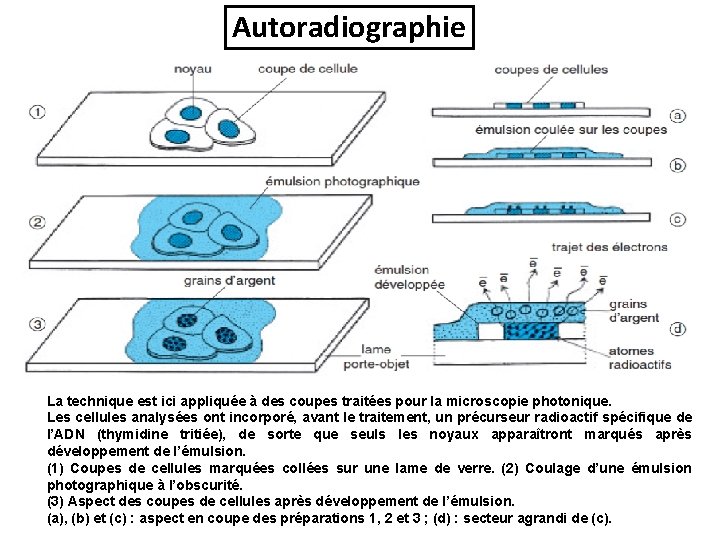
Autoradiographie La technique est ici appliquée à des coupes traitées pour la microscopie photonique. Les cellules analysées ont incorporé, avant le traitement, un précurseur radioactif spécifique de l’ADN (thymidine tritiée), de sorte que seuls les noyaux apparaîtront marqués après développement de l’émulsion. (1) Coupes de cellules marquées collées sur une lame de verre. (2) Coulage d’une émulsion photographique à l’obscurité. (3) Aspect des coupes de cellules après développement de l’émulsion. (a), (b) et (c) : aspect en coupe des préparations 1, 2 et 3 ; (d) : secteur agrandi de (c).

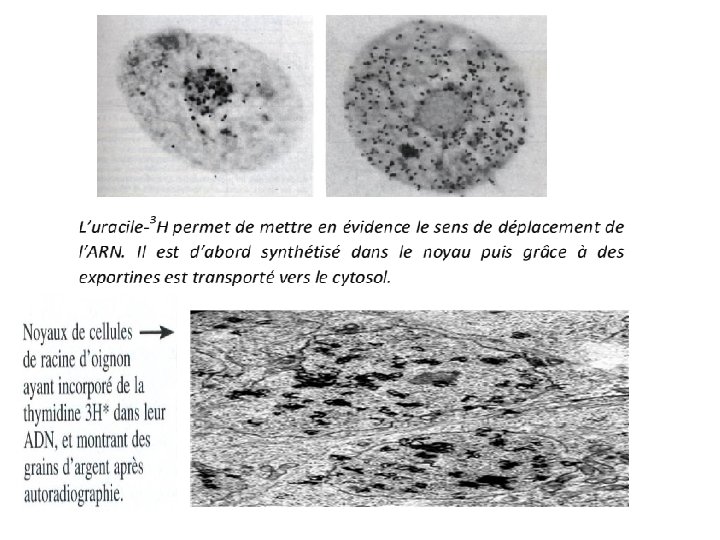
On cultive des cellules in-vitro, dans un milieu. On ajoute dans le milieu des acides aminés, qui sont marqués radioactivement. C'est l'étape de pulse, qui dure quelques minutes, le temps de l'incorporation des acides aminés dans la chaîne biosynthétique. On place ensuite les cellules dans un milieu où les acides aminés ne sont pas marqués radioactivement. C'est l'étape de chasse. On prélève des cellules de ce nouveau milieu ; Par l'autoradiographie: on prépare une coupe de la cellule, par fixation puis découpage au microtome. Sur la plaquette obtenue, on dépose un film photographique contenant des grains d'argent, et on laisse le tout reposer quelques semaines à l'obscurité. Les électrons β ou rayons γ issus de la désintégration des noyaux radioactifs assimilés par la cellule réduisent les ions Ag+ en grains noirs d'argent, donnant ainsi une « photographie » de la localisation de la radioactivité cellulaire. On peut ainsi retracer, par observation de lames minces le trajet cellulaire des protéines lors de leur synthèse.


Méthode de fractionnement cellulaire Les méthodes de fractionnement subcellulaire consistent à séparer les différents composants cellulaires par destruction de la membrane plasmique, suivie par certaines techniques de séparations.

Centrifugation différentielle La centrifugation différentielle (fractionnement cellulaire), permet la purification de l’homogénat en fonction de la masse et de la densité de ses constituants. Pour se faire on centrifuge l’homogénat à différentes vitesses ; à chaque vitesse, différents organites se déposent dans le culot, qui sera prélevé. Les particules plus grosses et les plus denses de l’homogénat forment le premier sédiment (ou culot) rassemblé au fond du tube à centrifuger, le liquide surnageant contenant les plus petites et les plus légères. Le surnageant et le culot sont séparés par décantation.

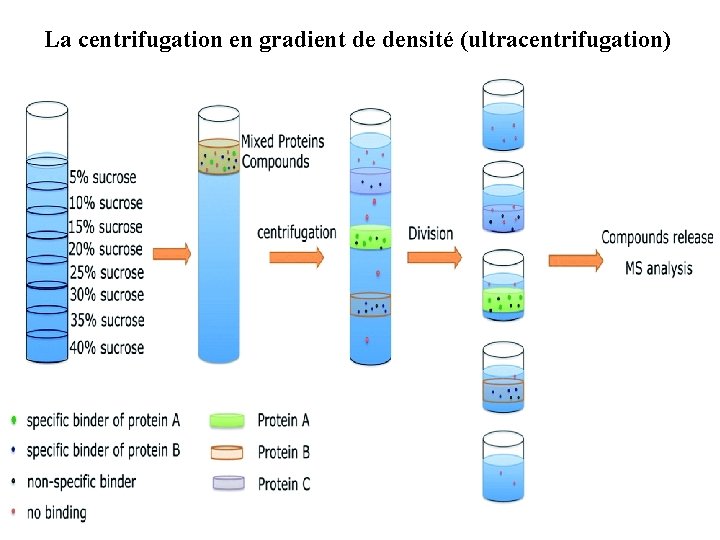
La centrifugation en gradient de densité (ultracentrifugation) 1. Par gradient préformé La centrifugation par gradient de densité consiste à déposer une mince couche d’homogénat au dessus de la solution de saccharose dont la concentration varie de façon régulière et décroissante du bas vers le haut. Les différents constituants de l’homogénat sédimentent tous à des vitesses différentes, on obtient ainsi différentes bandes (la couche la plus dense étant au fond) que l’on séparera.

La centrifugation en gradient de densité (ultracentrifugation)

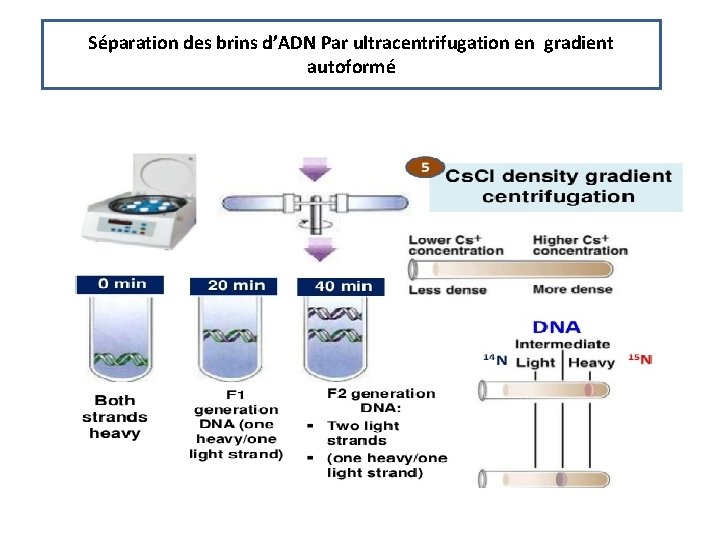
2. Par gradient autoformé L’échantillon (en général, des acides nucléiques) est au départ dissous dans la solution de Cs. Cl au sein de laquelle s’établit, au cours de la centrifugation, un gradient continu de concentration et de densité. Les molécules se séparent en bandes selon leur seule densité et restent ainsi à l’équilibre. Par cette technique, on peut aussi séparer des molécules d’ADN dont les différences de densité sont dues à la présence d’isotopes lourds (ADN contenant par exemple du N 15 au lieu du N 14 normal ).

Séparation des brins d’ADN Par ultracentrifugation en gradient autoformé