LES LIPIDES LIPIDES 1 Classification des lipides alimentaires
































- Slides: 40

LES LIPIDES

LIPIDES 1°) Classification des lipides alimentaires : Les lipides simples : ce sont des esters d'acides gras avec des alcools, les plus importants sont les triglycérides, les monoglycérides, les esters de la vita A et de la vita D et les esters de cholestérol. Les lipides composés : ce sont des produits complexes, qui contiennent d'autres groupements en plus d'un acide gras ou un alcool par exemple : les phospholipides utilisés comme émulsifiants. Ils contiennent en plus dans leur molécule de l'azote, du soufre. . . Les dérivés de lipides : ce sont des substituants qui dérivent des lipides par hydrolyse tels que les acides gras et les vitamines liposolubles

Les acides gras sont des acides le plus souvent monocarboxyliques : à nombre d'atome de carbone > 4 - saturés ou non, généralement non ramifiés, parfois cycliques. - sont porteurs de fonctions, autres que la fonction carboxylique (-COOH) les aminoacides par exemple : la longueur de chaîne des acides gras est définie par le nombre d'atomes de carbone et qui varie entre 4 et 32, dans la nature il est quasi généralement pair : - les A. G. sont à chaîne courte lorsque le nombre de carbone C < 6. - Les A. G. sont à chaîne moyenne lorsque le nombre de carbone 6< C<14. - Les A. G. sont à chaîne longue lorsque le nombre de carbone C > 14 La numérotation des atomes de carbone se fait à partir de la fonction acide carboxylique (…- COOH).

2°) Types d'acides gras : Acides gras saturés : les acides gras naturels possèdent un nombre pair de carbone, ce qui résulte du mécanisme de leur biosynthèse à partir d'un composé à 2 atomes de carbone : "acétyl-coenzyme A", leur nombre d'atome de carbone varie de 4 (pour l'acide butyrique) à 32 (les cires) : Les cires : ce sont des esters d'acides gras et d'alcool à chaîne longue : pour les mettre en évidence, il faut froidir lřhuile alimentaire. Acides gras à chaîne droite : Formule brute : Cn. H 2 n. O 2 (n = nombre pair d'atome de carbone compris entre 4 à 32). Formule développée : H 3 C CH 2 . . . CH 2 COOH La chaîne carbonée de l'acide gras est "lipophile" alors que le groupement carboxylique COOH (polaire) est hydrophile. Acides gras à chaîne ramifiée : la plupart de ces acides gras ne possèdent qu'une seule ramification.

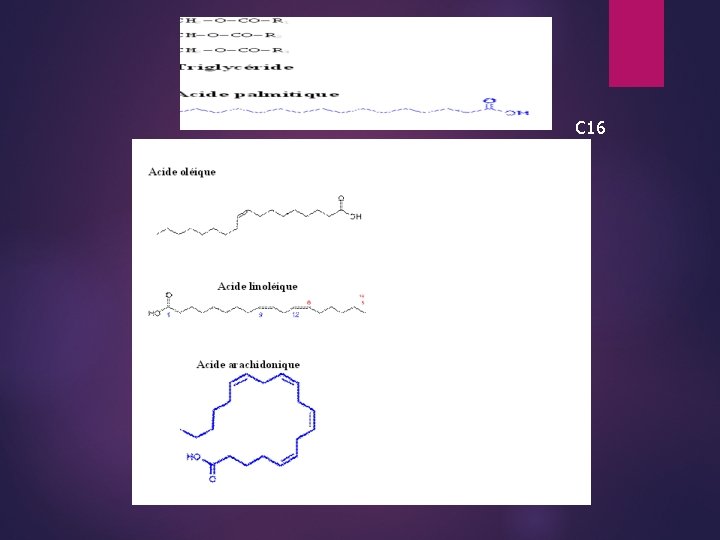
Classification de quelque A. G : C 16 H 32 O 2 : acide palmitique. Si 4 < n < 10 : l'acide gras est dit butyreux Si 12 < n < 24 : L'AG fait partie des huiles animales ou végétales. Si 26 < n < 32 : L'AG est un constituant de cires (céride).

A température ambiante : Si n < 10 : L'AG se trouve à l'état liquide Si 10 < n < 12 : L'AG est à l'état solide Si n > 12 : l'A. G. est insoluble dans l'eau ●Acides gras insaturés : leur chaîne carbonée est droite et peut être parfois ramifiée possédant une ou plusieurs doubles liaisons, d'où possibilité d'isoméries cis-trans. * A. G monoéthylénique : Acide oléique (abondant dans l'huile d'olive 55% à 82%). La seule double liaison est entre C 9 = C 10 (C 18 H 34 O 2) : C 18 : 1. * A. G. diéthylénique : Acide linoléique : C 18 H 32 O 2 : C 18 : 2. Il présent 2 doubles liaisons au niveau de C 9 = C 10 et C 12 = C 13, on la dénomme C 18 : 2 ; 2 à cause de nombre de double liaison (2). • A. G polyéthylénique : (polyinsaturé) : acide arachidonique C 26 H 40 O 3 il possède 4 double liaisons : C 5 = C 6 ; C 8 = C 9 ; C 11 = C 12 et C 14 = C 15. - La teneur en lipides dans les denrées alimentaires est variable

C 16


3°) Principaux constituants chimiques des corps gras : Acides gras saturés : * Acides courts caractéristiques des matières grasses laitières : Acide butyrique (acide butanoïque) C 4 H 8 O 2 : 0 C 4 : O Acide caproïque (hexanoïque) : C 6 H 12 O 2 : 0 C 6 : 0 Acide caprylique (octanoïque) : C 8 H 16 O 2 : 0 ou C 8 : 0 *Acides moyen : constituants principaux des huiles dites laurique : Acide caprique (décanoïque) : C 10 H 20 O 2 : O ou C 10 : O A. Laurique (dodécanoïque) : C 12 H 24 O 2 : O ou C 12 : O Myristique (Tétradécanoïque) : C 14 H 28 O 2 : O ou C 14 : O * Acides lourds (longs) A palmitique (hexadécanoïque) : C 16 H 32 O 2 : O ou C 16 : O A. Stearique (octadécanoïque) : C 18 H 36 O 2 : O ou C 18 : O Le premier est abondant des huiles végétales, le 2 nd est présent à côté du palmitique dans les H. G d'origine animale en quantités équivalentes. L'Acide stéarique est présent dans les huiles hydrogénées. * Acides très longs : - Acide aractique : C 20 H 40 O 2 : O (C 20 : O) - Acide béhénique : C 22 H 44 O 2 : O (C 22 : O) - Acide lignocérique : C 24 HO 2 : O (C 24 : O) - Acide cérotique : C 26 H 52 O 2 : O (C 26 : O) présents en faibles proportions dans quelque corps gras végétaux.

Acides monoénique : (C=C) - Acide oléïque : C 18 : 1 ou CH 3 -(CH 2)4 -CH=CH-(CH 2)17 -COOH * Acides polyéniques : ces acides sont représentés dans les corps gras par 2 acides majoritaires : acide linoléique C 18 : 2 et acide linolénique - C 18: 3. * Acides polyinsaturés

Composition en A. G des graines végétales : A. G C 6 C 8 C 10 C 12 C 14 C 16 : 0 C 16 : 1 C 18 : 0 C 18 : 1 C 18 : 2 C 20 : 0 Palme Coprah Palmiste Beurre du Cacao 1, 2 0, 8 - 46 41, 1 - 59, 3 0, 5 3, 726 - 53 1, 7 - 10 1 0, 2 - 1, 2 6, 1 - 9, 2 5, 1 - 6? 2 44 - 54 14, 8 - 21, 3 8 - 11, 9 2 - 5, 1 11 - 17 2 -5 - 0, 2 2, 5 -4, 0 2, 5 - 3, 8 42 - 51 14, 3 - 17 7, 9 - 11 32 - 35 33 - 34 2, 5 - 3 - 25 - 29 0, 8 30 - 41 45 - 50 4 -5 1

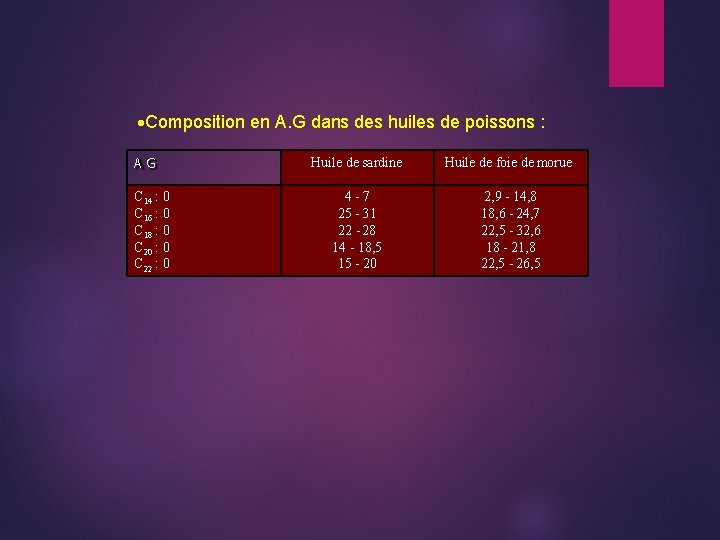
Composition en A. G dans des huiles de poissons : AG C 14 : 0 C 16 : 0 C 18 : 0 C 20 : 0 C 22 : 0 Huile de sardine Huile de foie de morue 4 -7 25 - 31 22 - 28 14 - 18, 5 15 - 20 2, 9 - 14, 8 18, 6 - 24, 7 22, 5 - 32, 6 18 - 21, 8 22, 5 - 26, 5

4°) Solubilité des lipides - Les mono, et les diglycérides, sont plus soluble que les triglycérides. -La présence des liaisons doubles dans les A. G favorise la solubilisation et dans ce cas, le lipide est plutôt sous forme liquide (il est plus soluble) -La solubilité peut-être influencée par la conformation géométrique du lipide (cis ou trans). Exemple : -A. G. : 18 : 1 acide oléique : forme cis a un point de fusion de 18°C et la forme trans a un point de fusion de 48°C. Donc il est plus soluble lorsqu'il est sous la forme cis. 6°) Modification des huiles et des graisses : -Les lipides peuvent subir des modifications indirectes pour répondre à certains besoins de consommation. -A l'état naturel, les huiles et les graisses sont surtout sous forme de triglycérides et d'esters d'acides gras et de glycérol. Ils peuvent avoir de 0 à 6 doubles liaisons. -Toutes les huiles naturelles contiennent des proportions variables dont moins 4 acides gras d'acide linoléique.

a-Hydrogénation catalytique : - Elle consiste en l'addition d'hydrogène gazeux à la ou aux doubles liaisons des acides gras mono ou polyinsaturés. Cette opération industrielle permet la conversion des huiles alimentaires liquides en matière grasse plastique pour la production de la margarine et des substances émulsifiables. Ce processus d'hydrogénation réduit la susceptibilité de certaines huiles à l'oxydation. Acide gras insaturé Acide gras saturé facilité d'oxydation. moins facilement oxydé. - La vitesse d'oxydation diminue avec la diminution des insaturations. - La réaction d'hydrogénation catalytique se déroule en présence de 3 phases : *Le catalyseur à l'état solide : le Ni est le catalyseur approprié (moins cher). * L'huile alimentaire liquide. * L'hydrogène gazeux

b-La saponification : - Cette réaction ne dure que 15 mn pour se limiter à des réactions de saponification parasitaire. - C'est une réaction, au cour de laquelle la soude Na. OH neutralise les acides gras libres et des esters, a des applications industrielles dans la fabrication des savons et aussi sur le plan analytique pour mesurer la longueur des chaînes. - L'indice de saponification IS qui peut nous renseigner sur la longueur moyenne des chaînes carbonées des acides gras dans une matière grasse. IS = quantité d'ester + quantité des acides gras libres. Triglycéride + 3 KOH ou 3 Na. OH Glycérol + Savon.

5°) Réactions d'oxydation des lipides -Les substrats des réactions d'oxydation des lipides sont les acides gras libres mono et polyinsaturés. -Ces acides gras libres s'oxydent en général plus vite que l'orsqu'ils font partie des molécules de glycérides ou de phospholipides (phosphatidines). -C'est surtout le degré d'insaturation qui influence la vitesse d'oxydation : à 100°C les vitesses relatives d'oxydation des acides stéarique (C 18 : 0), oléique (C 18 : 1), linoléique (C 18 : 2), linolénique (C 18 : 3) sont respectivement : 1, 1000 -1500, 2000 -3500. -Les acides gras saturés ne s'oxydent qu'à des températures supérieures à 60°C. -Le principal problème posé par les réactions d'oxydation des lipides réside dans la formation de composés volatiles d'odeurs désagréables ce qui peut limiter la durée de conservation d'aliments divers même renfermant moins de 1% de lipides.

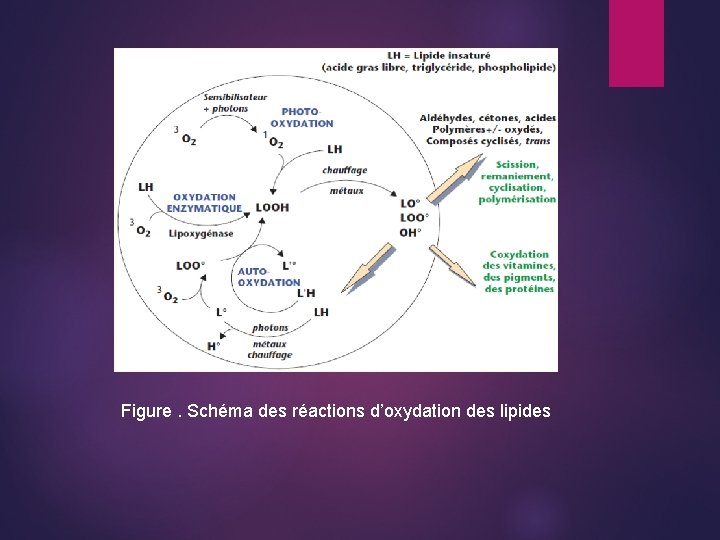
Schéma général des réaction d'oxydation des lipides : L’oxydation des lipides peut résulter de plusieurs voies réactionnelles en fonction du milieu et des agents initiateur : - l’auto-oxydation catalysée par la température, les ions métalliques, les radicaux libres ; - la photo-oxydation, initiée par la lumière en présence de photosensibilisateurs - l’oxydation enzymatique initiée par la lipoxygénase. Auto-oxydation: On peut distinguer dans l'oxydation des lipides 3 groupes de réactions : Réaction d'initiation : ces réactions donnent lieu à la formation de radicaux libres d'acides gras mono ou poly insaturés ou de peroxydes lipidiques. Cette réaction a une énergie d'activation élevée : de 39 à 65 kcal/mol dans cette étape, l'H est arraché à partir d'un A. G non saturé : R Ŕ H R° + H° On peut avoir également, une réaction par oxydation : R - H + O 2 R-O-O° + H+ (formation de peroxyde) Elle est favorisée par des températures, par la lumière, par les traces de certains métaux (ligands) : R - H + M n+ R° + H+ + M (n-1)+ Ces traces des métaux jouent le rôle de catalyseur.

Réaction de propagation : ces réactions se caractérisent par une accumulation de peroxydes lipidiques. Ces réactions constituent l'étape d'oxydation par l'oxygène gazeux des acides gras insaturés. Ces réactions nécessitent l'intervention des radicaux libres mais en créant autant qu'elles consomment. ROO° + H+ R-H + O 2 R° + O 2 (initiation) ROO° radical peroxydique. ROO° + RH ROOH + R° (Ex : 3 à 5 kcal/mol) Réaction de terminaison (ou d'arrêt) : ce sont des réactions par lesquelles des radicaux libres peuvent s'associer pour donner des composés non radicalaires (stables). Ces radicaux libres proviennent en grande partie de la décomposition des peroxydes lipidiques, substances très instables et très réactives. R° + R° R 2 ROO° + R° n(ROO°) ROOR (RO 2)n (polymère)

L'oxydation des lipides peut entraîner donc : -Développement d'une odeur ronce -On favoriser le brunissement de Maillard non enzymatique -Une perte d'activité vitaminique et de la couleur - La diminution de la valeur nutritive des lipides: oxydation des A. G essentiel pour la nourriture. Photo-oxydation : -Cette réaction est catalysée par la lumière -La réaction de Photo-oxydation aboutit également à la formation d'hydropéroxyde, elle est plus rapide que Auto-oxydation. Le brunissement des aliments implique 2 réactions oxydatives enzymatique, et non enzymatique :

Le brunissement enzymatique, produit entre l'O 2 et les polyphénols catalysés par l'enzyme "polyphénol oxydase ": l'étape de cette réaction est la transformation phénolique en polymères colorés le plus souvent brunes ou noirs (charbonnage) La brunissement non enzymatique : désigne un ensemble de réactions chimiques Complexes et beaucoup d'étapes. -Ce type comprend 3 réactions : * Réaction de Maillard, entre les sucres réducteurs et les protéines (et acides aminés). * Caramélisation : résultat de la dégradation du sucres à haute T°. * La dégradation de la vitamine C (Acide Ascorbique) dont les dernières étapes est due à la réaction de Maillard. NB: La condensation des groupement aminés, entraîne, une baisse de la qualité nutritionnelle, de l'aliment (cas de la lysine) ainsi une baisse de solubilité et de digestibilité

La vitesse de brunissent non enzymatique est influencée par : -la nature du sucre (les sucres réducteurs sont plus réactifs) -la nature de l'acide aminé (ou protéine) : la lysine est la plus réactive des a. a car il a un groupe amine libre, - La température, le p. H (p. H acide augmente la vitesse de la réaction de Maillard), concentration de l'O 2, activité d'eau. -Les métaux : sulfates de Cu, sulfates de Fe favorise la réactions des catalyseurs. -Le Ca. Cl 2 : est un inhibiteur de la réaction * la caramélisation : la formation des pigments de caramel, est considéré comme une réaction non enzymatique de brunissement, elle se produit à haut température 200°C, quand ces réactions se produisent pendant le chauffage, il se forme des acides : (a. aminés) hétérogènes (comportant des atomes de N), qui confèrent aux produits alimentaires, la couleur, l'arôme et le goût.

Figure. Schéma des réactions d’oxydation des lipides

Tableau. Méthodes d’évaluation de l’état d’oxydation des huiles.

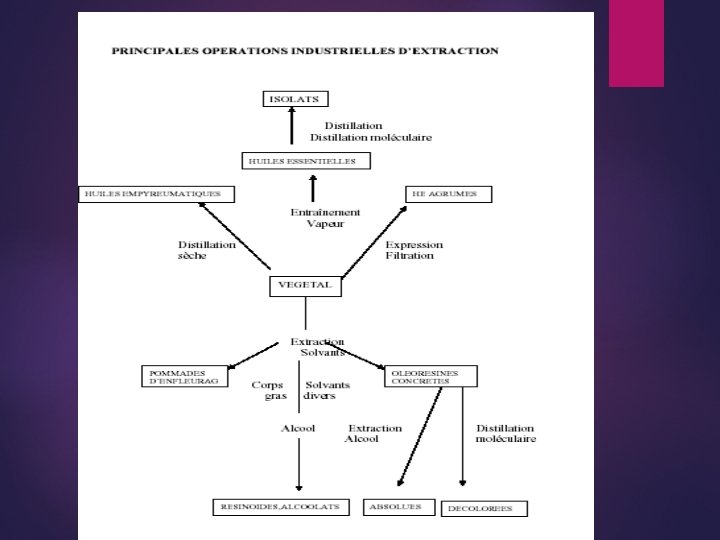
Extraction des arômes 4. 1. Introduction L'action de séparer une substance d'un composé dont elle fait partie, met en œuvres diverses opératoires fondamentales basées sur des phénomènes physiques. Elle cherche à isoler d'un mélange végétal complexe, des composants ou des groupes de composants possédant des propriétés organoleptiques. Les principales propriétés physiques mises en œuvre dans les opérations fondamentales d'extraction de matières premières naturelles sont : -la volatilité (évaporation, distillation, …. . ), -la solubilité (extraction), -les dimensions et les formes des particules, -l'adsorption. La figure suivante donne les principales opérations industrielles d'extraction.


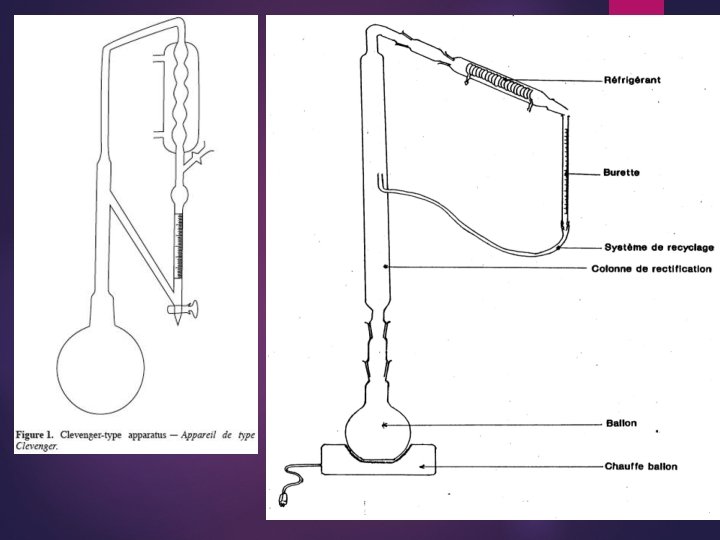
2. Entraînement à la vapeur : distillation 1. Extraction des huiles essentielles : mecanismes physicochimiques mis en jeu Les HE sont des produits aromatiques d'origine végétale. On les retrouve dans les glandes à huiles, dans les veines, dans les sacs d'huile ou dans les cellules glandulaires des plantes aromatiques. Quand la plante est laissée intacte, les huiles ne peuvent être entraînées par la vapeur qui après passage de l'intérieur des tissus à la surface du matériel végétal, c'est la diffusion. La diffusion est un processus relativement long. Les composés volatils constitutifs de l'HE sont retenus par la fraction lipidique, ce qui ralentit leur entraînement par la vapeur d'eau. C'est cette étape qui détermine la durée de la distillation. Il est par ailleurs connu qui au cours de l'hydrodistillation, la vitesse de vaporisation des huiles volatils est également influencée par le degré de solubilité de ces constituants volatils dans l'eau. Durant la distillation à la vapeur d'eau, l'eau chaude pénètre dans les tissus végétaux et dissout les parties d'HE présentes dans les cellules. Cette solution aqueuse diffuse à travers les parois cellulaires. Quand ces composés dissous dans l'eau chaude se trouvent à la surface, ils s'évaporent. Le mélange vapeur d'eau / HE passe ensuite à travers un condenseur où il se refroidit pour donner 2 couches séparées d'huile et d'eau au niveau du récupérateur appelé:

4. 2. 2. Les techniques d’extraction La distillation : principe de base Le principe de base se résumé comme suit : -une source de production de vapeur d'eau, -alambic pour le traitement du matériel végétal, -un serpentin refroidissement plongé dans l'eau froide. -un essencier ou est récupérée l'essence (HE) produite. Le système fonctionne de la manière suivante : la vapeur produite par le générateur de vapeur traverse la charge du matériel végétal, se charge des HE contenues dans la plante, avant de quitter l'alambic par la conduite menant vers le système de refroidissement où la vapeur d'eau chargée d'HE est condensée. La phase liquide arrive dans l'essencier où l'huile essentielle se sépare de l'eau et décante à la surface de l'eau.

On distingue généralement 3 techniques de base pour l'extraction des HE. Elles diffèrent essentiellement par le degré de contact entre le matériel végétal et l'eau : ces techniques : -l'hydrodistillation -la vapo-hydrodistillation -la distillation à la vapeur directe produite séparément. Hydrodistillation Dans cette méthode, le matériel végétal à distiller est immergé dans l'eau bouillante. On réalise le chauffage de l'alambic soit directement (alambic à feu nu), soit indirectement par l'envoi dans cette dernière d'une vapeur surchauffée produite séparément (Figure…. ). Vapo-hydrodistillation Dans cette technique, le matériel végétal est supporté par un grillage situé à une distance adéquate au dessus du fond de l'alambic. La partie inférieure de l'alambic est remplie d'eau chauffée jusqu'à ébullition afin de produire une vapeur saturée (Figure…. ). Distillation à la vapeur directe produite séparément La vapeur dřeau saturée ou surchauffée introduite dans l'alambic, généralement par le fond et traverse directement le végétal (Figure…. ).



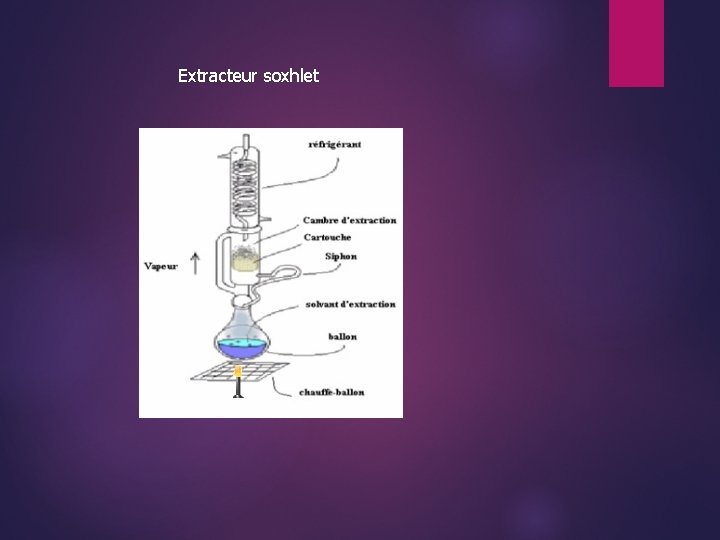
Extracteur soxhlet

3. Extraction par solvant Les matières végétales plus utilisées renferment souvent à côté dřune très faible quantité de composants aromatiques, des substances solides ou liquides quřil faut séparer. Ces substances ne peuvent être récupérées par EV à cause du rendement nul ou très faible. Pour séparer ces aromatiques, deux types dřextraction sont utilisées : Lřextraction solide/liquide : opération de transfert ou dřéchange de matière entre une phase solide (la matière à extraire) et une phase liquide (le solvant dřextraction). Lřextraction liquide/liquide : opération de transfert ou dřéchange de matière entre deux phases liquides, la solution et le solvant. 1. Extraction solide/liquide Elle est réalisable de plusieurs manières : par simple contact, par contacts multiples, à co-courants parallèles par contacts multiples à contre-courants. Lřextraction moyennant des solvants liquides volatils a été développée à la fin du 19 siècle à Grasse en particulier. Selon que le solvant présent dans le miscella dřextraction est conservé ou éliminé, on prépare : Les teintures, infusions (ex. vanille) obtenues par macération, percolation au moyen dřéthanol. des concrètes, résinoïdes, oléorésines, …… en chassant le solvant. Les solvants les plus utilisés sont lřhexane, lřéthanol, lřacétone, les polychrométhanes et éthanes. 2. Extraction liquide/liquide Lřopération fondamentale consiste à extraire un ou plusieurs constituants dřune solution par dissolution au contact dřun solvant liquide dans lequel les corps sont plus solubles que dans le milieu liquide initial, puis à séparer par décantation. Lřopération est terminée par élimination du solvant dřextraction en vue dřisoler le ou les constituants recherchés.

4. 3. 3. Extraction par le CO 2 Principe L'état supercritique correspond à un domaine de pression et de température bien défini à l'intérieur duquel le fluide considéré ne peut être liquéfié. La pression et la température minimale au delà desquelles nous entrons dans ce domaine définissent le produit critique. Pour le CO 2 : PC = 73, 8 bars et TC = 31, 0°C La solubilité des matières premières naturelles dans le CO 2 est liée à son état. Par exemple, la solubilité d'un composé est pratiquement nulle à l'état gazeux, seulement de quelques g/l à l'état liquide et devient importante à l'état supercritique. Cette propriété est utilisée pour réaliser l'extraction dans le domaine supercritique. Ainsi le CO 2 est refroidi et comprimé à une P < à PC il passe à l'état liquide. Il est ensuite comprimé puis chauffé à une pression et température données. Le fluide à l'état supercritique traverse alors la cuve d'extraction où se trouve le matériel végétal. Le CO 2 supercritique chargé en soluté est ensuite détendu au dessous de la pression critique avant d'autres dans le séparateur et passer à l'état gazeux. Il perd ainsi ses propriétés de solvant et permet aux solutés de précipiter et d'être récupérées. Le CO 2 est ensuite recyclé pour une nouvelle extraction (Figure ).

Extraction par enfleurage Ce procédé utilisé à Grasse, en particulier pour le jasmin, la tubéreuse, avant le développement de l'extraction par solvants. Il s'agit de placer les fleurs sur un corps gras purifié et de laisser les arômes pénétrer le corps gras. Une fois l'arôme des fleurs pompé, on les retire et on remet des fleurs fraîches, jusqu'à saturation du corps gras. La pommade ainsi obtenue, la suffit de la nettoyer, puis d'y ajouter de l'alcool. Au bout de 24 heures, le corps gras et les huiles essentielles sont séparés. Il ne reste plus qu'à recueillir la précieuse huile essentielle ! Pour la rose, la fleur d'oranger, l'acacia, le mimosa, l'enfleurage à froid étant insuffisant, on procédait à une immersion dans de la graisse chauffée à 80°.

Analyse des extraits aromatiques 5. 1. Indices physico-chimiques Au début, pour caractériser les HE, on détermine les indices suivants : la densité indice de réfraction déviation polarimétrique solubilité dans l'éthanol (pour voir si le produit peut être ajouté dans les parfums) indice d'acide indice de peroxyde indice d'esters indice de phénols. 5. 2 Chromatographie préparatoire Après ces indices, on a inventé la chromatographie micropréparative qui permet de séparer certains composés qui existent en quantité appréciable dans le mélange à analyser. On essaie alors de piéger le composé à la sortie du détecteur (qui est non destructeur). Le composé ainsi piégé est identifié par IR ou RMN. Cette chromatographie ne permet pas d'obtenir une bonne séparation du mélange d'où la nécessité d'utiliser la chromatographie analytique.

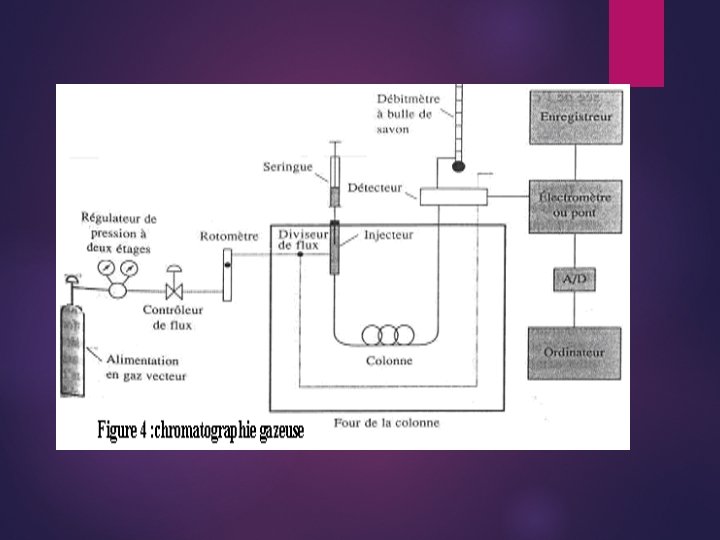
Chromatographie analytique CPG Principe La CPG est devenue la méthode de choix pour la séparation d'un mélange complexe de produits volatils. Le chromatographe est constitué de : un injecteur pour l'injection de l'échantillon. une colonne contenant la phase stationnaire. Un détecteur qui permet de détecter les composés séparés. Le principe de cette méthode est la partition ou distribution des solutions entre une phase stationnaire (liquide ou solide) et une phase mobile gazeuse. Durant leur passage à travers la colonne, les molécules du mélange sont séparées. La séparation dépend des interactions sélectives entre les solutés et la phase liquide stationnaire. C'est la polarité de chaque partenaire qui en décide. A la sortie du détecteur, les pics sont enregistrés à l'aide d'un intégrateur qui donne un chromatogramme.


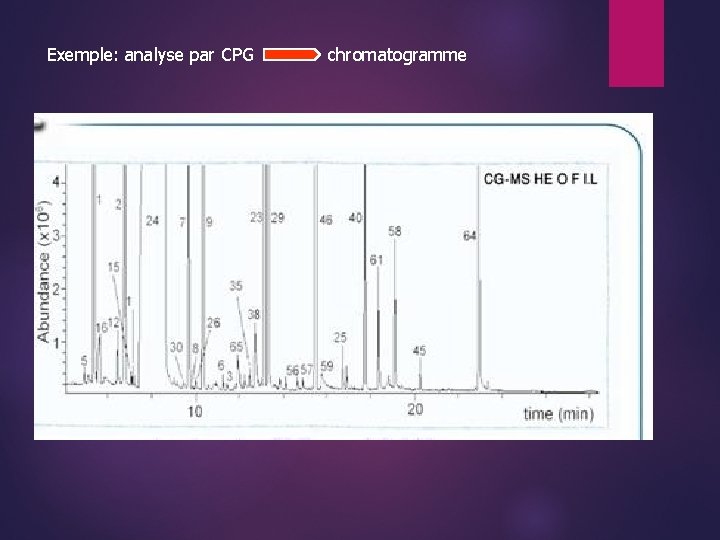
Exemple: analyse par CPG chromatogramme


102