Les liaisons intermolculaires Les liaisons intermolculaires dans les

















- Slides: 30

Les liaisons intermoléculaires

Les liaisons intermoléculaires dans les corps covalents Les liaisons dipôle-dipôle • Lorsque la différence d’électronégativité entre deux atomes d’une liaison est plus grande que 0, 4, la liaison est dite polaire. • Si une molécule ne possède qu’une seule liaison polarisée, ou si elle en possède plusieurs dont l’effet cumulé n’est pas nul, la molécule est dite polaire et forme un dipôle. • Deux dipôles différents s’attirent. 2 d- + d+ d+ O H H 104 °

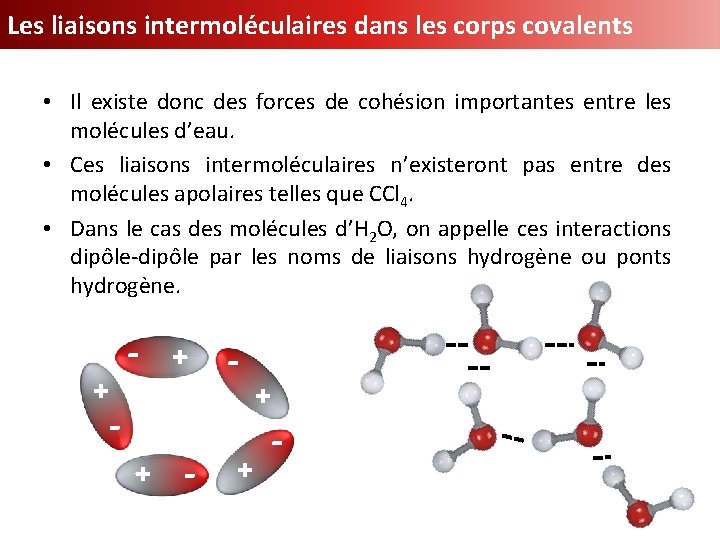
Les liaisons intermoléculaires dans les corps covalents + - - + • Il existe donc des forces de cohésion importantes entre les molécules d’eau. • Ces liaisons intermoléculaires n’existeront pas entre des molécules apolaires telles que CCl 4. • Dans le cas des molécules d’H 2 O, on appelle ces interactions dipôle-dipôle par les noms de liaisons hydrogène ou ponts hydrogène. + + - +

Les liaisons intermoléculaires dans les corps covalents Démonstration 1 : • A l’intérieur d’un liquide constitué de molécules polaires, comme l’eau par exemple, toutes les molécules sont attirées dans toutes les directions par leurs voisines, et ces attractions se compensent. Les molécules de la surface, par contre, ne sont attirées que par les molécules situées à côté et en dessous d’elles. Il en résulte des forces d’attractions dirigées vers l’intérieur du liquide, la surface ayant alors une certaine résistance envers l’extérieur. Cette force de résistance est appelée tension superficielle.

Les liaisons intermoléculaires dans les corps covalents Démonstration 2 : • Tous les liquides n’ont pas la même tension superficielle. • L’ajout de liquide vaisselle réduit la tension superficielle de l’eau en répartissant ses molécules à la surface de celle-ci. Un produit qui comme le liquide vaisselle abaisse la tension superficielle de l’eau ou de tout autre liquide est appelé un agent tensioactif ou un surfactant. • Les principaux agents tensioactifs sont les détergents.

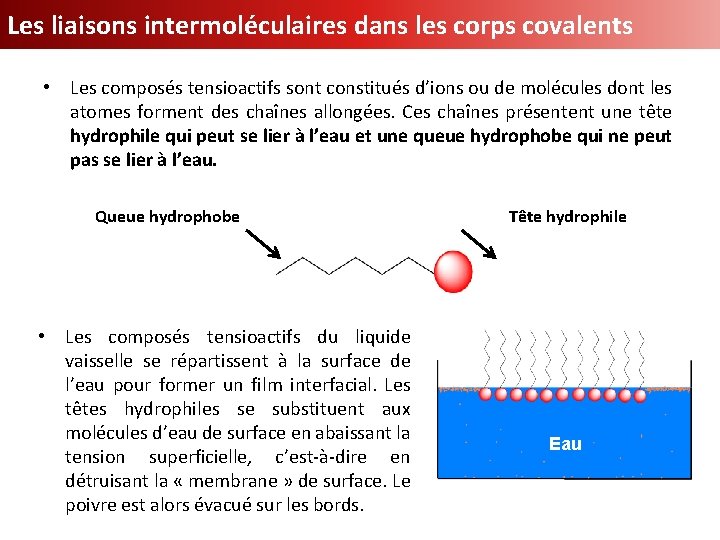
Les liaisons intermoléculaires dans les corps covalents • Les composés tensioactifs sont constitués d’ions ou de molécules dont les atomes forment des chaînes allongées. Ces chaînes présentent une tête hydrophile qui peut se lier à l’eau et une queue hydrophobe qui ne peut pas se lier à l’eau. Queue hydrophobe • Les composés tensioactifs du liquide vaisselle se répartissent à la surface de l’eau pour former un film interfacial. Les têtes hydrophiles se substituent aux molécules d’eau de surface en abaissant la tension superficielle, c’est-à-dire en détruisant la « membrane » de surface. Le poivre est alors évacué sur les bords. Tête hydrophile Eau

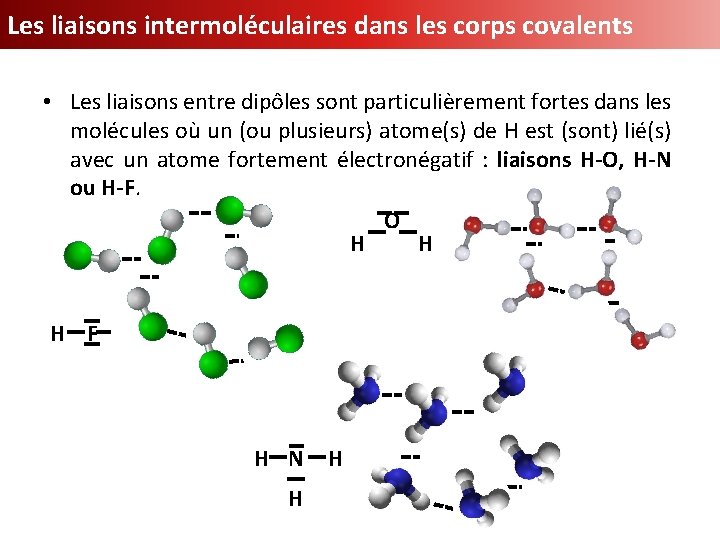
Les liaisons intermoléculaires dans les corps covalents • Les liaisons entre dipôles sont particulièrement fortes dans les molécules où un (ou plusieurs) atome(s) de H est (sont) lié(s) avec un atome fortement électronégatif : liaisons H-O, H-N ou H-F. O H H H F H N H H

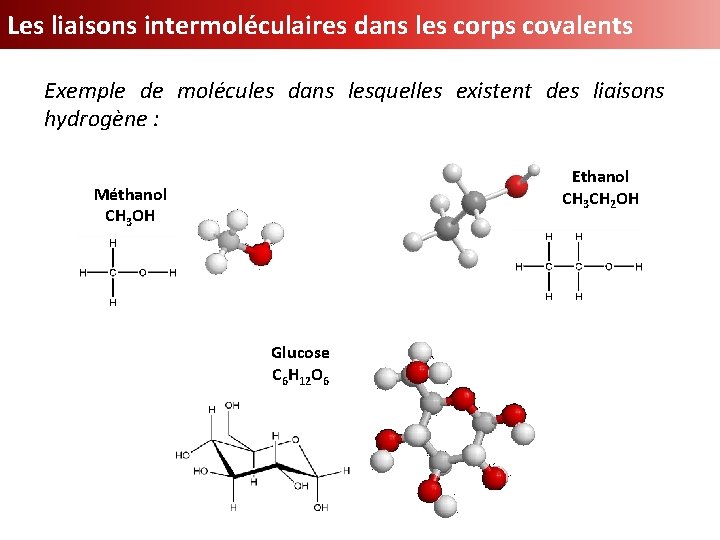
Les liaisons intermoléculaires dans les corps covalents Exemple de molécules dans lesquelles existent des liaisons hydrogène : Ethanol CH 3 CH 2 OH Méthanol CH 3 OH Glucose C 6 H 12 O 6

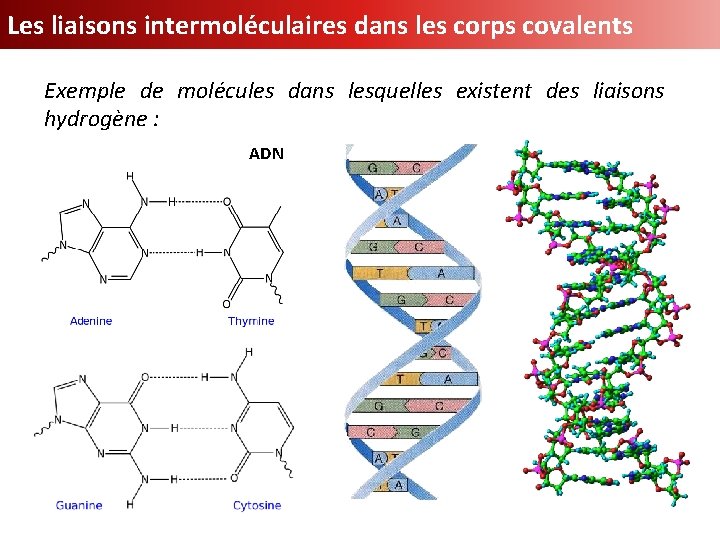
Les liaisons intermoléculaires dans les corps covalents Exemple de molécules dans lesquelles existent des liaisons hydrogène : ADN

Les liaisons intermoléculaires dans les corps covalents Démonstration 3 : • Le polyacrylate de sodium est un polymère capable de former un très grand nombre de liaisons hydrogène, il est ainsi capable d’absorber au moins 100 fois sa prpopre masse en eau. • Il est utilisé comme superabsorbant, notamment dans les couches-culottes. Liaisons hydrogène avec les molécules d’eau http: //scienceamusante. net/wiki/index. php? title=Polyacrylate_de_sodium_superabsorbant

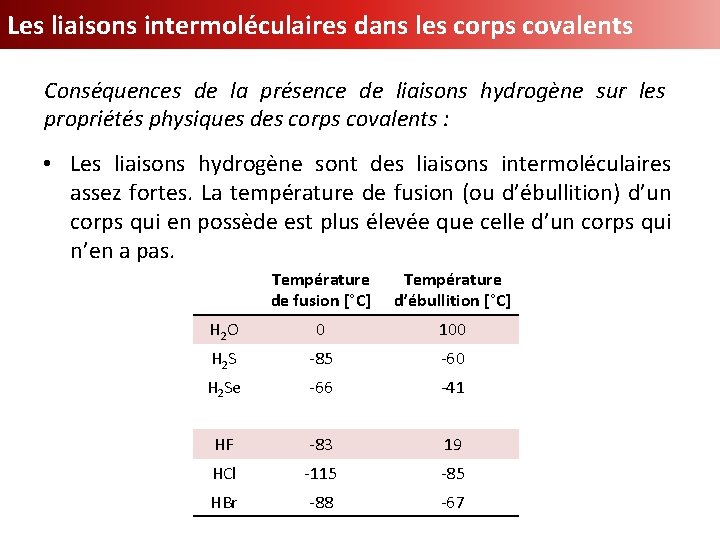
Les liaisons intermoléculaires dans les corps covalents Conséquences de la présence de liaisons hydrogène sur les propriétés physiques des corps covalents : • Les liaisons hydrogène sont des liaisons intermoléculaires assez fortes. La température de fusion (ou d’ébullition) d’un corps qui en possède est plus élevée que celle d’un corps qui n’en a pas. Température de fusion [°C] Température d’ébullition [°C] H 2 O 0 100 H 2 S -85 -60 H 2 Se -66 -41 HF -83 19 HCl -115 -85 HBr -88 -67

Les liaisons intermoléculaires dans les corps covalents Conséquences de la présence de liaisons hydrogène sur les propriétés physiques des corps covalents : • Plus il y a de liaisons hydrogène entre les molécules d’un corps covalent, plus sa température de fusion (ou d’ébullition) est élevée. Température Ethanol CH 3 CH 2 OH Ethanediol (Ethylène glycol) HOCH 2 OH de fusion [°C] d’ébullition [°C] -117 79 -13 197

Les liaisons intermoléculaires dans les corps covalents Exercice : • Classer les corps covalents qui suivent selon leurs températures d’ébullition croissantes : a) b) c) d) e) f) g) CH 2 OH-CH 2 OH H 2 O CH 3 -CH 2 OH H 2 S CH 2 OH-CH 3 CO 2 Ne Réponse : • 1 -g (-246°C) / 2 -d (-60°C) / 3 -f (-57°C) / 4 -b (100°C) / 5 -e (188°C) / 6 -c (197°C) / 7 -a (290°C)

Relations entre la force des liaisons intermoléculaires et les propriétés physiques • Toutes les propriétés physiques d’une substance sont très influencées par la nature des liaisons intermoléculaires : § Température de fusion § Température d’ébullition § Solubilité § Etc…

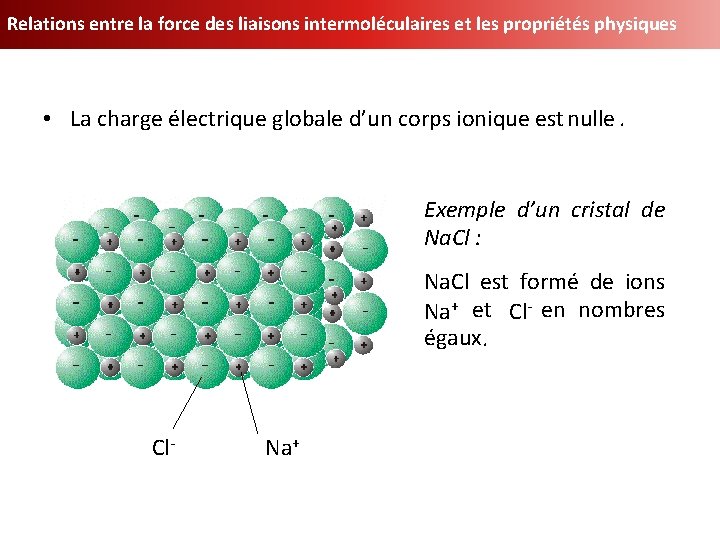
Relations entre la force des liaisons intermoléculaires et les propriétés physiques 1) Les corps ioniques • Les corps ioniques sont formés de cations+ (+) et d’anions - (-) qui s’attirent mutuellement grâce à de grandes forces s’attirent électriques. http: //thepoussin. free. fr/TPE 2003/Lexique. htm

Relations entre la force des liaisons intermoléculaires et les propriétés physiques • La charge électrique globale d’un corps ionique est nulle. Exemple d’un cristal de Na. Cl : Na. Cl est formé de ions Na+ et Cl Cl-- en nombres égaux. Cl- Na+

Relations entre la force des liaisons intermoléculaires et les propriétés physiques • Les forces de cohésion entre les ions sont si fortes que solides à pratiquement tous les corps ioniques sont solides température ambiante (25°C). Vue d’un cristal de Na. Cl en coupe : Cl- Na+

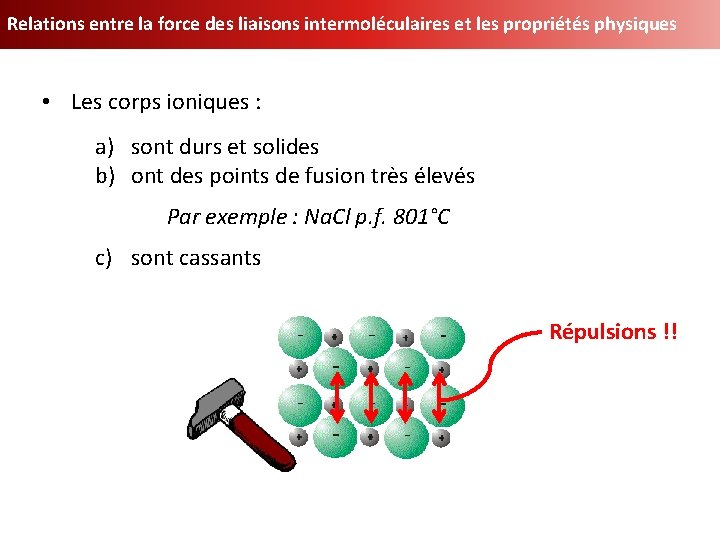
Relations entre la force des liaisons intermoléculaires et les propriétés physiques • Les corps ioniques : a) sont durs et solides b) ont des points de fusion très élevés Par exemple : Na. Cl p. f. 801°C c) sont cassants Répulsions !!

Relations entre la force des liaisons intermoléculaires et les propriétés physiques Solubilité des corps ioniques : • Les ions d’un cristal ionique immergé dans un liquide (polaire ou non polaire) subissent de la part des molécules du liquide des chocs dû à l’agitation moléculaire. • A température ambiante, ces chocs arrivent difficilement à arracher des ions au réseau cristallin de Na. Cl. • Par contre, si le liquide est polaire, les molécules du liquide présentent un dipôle.

Relations entre la force des liaisons intermoléculaires et les propriétés physiques Solubilité des corps ioniques : • L’énergie due à l’attraction de l’ion avec le dipôle s’ajoute à celle communiquée lors du choc : il y a alors assez d’énergie pour que l’ion puisse quitter le réseau cristallin du solide ionique. Le solide se dissout. +

Relations entre la force des liaisons intermoléculaires et les propriétés physiques Solvatation des ions : • Dans les solvants polaires, la dissolution des corps ioniques peut s’expliquer par la solvatation qui accompagne la rupture des liaisons ioniques entre les ions de charges opposées. Qu’est-ce que la solvatation ? • Lorsqu’un ion a été arraché à son réseau cristallin par un solvant polaire, il s’entourera d’un certain nombre de molécules de solvant. ü Le nombre de molécules de solvant entourant chaque ion dépendra des tailles relatives de l’ion et des molécules de solvant. ü Les dipôles des molécules de solvant s’orienteront différemment suivant la charge de l’ion central.

Relations entre la force des liaisons intermoléculaires et les propriétés physiques Exemple : • Na. Cl dans l’eau forme les ions Na+ et Cl-, qui seront orientés ainsi : +

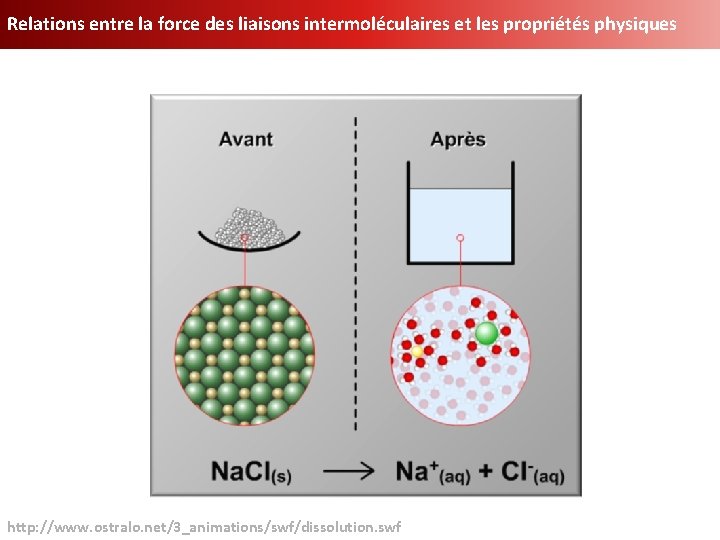
Relations entre la force des liaisons intermoléculaires et les propriétés physiques http: //www. ostralo. net/3_animations/swf/dissolution. swf

Relations entre la force des liaisons intermoléculaires et les propriétés physiques En résumé : • « Qui se ressemble s’assemble » est aussi valable en chimie ! Ainsi, on peut dire que les corps ioniques sont : ü généralement solubles dans les solvants polaires (eau, alcool, ammoniac liquide, etc. ). ü généralement peu ou pas solubles dans les solvants non polaires (CCl 4, CS 2, alcanes, etc. ). ü conduisent le courant électrique. Ce sont les ions (qui sont mobiles dans un liquide) qui conduiront le courant.

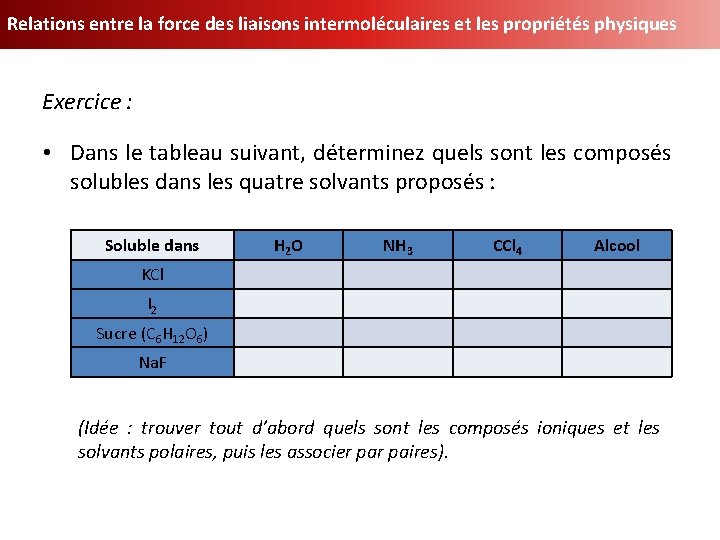
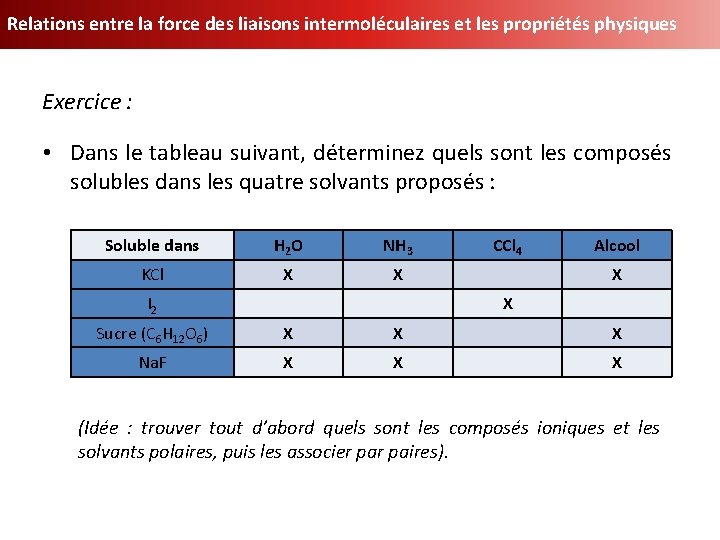
Relations entre la force des liaisons intermoléculaires et les propriétés physiques Exercice : • Dans le tableau suivant, déterminez quels sont les composés solubles dans les quatre solvants proposés : Soluble dans H 2 O NH 3 CCl 4 Alcool KCl I 2 Sucre (C 6 H 12 O 6) Na. F (Idée : trouver tout d’abord quels sont les composés ioniques et les solvants polaires, puis les associer paires).

Relations entre la force des liaisons intermoléculaires et les propriétés physiques Exercice : • Dans le tableau suivant, déterminez quels sont les composés solubles dans les quatre solvants proposés : Soluble dans H 2 O NH 3 KCl X X I 2 CCl 4 Alcool X X Sucre (C 6 H 12 O 6) X X X Na. F X X X (Idée : trouver tout d’abord quels sont les composés ioniques et les solvants polaires, puis les associer paires).

Relations entre la force des liaisons intermoléculaires et les propriétés physiques 2) Les corps covalents a) Les corps covalents formés de molécules non-polaires • Seules de très faibles forces (appelées forces de Van der Waals) interviennent comme forces intermoléculaires et lient les molécules ensemble. • Ces composés sont généralement gazeux lorsque la masse des molécules est petite, comme c’est le cas pour Br 2, Cl 2, H 2, O 2, CH 4 ou O 2, par exemple. • Ces composés sont liquides, voire même solides lorsque la masse des molécules est grande, c’est le cas par exemple des liquides CCl 4 et CS 2 ou du solide I 2.

Relations entre la force des liaisons intermoléculaires et les propriétés physiques 2) Les corps covalents b) Les corps covalents formés de molécules polaires • Dans ces composés, les importantes forces d’attraction entre les dipôles s’ajouteront aux forces de Van der Waals. d+ d- d- d+ d+ d+ d- Interactions entre deux dipôles d+ d- d- d+ ddd+ Exemple de composé covalent solide d-

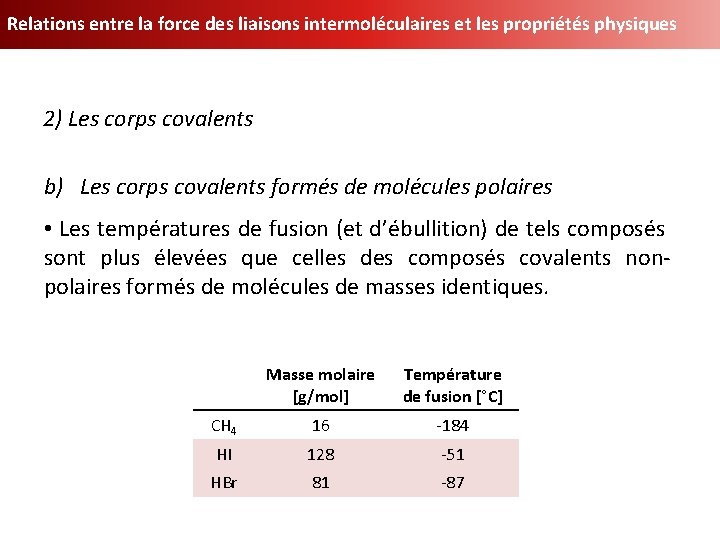
Relations entre la force des liaisons intermoléculaires et les propriétés physiques 2) Les corps covalents b) Les corps covalents formés de molécules polaires • Les températures de fusion (et d’ébullition) de tels composés sont plus élevées que celles des composés covalents nonpolaires formés de molécules de masses identiques. Masse molaire [g/mol] Température de fusion [°C] CH 4 16 -184 HI 128 -51 HBr 81 -87

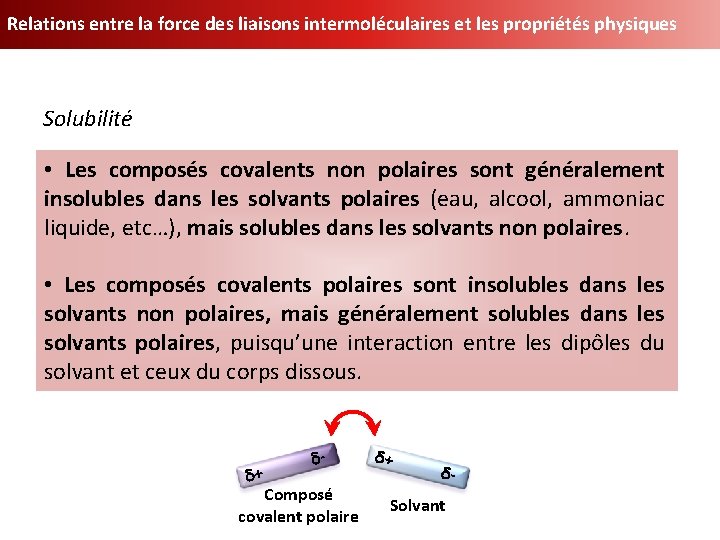
Relations entre la force des liaisons intermoléculaires et les propriétés physiques Solubilité • Les composés covalents non polaires sont généralement insolubles dans les solvants polaires (eau, alcool, ammoniac liquide, etc…), mais solubles dans les solvants non polaires. • Les composés covalents polaires sont insolubles dans les solvants non polaires, mais généralement solubles dans les solvants polaires, puisqu’une interaction entre les dipôles du solvant et ceux du corps dissous. d+ d- Composé covalent polaire d+ d- Solvant
 Liaison pivot
Liaison pivot Quand je suis frais je suis chaud qui suis-je
Quand je suis frais je suis chaud qui suis-je Extrait 2 de la ficelle
Extrait 2 de la ficelle Liaison interdites
Liaison interdites Macrocible d'entrée exemple
Macrocible d'entrée exemple Les professeurs 1 of 1 dans la salle de classe.
Les professeurs 1 of 1 dans la salle de classe. Les types d'allées dans un magasin
Les types d'allées dans un magasin Les fonctions dans le groupe verbal
Les fonctions dans le groupe verbal Analyse du chapitre 49 le dernier jour d'un condamné
Analyse du chapitre 49 le dernier jour d'un condamné Plan des enfers
Plan des enfers Remerciement maitre de stage
Remerciement maitre de stage Texte dopinion
Texte dopinion Le guide de la parfaite femme au foyer dans les années 50
Le guide de la parfaite femme au foyer dans les années 50 Marque allemande de bonbon
Marque allemande de bonbon Quel beau nom paroles
Quel beau nom paroles Les instructions dans la classe
Les instructions dans la classe Structure de conte
Structure de conte Dans le ciel d abraham
Dans le ciel d abraham échange des substances dissoutes
échange des substances dissoutes Caspar david friedrich l'abbaye dans une forêt de chênes
Caspar david friedrich l'abbaye dans une forêt de chênes Broche trans osseuse
Broche trans osseuse Portrait moral
Portrait moral Donne la paix à ton frère
Donne la paix à ton frère Il y a des moments dans la vie
Il y a des moments dans la vie Tu habites dans quel pays
Tu habites dans quel pays Pnjf
Pnjf Le geai gélatineux geignait dans le jasmin
Le geai gélatineux geignait dans le jasmin Chapitre 2 richesse et pauvreté dans le monde
Chapitre 2 richesse et pauvreté dans le monde Comment mettre une girafe dans un frigo
Comment mettre une girafe dans un frigo Pronom objet direct et indirect übungen
Pronom objet direct et indirect übungen J'ai 6 clés sans serrures si tu me grattes je murmure
J'ai 6 clés sans serrures si tu me grattes je murmure