Les gaz en plonge et leurs effets selon












- Slides: 16

Les gaz en plongée et leurs effets selon la pression (Azote, Oxygène, CO 2) Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Plan du cours • Rappel sur les notions de pression • Rappel sur la Loi de mariotte • Les mélanges gazeux – – Composition de l’air Loi de Dalton Notion de pression partielle Exercice d’application – – – Toxicité des gaz Intoxication à l’Oxygène Intoxication au CO 2 Intoxication au CO Intoxication à l’Azote : La Narcose • Applications à la plongée: accidents biochimiques Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

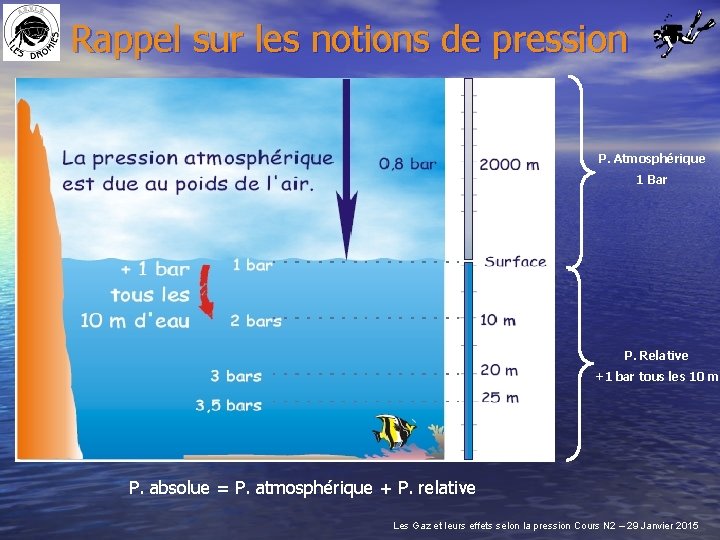
Rappel sur les notions de pression P. Atmosphérique 1 Bar P. Relative +1 bar tous les 10 m P. absolue = P. atmosphérique + P. relative Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Rappel sur la Loi de Mariotte (1/2) • Définition – Pour un volume fermé, le produit de la pression (P) par le volume (V) est constant donc le volume d’un gaz est inversement proportionnel à la pression qu’il reçoit. P*V = Constante ou P 1*V 1 = P 2*V 2 donc P 1 = P 2*V 2/V 1 • A la descente, la profondeur augmente, donc P => l’air est • => l’air se détend comprimé et le volume des gaz diminue donc V A la remontée, la profondeur diminue, donc P et le volume des gaz augmente donc V Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Rappel sur la Loi de Mariotte (2/2) • Expérience Les variations de volume sont plus importantes près de la surface : le volume de gaz double entre 10 m et la surface. C’est la raison pour laquelle les barotraumatismes sont plus nombreux et plus grave dans cette zone. Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

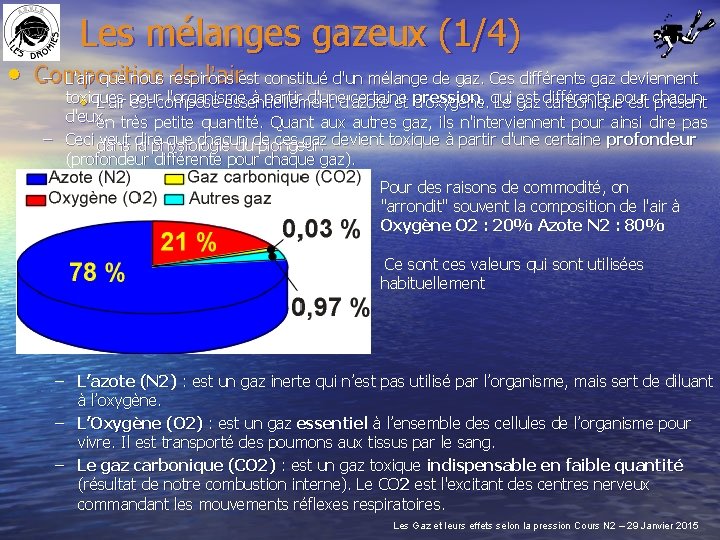
Les mélanges gazeux (1/4) • Composition de l’airest constitué d'un mélange de gaz. Ces différents gaz deviennent – L'air que nous respirons toxiques l'organisme à partir d'uned'azote certaine , qui est différente • L'air pour est composé essentiellement et pression d'oxygène. Le gaz carboniquepour est chacun présent d'eux. en très petite quantité. Quant aux autres gaz, ils n'interviennent pour ainsi dire pas – Ceci dans veut dire que chacun ces gaz devient toxique à partir d'une certaine profondeur la physiologie dude plongeur. (profondeur différente pour chaque gaz). Pour des raisons de commodité, on "arrondit" souvent la composition de l'air à Oxygène O 2 : 20% Azote N 2 : 80% Ce sont ces valeurs qui sont utilisées habituellement – L’azote (N 2) : est un gaz inerte qui n’est pas utilisé par l’organisme, mais sert de diluant à l’oxygène. – L’Oxygène (O 2) : est un gaz essentiel à l’ensemble des cellules de l’organisme pour vivre. Il est transporté des poumons aux tissus par le sang. – Le gaz carbonique (CO 2) : est un gaz toxique indispensable en faible quantité (résultat de notre combustion interne). Le CO 2 est l'excitant des centres nerveux commandant les mouvements réflexes respiratoires. Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Les mélanges gazeux (2/4) • Loi de Dalton & notion de pression partielle • La pression absolue d’un mélange gazeux est la somme des pressions partielles des gaz qui composent ce mélange • La pression partielle d'un gaz dans un mélange est égale à la Pression absolue du mélange multiplié par la concentration (ou le pourcentage) du gaz dans le mélange. ÞPression Partielle Gaz = Pression Absolue du Mélange * % Gaz • La somme des pressions partielles est donc égale à la pression absolue du mélange. P. P est la Pression Partielle. A la pression atmosphérique : Pp. N 2 = 0, 8 bars et Pp. O 2 = 0, 2 bars (on a bien 0, 8+0, 2 = 1). Avec la profondeur, les Pp augmentent. Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Les mélanges gazeux (3/4) • Exercice d’application • Un plongeur respire à 20 m de l’air comprimé. Son détendeur lui délivre de l’air à la pression ambiante. A 20 m la pression absolue est de 3 bars, donc l’air qu’il respire est à la même pression (c’est le boulot du détendeur !!!). – Quelles sont les pressions partielles d’Oxygène et d’Azote à cette profondeur ? • Si l’oxygène était seul, il occuperait toute la place et il aurait une pression de 3 bars. , mais, comme il n’occupe que 20% du volume total, sa pression est de 20/100 de la pression du mélange. – Cette pression que l’on appelle pression partielle est donc de 20% * 3 bars = 0, 6 bars • De même si l’azote était seul, il occuperait toute la place et aurait donc une pression de 3 bars. Mais, comme il n’occupe que 80% du volume total. • • • – Sa pression partielle est de 80% * 3 bars = 2, 4 bars Pression partielle Oxygène Pression partielle Azote Pression Air ou Pression Absolue – 20% * 3 bars = 0, 6 bar 80% * 3 bars = 2, 4 bar 0, 6 bar (O 2) + 2, 4 bar (N 2) = 3 bars La pression absolue d’un mélange gazeux est la somme des pressions partielles des gaz qui composent ce Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015 mélange.

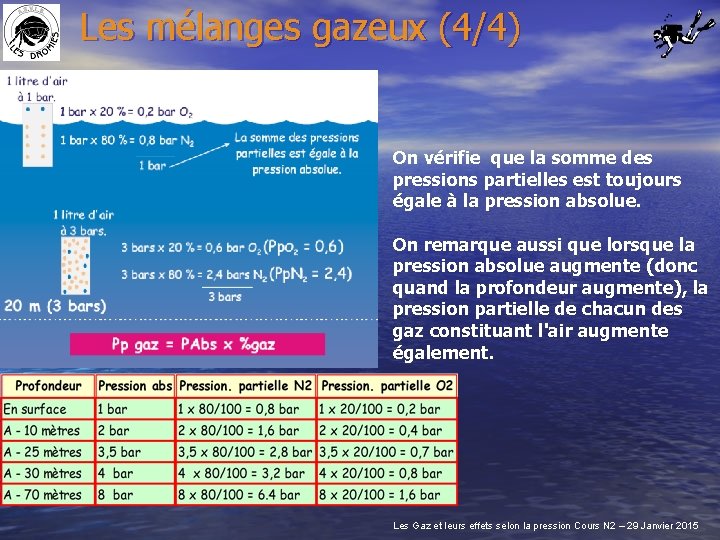
Les mélanges gazeux (4/4) On vérifie que la somme des pressions partielles est toujours égale à la pression absolue. On remarque aussi que lorsque la pression absolue augmente (donc quand la profondeur augmente), la pression partielle de chacun des gaz constituant l'air augmente également. Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Applications à la plongée (1/7) • Toxicité des gaz • L'air que nous respirons est donc constitué d'un mélange de gaz. Un gaz parfaitement toléré à la pression atmosphérique, peut devenir toxique pour l'organisme à partir d'une certaine pression partielle plus élevée et d'une certaine durée d'utilisation. • La tolérance de l'organisme à divers gaz varie selon la nature des gaz et la pression auxquelles ils sont respirés Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Applications à la plongée (2/7) • Intoxication à l’Oxygène Le fonctionnement normal de l'organisme correspond à une pression Partielle d’O 2 de 0, 20 bar. • Hyperoxie: L'O 2 est toxique pour une pression partielle supérieure à 1, 6 bar, ce qui correspond à une profondeur de 70 mètres. Or, faut-il le rappeler, la plongée en Symptômes: France estvision limitée à 60 réduction mètres (voir Face rose, trouble, du champ l’arrêté du 22 juin 1998 réglementant visuel, crampes, contractions musculaires, la plongée subaquatique autonome à crise épileptique, perte de connaissance. l'air). Conduite à tenir : L’hyperoxie d’autant plus d’O 2. Il faut baisser est la Pression Partielle improbable pour les plongeurs de niveau 2 qu’ils Prévention : ne doivent en aucun cas descendre à plus 40 mètres: de Ne pas dépasser sesde prérogatives plongée profondeur (accompagné d’un maximum 40 m (accompagné d’un plongeur Niveau 4 minimum). Au-delà de 1, 6 bar, l’oxygène est toxique pour le système nerveux. Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Applications à la plongée (3/7) • Hypoxie et anoxie: On parle d'hypoxie pour une pression partielle d'O 2 inférieure à 0, 15 bar et d'anoxie pour un P. P inférieure à 0, 12 bar. Pour la plongée loisir, les risques d’anoxie sont possibles en cas : – Apnée précédée d’une hyperventilation : fortement déconseillé car risque de syncope puis de noyade – Noyade, qui se traduit par un arrêt d’apport en oxygène et peut être assimilée à une anoxie. Conduite à tenir : Suivant la gravité, mise sous oxygène, massage cardiaque et appel des secours obligatoire (assuré par le directeur de plongée ou autre secouriste). Prévention : Une bonne condition physique Ne pas s’immerger en cas d’essoufflement en surface En mer on a soit le détendeur soit le tuba en bouche surtout en cas de mer agitée Quand on remonte sur le bateau, on garde le détendeur en bouche Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Applications à la plongée (4/7) • Intoxication au dioxyde de Carbone (CO 2) Le gaz carbonique (CO 2) : est un gaz toxique indispensable en faible quantité (résultat de notre combustion interne). Le CO 2 est l'excitant des centres nerveux commandant les mouvements réflexes respiratoires. – Cause: Lorsque la Pression partielle de CO 2 dépasse 0, 02 bar, il y a • Un effort!!! excessif : nage à contre courant, sur lestage, palmage trop intensif… essoufflement • Détendeur défectueux , robinet mal ouvert Prévention : Symptômes : • Apprendre à contrôler son Essoufflement rythme respiratoire (Inspiration - tempscardiaque, d'arrêt (accélération du rythme expiration - temps d'arrêt). ventilation superficielle), maux de tête, sueurs, nausées, • Ne pas faire d'efforts inconsidérés au-delà de 10 m, aller à l'économie). angoisse(surtout Syncope • Se protéger du froid, avoir. Conduite un détendeur bien: réglé, être en forme. à tenir • Ne pas descendre si on est. Cesser déjà essoufflé. toute activité, signe "je suis essoufflé(e)", respirer lentement en expirant profondément pour augmenter L'essoufflement est un des principauxde dangers qui guettent le plongeur. l'élimination CO 2 et éviter la surpression pulmonaire, Un début d’essoufflement provoque une respiration difficile, haletante, souvent calmer, remonter, respirer O 2 normobare. accompagné de maux de tête. Avertir son binôme ou la palanquée par le signe usuel. L'affolement et la panique peuvent survenir et entraîner une syncope avec sa conséquence fatale: la noyade. L’essoufflement arrive d’autant plus facilement que la profondeur est Il peut être prévenu par des mesures simples et efficaces importante. . . Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Applications à la plongée (5/7) • Intoxication au monoxyde de Carbone (CO) Due au mauvais gonflage, compresseur défectueux, air inspiré vicié, provenant de l'échappement d'un moteur thermique (mauvaise combustion). • Symptômes : – Maux de tête, sueurs, nausées, changement de couleur de la face Syncope • Conduite à tenir : – Le CO se fixe sur les molécules d’hémoglobines du sang qui servent normalement au transport de l’oxygène, rendant impossible l’apport en O 2 aux organes. Cette situation est irréversible sans acte médical, contrairement à l’intoxication au C 02. – Remonter et prévenir les secours pour évacuation sur un centre hyperbare O 2 (caisson). • Prévention : – Pureté de l’air contenu dans la bouteille. Ne pas gonfler à proximité d’un moteur thermique en marche. Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Applications à la plongée (6/7) • Intoxication à l’Azote: La Narcose Ce gaz neutre, diluant, n'est pas dangereux à des faibles pressions. – L'installation de la narcose peut être progressive ou brutale, perçue ou non par le plongeur. – Malgré des points communs, toutes les expériences de narcoses sont différentes. – Le seuil déclenchant la narcose est très variable. Les risques débutent vers 30 m (y compris chez le plongeur expérimenté en cas d'effort violent). Danger Au-delà de 40 m – L'habitude et le contrôle individuel diminuent les symptômes chez le plongeur expérimenté. Au-delà de 60 m tous les plongeurs sont narcosés. Ce phénomène proviendrait de la fixation d’azote sur les cellules nerveuses du cerveau. Lorsque la Pression partielle de l’azote dépasse 3, 2 bars, soit une profondeur de 30 mètres, il y a risque de narcose !!! Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015

Applications à la plongée (7/7) • Mécanisme Symptômes: : – – – – Ivresse des profondeurs / Euphorie. La narcose est une altération de la transmission des influx nerveux. Sensation de déséquilibre / Trouble de lade vision. Il y a fixation d’azote sur les gaines myélines recouvrant les fibres Difficulté à lire les instruments (profondimètre, ordinateur. . ). nerveuses. Retard de réponse aux signes. Accentuation du dialogue intérieur. Diminution de l'attention, de la mémoire, de la coordination. Perte de conscience => mort par noyade (lâchage d'embout, masque arraché). • Conduite à tenir: – Signaler rapidement et remonter immédiatement • Prévention : Descente lente / Pas d’efforts inutiles Maîtrise technique (gilet) Le froid est parfois un facteur aggravant S’observer (sentir ses réactions) et observer ses coéquipiers. Être en bonne condition physique. Éviter de plonger après une mauvaise nuit ou une soirée trop « arrosée » . – L'essoufflement favorise la narcose ainsi que le manque de repères visuels – Limiter la profondeur et la durée – – – Les Gaz et leurs effets selon la pression Cours N 2 – 29 Janvier 2015