Legaturi cristaline Prof Marilena Col Colegiul Naional I



















- Slides: 25

Legaturi cristaline Prof. Marilena Colţ Colegiul Naţional “I. L. Caragiale”, Ploieşti

• • Legătura chimică este forţa care menţine împreună atomii în molecule. Aceasta: - determină structura şi proprietăţile substaţelor - este determinată de învelişul electronic exterior al atomilor. Atomii nu sunt stabili în stare liberă, având învelişuri atomice incomplete în starea fundamentală – ei au tendinţa de a se lega între ei. Procesul de combinare a atomilor formarea legăturilor chimice – are loc spontan, cu degajare de energie. Starea finală – molecula, macromolecula sau reţeaua – este mai stabilă decât atomii liberi şi are o energie mai mică. Formarea legăturilor chimice este consecinţa a două fenomene: - stabilitatea deosebită a configuraţiei de gaz nobil a atomilor, -tendinţa atomilor de a-şi ocupa cât mai complet orbitalele vacante.

Teoria electronică a legăturii chimice (clasică) – W. Kossel, G. N. Lewis • Prin combinare chimică atomii îşi modifică straturile exterioare de electroni, realizând configuraţii mai stabile, identice cu ale gazelor nobile sau apropiate de acestea. Teoria electronică a legăturii chimice se bazează pe câteva principii şi anume: • - tendinţa de combinare este cauzată de nestabilitatea configuraţiei electronice a atomilor liberi, • - stabilitatea configuraţiei de gaz nobil – realizarea octetului electronic, • - tendinţa de folosire cât mai completă a electronilor şi orbitalelor disponibile.

Legătura ionică – electrovalenţa – W. Kossel în 1916 a elaborat teoria electronică a legăturii ionice. Această legătură ia naştere între elemente cu caracter chimic diferit, deci cu diferenţe mari de electronegativitate. Conform acestei teorii formarea legăturii ionice presupune două etape: 1. atracţia electrostatică dintre ioni. 2. formarea ionilor : are loc prin pierdere sau câştig de electroni: - metalele puternic electropozitive, cu un număr mic de electroni pe ultimul nivel faţă de configuraţia de gaz nobil (mai ales din grupele 1 şi 2), cedează aceşti electroni, trecând în ioni pozitivi numiţi cationic. Aceştia au configuraţia electronicǎ a elementului precedent - nemetalele – puternic electronegative – cu deficit mic de electroni faţă de configuraţia de gaz nobil, primesc electroni, trecând în ioni negativi numiţi anioni. Aceştia vor avea configuraţia electronică a gazului nobil următor

• Nu există „molecule ionice” ci numai ioni într-o reţea cristalină, în care fiecare ion este înconjurat de un num de ioni de semn contrar, astfel încât atracţiile electrostatice să fie maxime şi respingerile minime, asigurânduse neutralitatea reţelei în ansamblu. Legătura ionică nu se saturează, se respectă doar neutralitatea sistemului. • La formarea combinaţiilor ionice se degajă energie – cu cât aceasta este mai mare, stabilitatea combinaţiei este • mai mare. La aceasta contribuie: - atracţia coulombiană dintre ioni (în stare gazoasă), - energia de reţea a cristalelor ionice (se degajă), - solvatarea ionilor. • Energia de reţea compensează energia consumată la formarea ionilor. Energia de formare a combinaţiilor ionice din ioni izolaţi raportată la un mol de substanţă, reprezintă tăria legăturii ionice.

Caracteristicile legăturii ionice: • • • este de natură fizică – atracţie electrostatică între ioni. • este neorientată în spaţiu – ionii pot fi consideraţi sfere rigide încărcate electric – câmpul este distribuit uniform în toate direcţiile. • este nesaturată – un ion se înconjoară cu un număr maxim de ioni de semn contrar, în funcţie de dimensiunile lor relative - numărul de coordinaţie (N. C. ). Acesta depinde de raportul razelor cation /anion ( r+ /r). • este o legătură relativ puternică – scade cu creşterea distanţei după legea lui Coulomb: forţa de atracţie este proporţională cu -e 2/r unde e este sarcina ionului şi r distanţa dintre sarcini. • nu există legătură ionică pură- datorită polarizaţiei mutuale a ionilor, apare un caracter parţial covalent. Legura ionică este cazul limită a legăturii covalente polare.

Substanţele cu reţele ionice au câteva proprietăţi caracteristice: • - au caracter salin (majoritatea sunt săruri), • - au puncte de topire (tt) şi de fierbere (tf) ridicate, • - se dizolvă în sovenţi polari (apă), în soluţie apoasă are loc fenomenul de hidratare a ionilor prin care ionii se înconjoară cu moleculele dipolare ale apei. • - în stare solidă sunt izolatori, • - soluţiile substanţelor ionice în apă conduc curentul electric, de aceea se numesc electroliţi sau conductori electrici de ordinul II, având conductibilitate ionică. În acelaşi mod conduc curentul electric şi topiturile ionice.

Legătura covalentă – covalenţa (G. N. Lewis) • • • Tendinţa de formare a octetului se realizează în acest caz, spre deosebire de legătura ionică, prin punere în comun de electroni, cu formare de perechi de electroni de legătură. Alte caracteristici importante sunt: - numărul covalenţelor este egal cu numărul de electroni puşi în comun (cuplaţi), - ia naştere între atomi de acelaş fel sau cu caracter chimic foarte apropiat (electronegativităţi apropiate), - covalenţa în grupele principale este egală cu 8 minus numărul grupei – aceasta reprezintă chiar numărul de electroni necesari pentru completarea octetului, - atomii realizează octet prin punerea în comun de electroni. Regula octetului este riguros valabilă practic numai pentru elementele din perioada a 2 -a. În celelalte perioade se formează configuraţii diferite : 10, 12, 14, 18 electroni. - prin legături covalente se formează molecule.

• • • Exemple: Perechile de electroni neangajate în legǎturi se numesc electroni neparticipanţi. Se mai pot forma şi legături multiple între atomi de acelaşi fel. De exemplu menţionăm: • : Ö=Ö: : N≡N: =C=C= -C≡C-

Caracteristicile legăturii covalente sunt: • • • - este orientată în spaţiu, - este rigidă (atomii ocupă poziţii fixe), - este saturată, - este foarte puternică, - prin covalenţe se formează molecule independente (în stare gazoasă) sau reţele atomice (în stare solidă), • - la moleculele formate din atomi diferiţi, apare fenomenul de polarizare, • Caracteristicile substanţelor cu legături covalente diferă în funcţie de moleculele substanţelor dar şi în funcţie de reţelele rezultate.

• Substanţele cu molecule mici (O 2, N 2, CO 2, NH 3, etc; substanţe organice) • - sunt gaze sau lichide la temperatura ordinară, • - au temperaturi de topire (tt) şi de fierbere (tf) joase, • - între molecule există forţe de atracţie slabe – van der Waals, • -sunt solubile în solvenţi organici, • - soluţiile sunt neelectroliţi. • Substanţele solide cu reţele atomice (diamant, siliciu, carburi, boruri etc): • - sunt foarte stabile chimic, • - au puncte de topire şi de fierbere foarte ridicate, • - multe dintre ele sunt foarte dure.

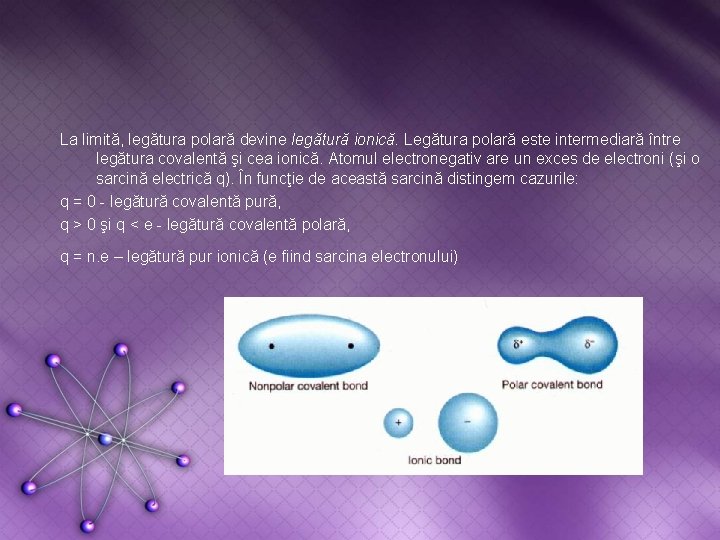
Legătura covalentă polară. Din punct de vedere al naturii atomilor constituenţi, moleculele pot fi: - Molecule homonucleare – formate din atomi identici – au norul electronic simetric. - Molecule heteronucleare – formate din atomi diferiţi – norul electronic este asimetric iar perechea de electroni de legătură este atrasă mai mult de atomul mai electronegativ (densitatea de sarcină negativă este mai mare în jurul atomului mai electronegativ). Ilustrarea variatiei electronegativitatii in sistemul periodic

La limită, legătura polară devine legătură ionică. Legătura polară este intermediară între legătura covalentă şi cea ionică. Atomul electronegativ are un exces de electroni (şi o sarcină electrică q). În funcţie de această sarcină distingem cazurile: q = 0 - legătură covalentă pură, q > 0 şi q < e - legătură covalentă polară, q = n. e – legătură pur ionică (e fiind sarcina electronului)

• • • Teoria mecanic-cuantică a covalenţei Covalenţa – prin contopirea orbitalelor atomice se formează orbitale moleculare care aparţin întregii molecule. Mecanica cuantică – calculează (cu aproximaţie) ecuaţiile şi geometriile orbitalelor moleculare. Etapele formării legăturii covalente conform mecanicii cuantice: - redistribuirea orbitalelor atomice, - suprapunerea (întrepătrunderea) orbitalelor atomice (OA)cu formarea de orbitale moleculare (OM), ocuparea OM cu perechi de electroni. Se pot combina orbitale atomice de simetrie (orientare) potrivită şi de energie apropiată. Procesul are loc cu eliberare de energie – proces spontan starea rezultată (molecula) este mai stabilă decât atomii izolaţi. Există două metode matematice de tratare a legurii chimice: - metoda orbitalelor moleculare (OM) - metoda legăturii de valenţă (LV) – sau metoda perechilor de electroni de legătură. Acestea diferă mai mult prin modul matematic de tratare concluziile fiind similare. Metoda LV e mai simplă şi poate exprima formare multor molecule. Dar nu toate legăturile chimice se pot reduce la perechi de electroni – sunt cazuri în care participă mai mulţi electroni (ex. în benzen - legături delocalizate). Metoda OM poate însă rezolva numai molecule mai simple, pentru cele mai complicate calculele sunt insurmontabile.

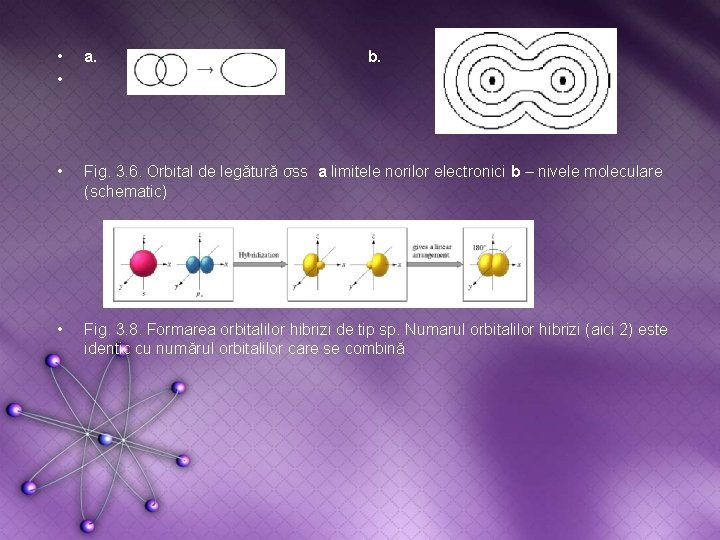
• • a. • Fig. 3. 6. Orbital de legătură σss a limitele norilor electronici b – nivele moleculare (schematic) • Fig. 3. 8. Formarea orbitalilor hibrizi de tip sp. Numarul orbitalilor hibrizi (aici 2) este identic cu numărul orbitalilor care se combină b.

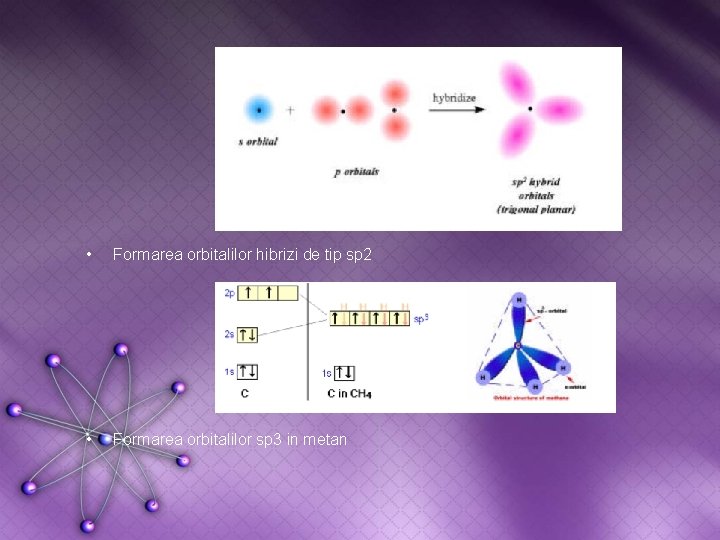
• Formarea orbitalilor hibrizi de tip sp 2 • Formarea orbitalilor sp 3 in metan

• • • Legătura coordinativă (donor – acceptor) Este o legătură covalentă în care perechea de electroni de legătură provine de la un singur atom – donor. Atomul care acceptă perechea de electroni – acceptor. Reacţia poate fi scrisă: : NH 3 + BF 3 = H 3 N → BF 3 Săgeata indică aici o legătura donor-acceptor, amoniacul fiind donorul iar atomul de bor (B) care în BF 3 doar 6 electroni de legătură în jurul său este acceptorul. Situaţia electronilor este ilustrată mai jos unde perechea de electroni cedată de amoniac este colorată în roşu: Combinaţiile formate prin legături coordinative – denumite combinaţii complexe – sunt formate dintr-un ion central (metal) şi liganzi. Liganzii pot fi molecule neutre sau anioni. Numărul de liganzi care înconjoară ionul central poartă numele de numar de coordinaţie. Exemple de formare a denumirilor: [Cu(NH 3)4]2+ + 2 Cl- - clorură tetraaminocupru(II) [Co(NH 3)6]2+ + 2 Cl- - clorură hexaaminocobalt(II) Na+ + [Ag(CN)2]- - dicianoargentat de sodiu 4 K+ + [Fe(CN)6]4 - - ferocianură de potasiu sau hexacianoferat de potasiu.

Teoria mecanic-cuantică a covalenţei • • • Covalenţa – prin contopirea orbitalelor atomice se formează orbitale moleculare care aparţin întregii molecule. Mecanica cuantică – calculează (cu aproximaţie) ecuaţiile şi geometriile orbitalelor moleculare. Etapele formării legăturii covalente conform mecanicii cuantice: - redistribuirea orbitalelor atomice, - suprapunerea (întrepătrunderea) orbitalelor atomice (OA)cu formarea de orbitale moleculare (OM), Legătura covalentă nepolară Legătura covalentă polară LegăturaionicăFig. 3. 5. Ilustrarea cazurilor limită ale legăturilor covalente şi ionice Legături Chimice 8 - ocuparea OM cu perechi de electroni. Se pot combina orbitale atomice de simetrie (orientare) potrivită şi de energie apropiată. Procesul are loc cu eliberare de energie – proces spontan starea rezultată (molecula) este mai stabilă decât atomii izolaţi. Există două metode matematice de tratare a legurii chimice: - metoda orbitalelor moleculare (OM) - metoda legăturii de valenţă (LV) – sau metoda perechilor de electroni de legătură. Acestea diferă mai mult prin modul matematic de tratare concluziile fiind similare. Metoda LV e mai simplă şi poate exprima formare multor molecule. Dar nu toate legăturile chimice se pot reduce la perechi de electroni – sunt cazuri în care participă mai mulţi electroni (ex. în benzen - legături delocalizate). Metoda OM poate însă rezolva numai molecule mai simple, pentru cele mai complicate calculele sunt insurmontabile

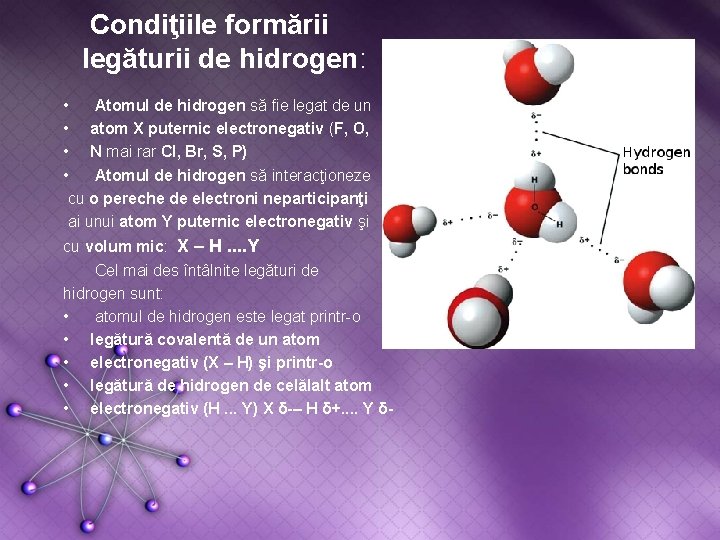
LEGĂTURI DE HIDROGEN • • S – a observat că hidrurile elementelor din perioada a 2 -a (HF, H 2 O, NH 3) au puncte de fierbere cu mult mai mari decât hidrurile elementelor din perioada a 3 -a, vecine lor în sistemul periodic. S-au observat „anomalii” şi pentru alte proprietăţi fizice (punct de topire, densitate, căldură de vaporizare, etc. ) ale acestor substanţe anorganice, precum şi în cazul unor substanţe organice care conţin în molecule grupe – OH, COOH şi – NH 2. Aceste anomalii au condus la ideea că aceste molecule sunt unite între ele prin interacţii slabe în asociaţii moleculare de tipul (HF)n, (H 2 O)n, (NH 3)n.

Condiţiile formării legăturii de hidrogen: • Atomul de hidrogen să fie legat de un • atom X puternic electronegativ (F, O, • N mai rar Cl, Br, S, P) • Atomul de hidrogen să interacţioneze cu o pereche de electroni neparticipanţi ai unui atom Y puternic electronegativ şi cu volum mic: X – H. . Y Cel mai des întâlnite legături de hidrogen sunt: • atomul de hidrogen este legat printr-o • legătură covalentă de un atom • electronegativ (X – H) şi printr-o • legătură de hidrogen de celălalt atom • electronegativ (H. . . Y) X δ-– H δ+. . Y δ-

Caracteristicile legăturii de hidrogen: • • • Este de natură electrostatică Este mai slabă decât legătura covalentă şi mai puternică decât legătura van der Waals, având o energie de legătură de 2 -60 k. J/mol. (se desfac la creşterea temperaturii, la scăderea presiunii sau la diluarea cu solvenţi) Este mai lungă decât legătura covalentă şi mai scurtă decât legătura van der Waals (2, 3 – 3 Å) Sunt două tipuri de legături de hidrogen: Legături de hidrogen intermoleculare Se realizează între molecule dând naştere la asociaţii moleculare ��

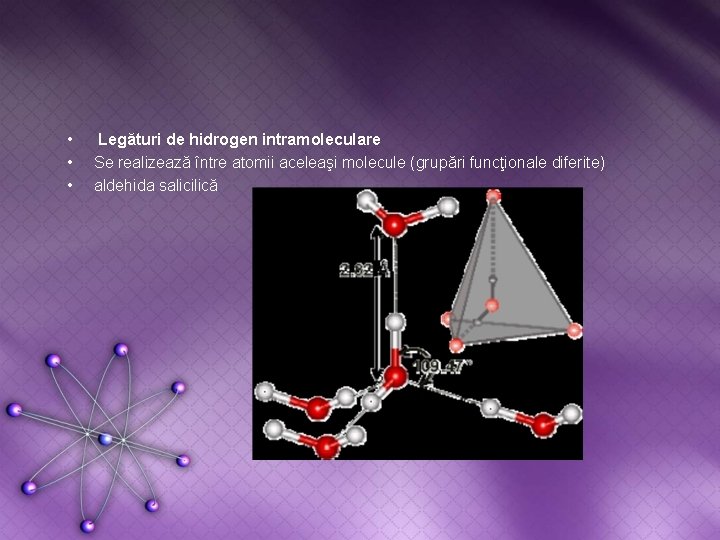
• • • Legături de hidrogen intramoleculare Se realizează între atomii aceleaşi molecule (grupări funcţionale diferite) aldehida salicilică

LEGĂTURI PRIN FORŢE van der WAALS • sunt forţe intermoleculare slabe care se manifestă în funcţie de proprietăţile moleculelor: • polaritatea moleculelor (μ – momentul de dipol) • şi polarizabilitatea lor (α). Ele se • manifestă uniform în jurul moleculelor, nu sunt dirijate în spaţiu, nu sunt saturate şi acţionează la distanţe foarte mici. • influenţează unele proprietăţi fizice ale substanţelor: tensiunea superficială, temperatura de fierbere, căldura de evaporare, lichefierea şi cristalizarea, etc. • intervin în formarea unor compuşi de tip special: complecşi moleculari (soluţii ale iodului în solvenţi organici), compuşi de incluziune (clatraţi).

Legătura metalică • Legătura metalică. Mineralogul si chimistul norvegian V. M. Goldschmidt considera că între atomii unui metal ar exista covalenţe. L. Pauling considera că în reţeaua metalică legăturile dintre atomi sunt în rezonanţă, electronii de valenţă fiind repartizaţi statistic în mod egal între toţi atomii alăturaţi ai reţelei cristaline. De exemplu, în reţeaua cristalină a sodiului fiecare atom, având un electron de valenţă în orbitalul 3 s, poate forma o covalenţă cu un atom vecin. Prin urmare, după L. Pauling, între atomii unui metal se stabilesc legături dielectronice, labile, care se desfac şi se refac necontenit, între diferitele perechi de atomi vecini din reţea. La formarea legăturilor metalice în sodiul cristalizat ia parte numai electronul de valenţă al fiecarui atom în parte. Pentru explicarea intensităţii legăturii metalice, L. Pauling considera că prin transfer de electroni de la un atom la altul se formează şi structuri ionice. Prin urmare, la metale unii atomi primesc mai mulţi electroni decât pot include în stratul de valenţă.

• Coeziunea mare a metalelor este explicată de către L. Pauling prin existenţa valenţei metalice, care este cuprinsă între 1 şi 6. Valenţa metalică este reprezentată de numarul electronilor care participă la formarea legăturii metalice. Pentru elementele cu Z=19 -31 valenta metalică este reprezentată de cifra scrisă deasupra fiecarui element. Prin urmare, numarul maxim de legături metalice este format de metalele tranziţionale cu coeziune maximă din grupele VI b, VII b şi VIII b. • Metalele al căror număr de legături metalice este mare, au raze atomice mici, densităţi şi durităţi mari, temperaturi de topire şi de fierbere ridicate, precum şi o rezistenţă remarcabilă la solicitările mecanice exterioare. • Spre deosebire de covalenţe, legăturile metalice sunt nesaturate, nelocalizate şi nedirijate în spaţiu, ceea ce ar explica plasticitatea metalelor.
 Geosferele
Geosferele Caracol col col sal de tu casita
Caracol col col sal de tu casita Legaturi covalente polare
Legaturi covalente polare Utilizari alchine
Utilizari alchine Alcadiene proprietati chimice
Alcadiene proprietati chimice Legaturi omogene
Legaturi omogene Marilena beltramini
Marilena beltramini Etnometodi
Etnometodi Marilena chaui nascimento
Marilena chaui nascimento Marilena esposito
Marilena esposito Colegiul economic arad
Colegiul economic arad Colegiul tehnic danubiana roman
Colegiul tehnic danubiana roman Colegiul grigore antipa
Colegiul grigore antipa Liceul gh sincai
Liceul gh sincai Profesori vladimir streinu
Profesori vladimir streinu Gheorghe asachi piatra neamt
Gheorghe asachi piatra neamt Colegiul economic nicolae titulescu
Colegiul economic nicolae titulescu Colegiul national nichita stanescu ploiesti
Colegiul national nichita stanescu ploiesti Colegiul national nicolae iorga
Colegiul national nicolae iorga Elena doamna galati
Elena doamna galati Colegiul national silvania zalau
Colegiul national silvania zalau Colegiul ucecom
Colegiul ucecom Admitere clasa 5 informatica piatra neamt
Admitere clasa 5 informatica piatra neamt George baritiu cluj
George baritiu cluj Colegiul economic ion ghica bacau
Colegiul economic ion ghica bacau Colegiul economic delta dunarii tulcea
Colegiul economic delta dunarii tulcea