lectrolyse de leau additionne de soude ou hydroxyde










- Slides: 26

Électrolyse de l’eau additionnée de soude ou hydroxyde de sodium Na+ + OH- D’après T. DULAURANS adapté par JY CATHELINE

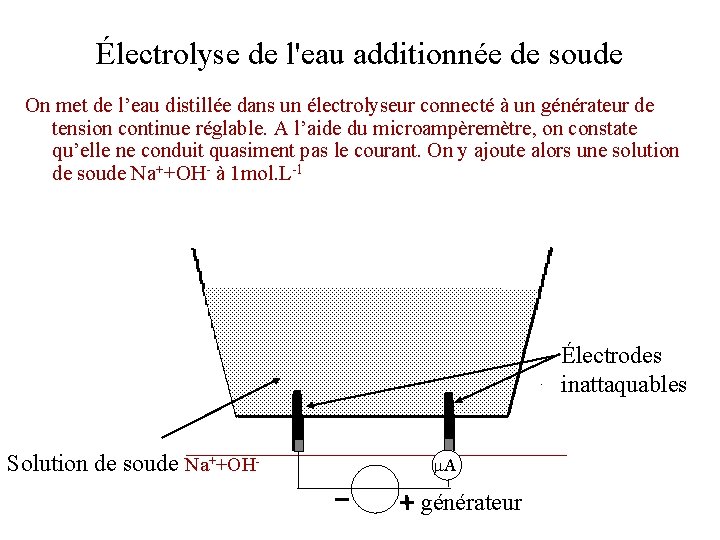
Électrolyse de l'eau additionnée de soude On met de l’eau distillée dans un électrolyseur connecté à un générateur de tension continue réglable. A l’aide du microampèremètre, on constate qu’elle ne conduit quasiment pas le courant. On y ajoute alors une solution de soude Na++OH- à 1 mol. L-1 Électrodes inattaquables Solution de soude Na++OH- A générateur

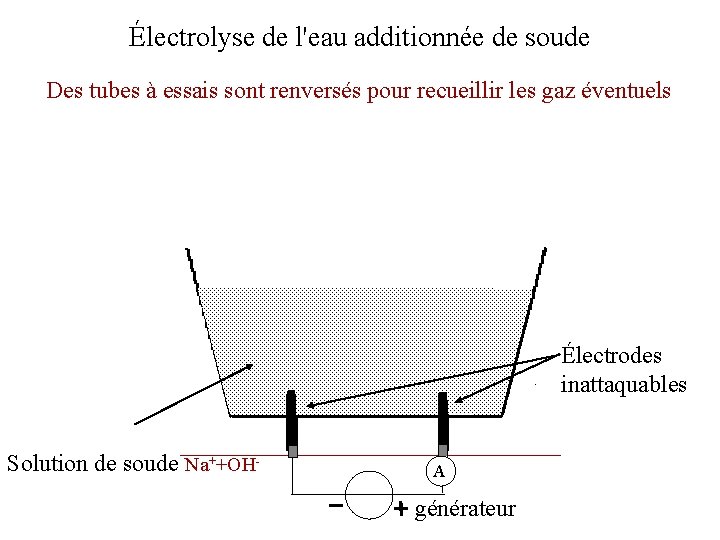
Électrolyse de l'eau additionnée de soude Des tubes à essais sont renversés pour recueillir les gaz éventuels Électrodes inattaquables Solution de soude Na++OH- A générateur

Électrolyse de l'eau additionnée de soude Des tubes à essais sont renversés pour recueillir les gaz éventuels Électrodes inattaquables Solution de soude Na++OHgénérateur

Électrolyse de l'eau additionnée de soude Électrodes inattaquables Solution de soude Na++OHgénérateur

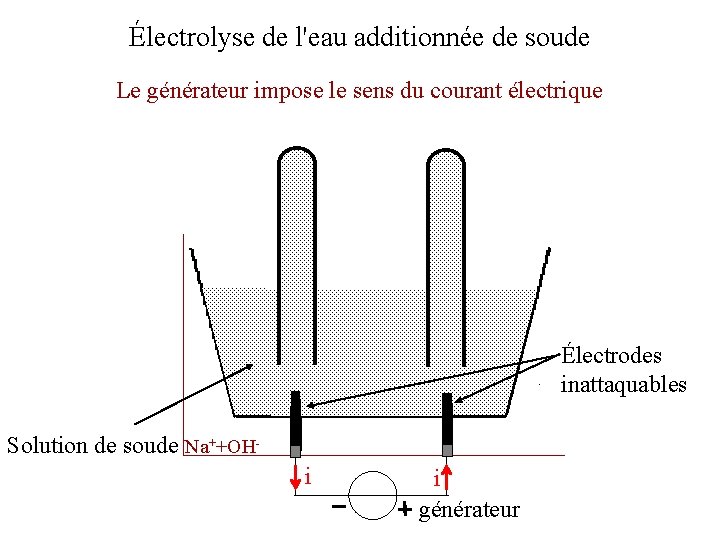
Électrolyse de l'eau additionnée de soude Le générateur impose le sens du courant électrique Électrodes inattaquables Solution de soude Na++OHi i générateur

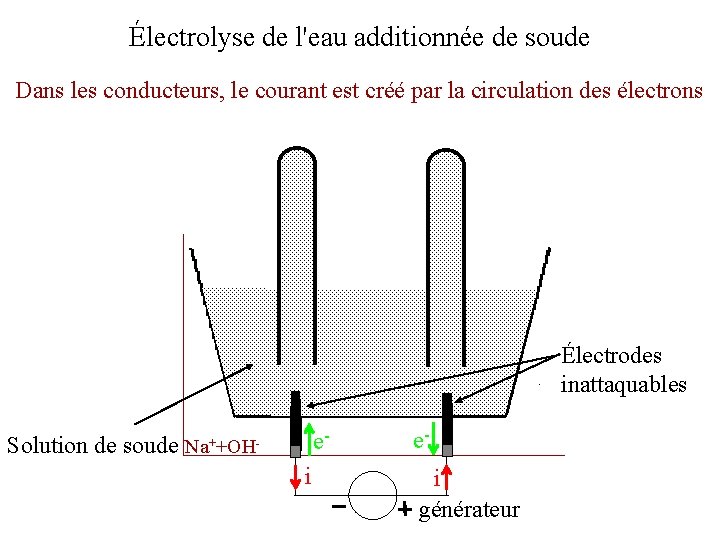
Électrolyse de l'eau additionnée de soude Dans les conducteurs, le courant est créé par la circulation des électrons Électrodes inattaquables Solution de soude e- Na++OH- i ei générateur

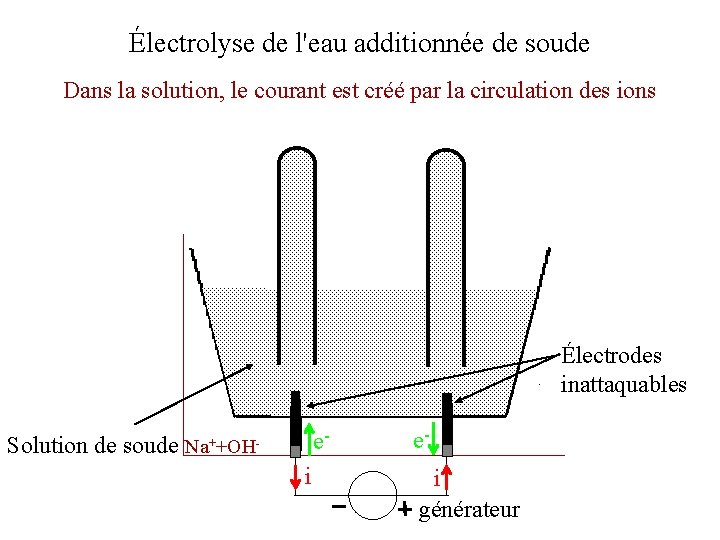
Électrolyse de l'eau additionnée de soude Dans la solution, le courant est créé par la circulation des ions Électrodes inattaquables Solution de soude e- Na++OH- i ei générateur

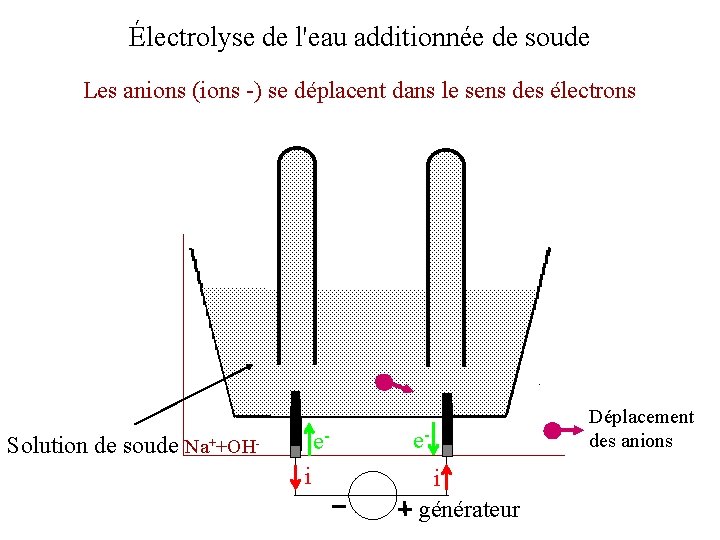
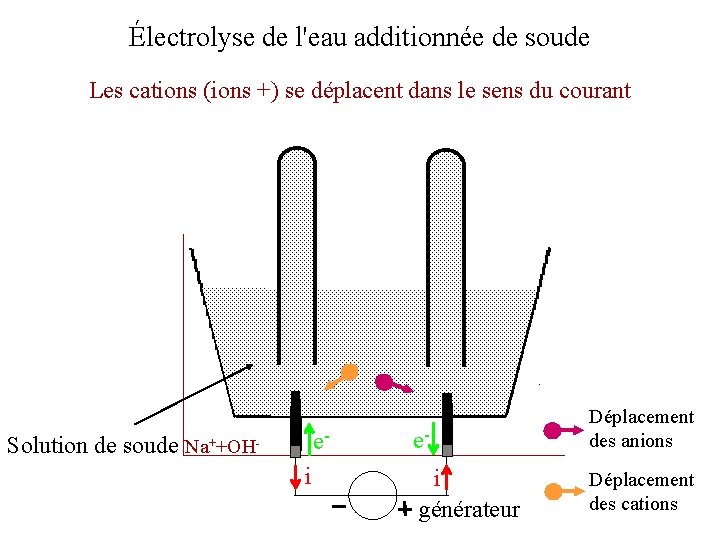
Électrolyse de l'eau additionnée de soude Les anions (ions -) se déplacent dans le sens des électrons Solution de soude e- Na++OH- i ei générateur Déplacement des anions

Électrolyse de l'eau additionnée de soude Les cations (ions +) se déplacent dans le sens du courant Solution de soude e- Na++OH- i e- Déplacement des anions i générateur Déplacement des cations

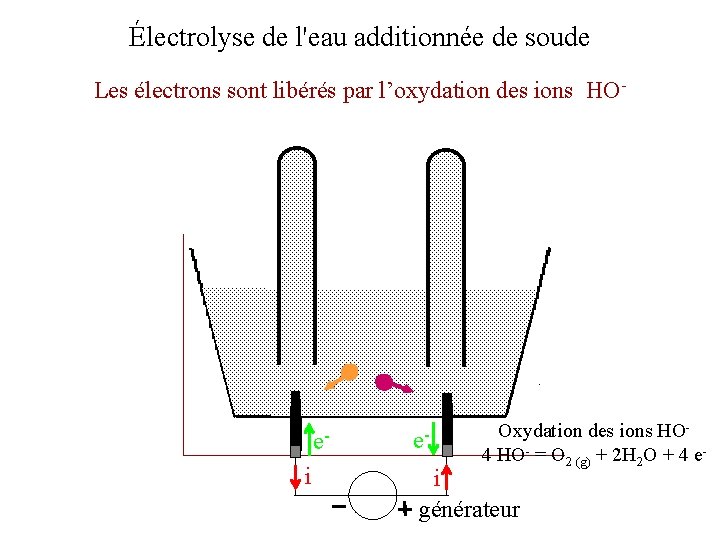
Électrolyse de l'eau additionnée de soude Les électrons sont libérés par l’oxydation des ions HO- ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

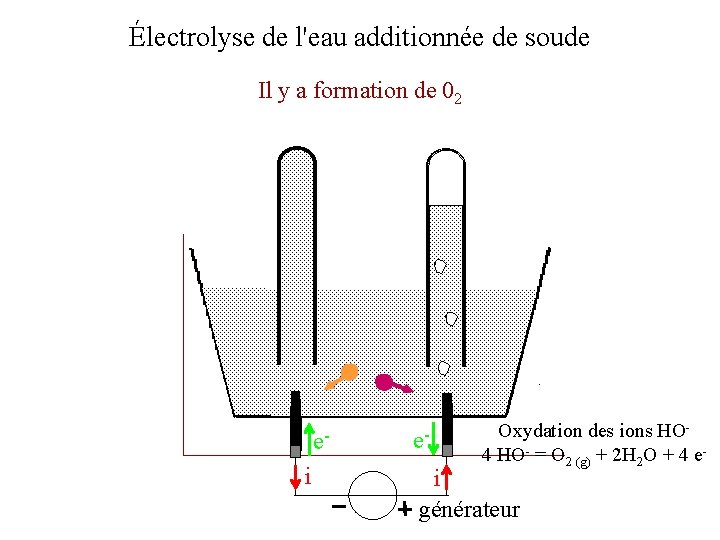
Électrolyse de l'eau additionnée de soude Il y a formation de 02 ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

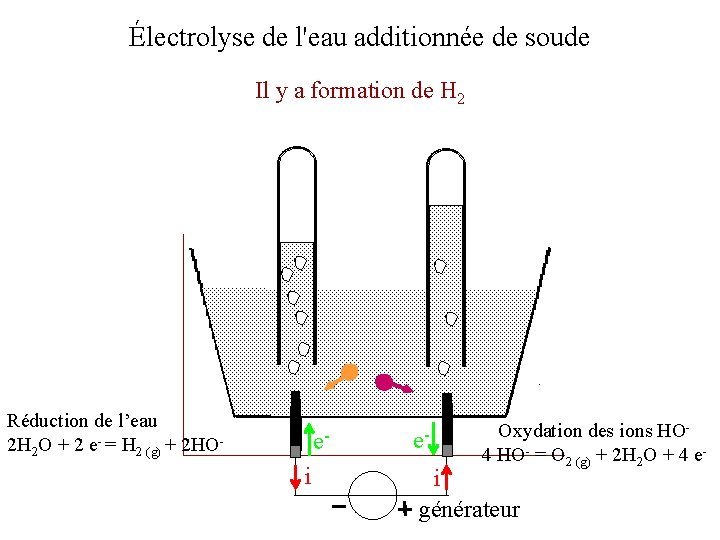
Électrolyse de l'eau additionnée de soude Les électrons sont consommés par la réduction de l’eau H 2 O Les ions Na + ne sont pas réduits Réduction de l’eau 2 H 2 O + 2 e- = H 2 (g) + 2 HO- ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

Électrolyse de l'eau additionnée de soude Il y a formation de H 2 Réduction de l’eau 2 H 2 O + 2 e- = H 2 (g) + 2 HO- ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

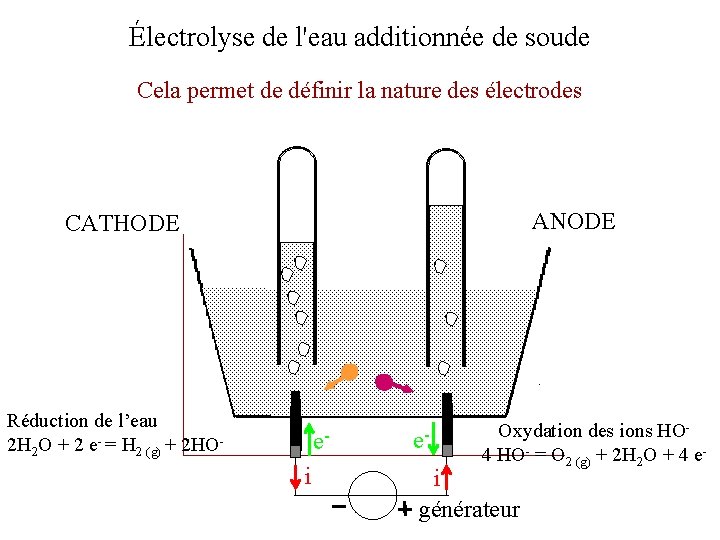
Électrolyse de l'eau additionnée de soude Cela permet de définir la nature des électrodes ANODE CATHODE Réduction de l’eau 2 H 2 O + 2 e- = H 2 (g) + 2 HO- ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

L’ANODE est l’électrode sur laquelle se produit l’OXYDATION. La CATHODE est l’électrode sur laquelle se produit la REDUCTION.

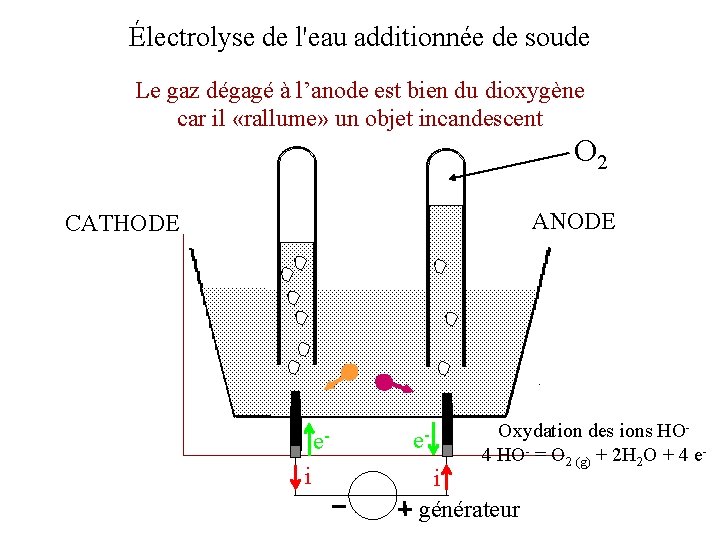
Électrolyse de l'eau additionnée de soude Le gaz dégagé à l’anode est bien du dioxygène car il «rallume» un objet incandescent O 2 ANODE CATHODE ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

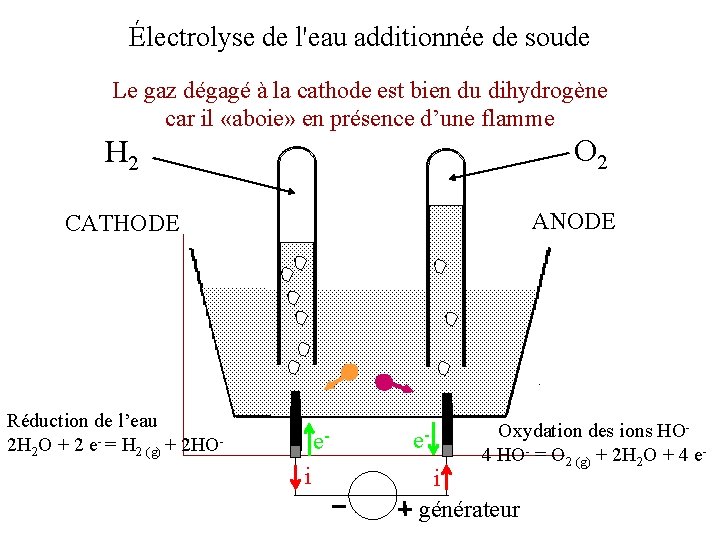
Électrolyse de l'eau additionnée de soude Le gaz dégagé à la cathode est bien du dihydrogène car il «aboie» en présence d’une flamme O 2 H 2 ANODE CATHODE Réduction de l’eau 2 H 2 O + 2 e- = H 2 (g) + 2 HO- ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

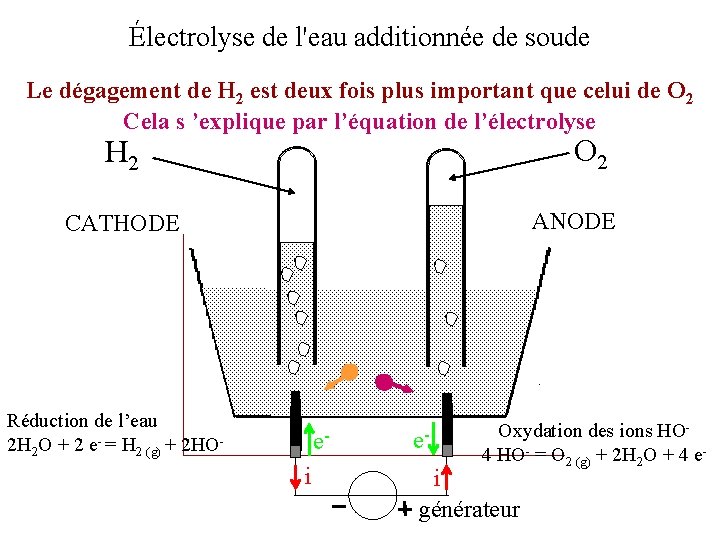
Électrolyse de l'eau additionnée de soude Le dégagement de H 2 est deux fois plus important que celui de O 2 Cela s ’explique par l’équation de l’électrolyse O 2 H 2 ANODE CATHODE Réduction de l’eau 2 H 2 O + 2 e- = H 2 (g) + 2 HO- ei e- Oxydation des ions HO 4 HO- = O 2 (g) + 2 H 2 O + 4 e- i générateur

Électrolyse de l'eau L’équation est celle du fonctionnement forcé : Oxydation des ions HO - à l’anode 4 HO- = O 2 (g) + 2 H 2 O + 4 e- Réduction à la cathode 4 H 2 O + 4 e- = 2 H 2 (g) + 4 HO- Formation de O 2 Formation de H 2 Équation 2 H 2 O = 2 H 2 + O 2 La quantité de H 2 formé est bien deux fois plus grande que celle de O 2 Le volume de H 2 formé est donc deux fois plus grand que celui de O 2





