Le tableau priodique des lments Origine et utilit

Le tableau périodique des éléments
Origine et utilité Le tableau périodique classifie les éléments (substances non décomposables) connus. Le tableau périodique moderne donne les noms, les symboles et plusieurs propriétés des éléments. Comme chaque élément correspond à un atome donné, le tableau classifie aussi les atomes connus. On doit le premier tableau périodique au chimiste d’origine russe, Dmitri Ivanovitch

Premiers tableaux périodiques Dans les premiers tableaux périodiques, les premiers 63 éléments connus étaient classés par ordre croissant de masse atomique et les colonnes correspondaient à des familles ayant des propriétés semblables. H 1 Li 7 Na 23 K 39 Rb 85 Cs 133 Famille des alcalins Éléments difficiles à classer : éléments de transition Élément encore inconnu Famille des halogènes Be B C N O F 9, 4 11 12 14 16 19 Mg Al Si P S Cl 24 27, 3 28 31 32 35, 5 Ca Ti V Cr Mn Fe Co Ni Cu Zn As Se Br 40 48 51 52 55 56 59 59 63 65 75 78 80 Sr In Sn Sb Te J Yt Zr Nb Mo Ru Rh Pd Ag Cd 87 113 118 122 125 127 Ba Di Ce Er La Ta W Os Ir Pt Au Hg Tl Pb Bi 137 138 140 178 180 182 184 195 197 198 199 200 204 207 208 Th U 231 240 Ancien symbole pour l ’iode

Le tableau périodique moderne La classification moderne des éléments est basée sur leur structure atomique. Niveau électronique Protons et neutrons dans le noyau Les éléments sont classés par ordre de numéro atomique (nombre de protons dans le noyau). Chaque nouvelle ligne ou période du tableau représente un niveau électronique supplémentaire. Le nombre d’éléments dans une période est fonction du nombre maximum d’électrons qu’on peut trouver dans un niveau (2, 8 , 18 ou 32).

Les périodes Le tableau périodique moderne comprend 7 périodes. 1 2 3 Périodes 4 5 6 7 1 H 3 Li 11 Na 19 K 37 Rb 55 Cs 87 Fr 4 Be 12 Mg 20 Ca 38 Sr 56 Ba 88 Ra 21 Sc 39 Y 57 La 89 Ac Faute de place, les éléments 5871 et 90 -103 sont placés en bas du 22 Ti 40 Zr 72 Hf 104 Rf 23 V 41 Nb 73 Ta 105 Ha 58 59 Ce Pr 90 91 Th Pa 24 Cr 42 Mo 74 W 106 Sg 60 Nd 92 U 25 Mn 43 Tc 75 Re 107 Uns 26 Fe 44 Ru 76 Os 108 Uno 27 Co 45 Rh 77 Ir 109 Une 28 Ni 46 Pd 78 Pt 110 Uun 8 O 16 S 34 Se 52 Te 84 Po 9 F 17 Cl 35 Br 53 I 85 At 2 He 10 Ne 18 Ar 36 Kr 54 Xe 86 Rn 65 66 67 68 69 Tb Dy Ho Er Tm 97 98 99 100 101 Bk Cf Es Fm Md 70 Yb 102 No 71 Lu 103 Lr 5 6 B C 13 14 Al Si 29 30 31 32 Cu Zn Ga Ge 47 48 49 50 Ag Cd In Sn 79 80 81 82 Au Hg Tl Pb 111 Uuu 61 62 63 64 Pm Sm Eu Gd 93 94 95 96 Np Pu Am Cm 7 N 15 P 33 As 51 Sb 83 Bi

Les groupes Le tableau périodique moderne comprend 18 groupes et 2 séries. Groupes 1 2 3 4 5 6 7 1 1 H 3 Li 11 Na 19 K 37 Rb 55 Cs 87 Fr 18 2 4 Be 12 Mg 20 Ca 38 Sr 56 Ba 88 Ra 8 O 16 S 34 Se 52 Te 84 Po 9 F 17 Cl 35 Br 53 I 85 At 2 He 10 Ne 18 Ar 36 Kr 54 Xe 86 Rn 65 66 67 68 69 Tb Dy Ho Er Tm 97 98 99 100 101 Bk Cf Es Fm Md 70 Yb 102 No 71 Lu 103 Lr 13 14 15 16 17 3 4 5 6 7 8 21 Sc 39 Y 57 La 89 Ac 22 Ti 40 Zr 72 Hf 104 Rf 23 V 41 Nb 73 Ta 105 Ha 24 Cr 42 Mo 74 W 106 Sg 25 Mn 43 Tc 75 Re 107 Uns 26 Fe 44 Ru 76 Os 108 Uno Série des lanthanides Série des actinides 58 59 Ce Pr 90 91 Th Pa 60 Nd 92 U 9 10 27 Co 45 Rh 77 Ir 109 Une 28 Ni 46 Pd 78 Pt 110 Uun 5 6 B C 14 11 12 13 Al Si 29 30 31 32 Cu Zn Ga Ge 47 48 49 50 Ag Cd In Sn 79 80 81 82 Au Hg Tl Pb 111 Uuu 61 62 63 64 Pm Sm Eu Gd 93 94 95 96 Np Pu Am Cm 7 N 15 P 33 As 51 Sb 83 Bi

Propriétés des éléments Dans les tableaux modernes, les caractères utilisés pour les symboles des éléments nous renseignent sur leurs propriétés. Élément naturel solide Élément naturel liquide H C Élément naturel gazeux Élément artificiel Un trait plein sépare les éléments métalliques (à gauche) des éléments non métalliques (à droite) Tc Br
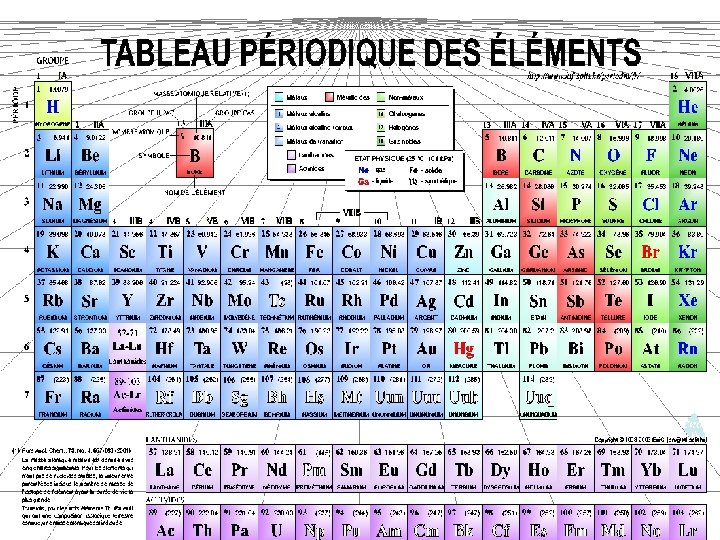
a. TABLEAU PÉRIODIQUE
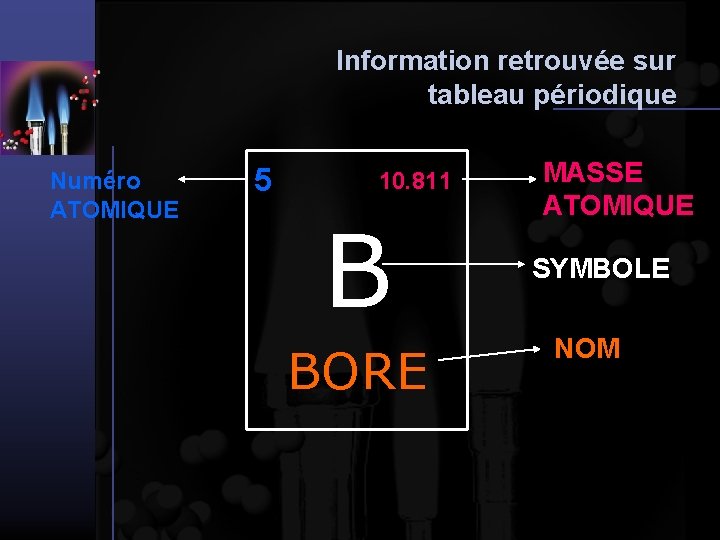
Information retrouvée sur tableau périodique Numéro ATOMIQUE 5 10. 811 B BORE MASSE ATOMIQUE SYMBOLE NOM

Information retrouvée sur tableau périodique Les tableaux modernes peuvent aussi fournir un grand nombre de renseignements supplémentaires sur les éléments. Le symbole de l’élément Le nom de l’élément 1 20, 28 Le numéro atomique La masse atomique (g/mol) 13, 81 La configuration électronique 0, 0899 Le point d’ébullition (K) Le point de fusion (K) La masse volumique (g/l pour les gaz et g/ml pour les autres phases) Les états d’oxydation possibles 1, 00794 1 H 1 s 1 Hydrogène Certains tableaux donnent plusieurs autres informations
- Slides: 10