Le tableau priodique Classification des lments Chiffre romain

Le tableau périodique
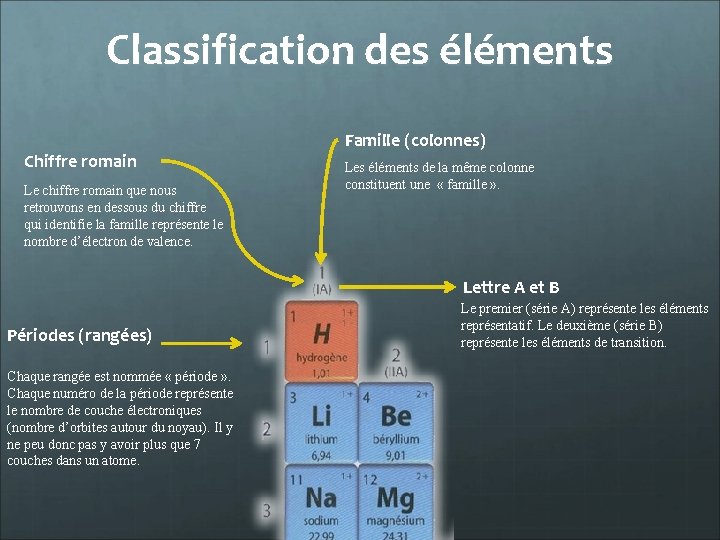
Classification des éléments Chiffre romain Le chiffre romain que nous retrouvons en dessous du chiffre qui identifie la famille représente le nombre d’électron de valence. Famille (colonnes) Les éléments de la même colonne constituent une « famille » . Lettre A et B Périodes (rangées) Chaque rangée est nommée « période » . Chaque numéro de la période représente le nombre de couche électroniques (nombre d’orbites autour du noyau). Il y ne peu donc pas y avoir plus que 7 couches dans un atome. Le premier (série A) représente les éléments représentatif. Le deuxième (série B) représente les éléments de transition.
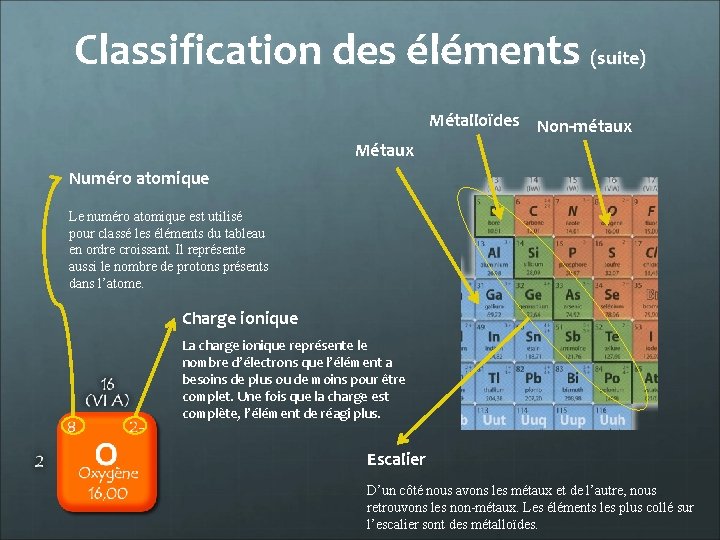
Classification des éléments (suite) Métalloïdes Non-métaux Métaux Numéro atomique Le numéro atomique est utilisé pour classé les éléments du tableau en ordre croissant. Il représente aussi le nombre de protons présents dans l’atome. Charge ionique La charge ionique représente le nombre d’électrons que l’élément a besoins de plus ou de moins pour être complet. Une fois que la charge est complète, l’élément de réagi plus. Escalier D’un côté nous avons les métaux et de l’autre, nous retrouvons les non-métaux. Les éléments les plus collé sur l’escalier sont des métalloïdes.
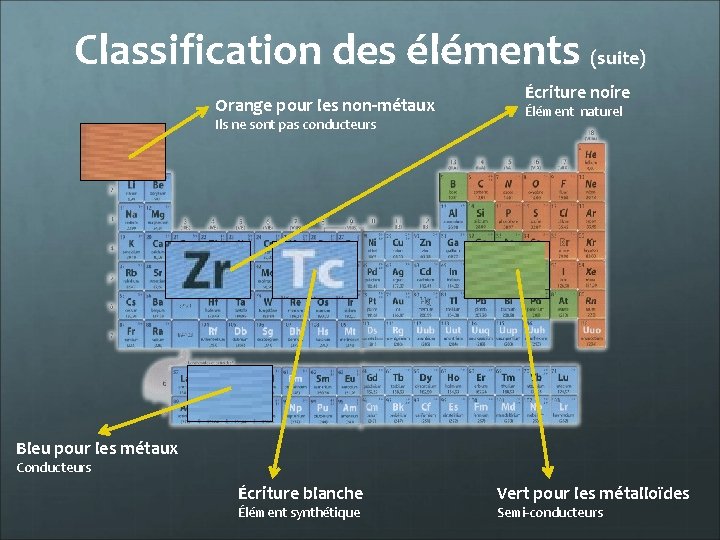
Classification des éléments (suite) Orange pour les non-métaux Ils ne sont pas conducteurs Écriture noire Élément naturel Bleu pour les métaux Conducteurs Écriture blanche Élément synthétique Vert pour les métalloïdes Semi-conducteurs
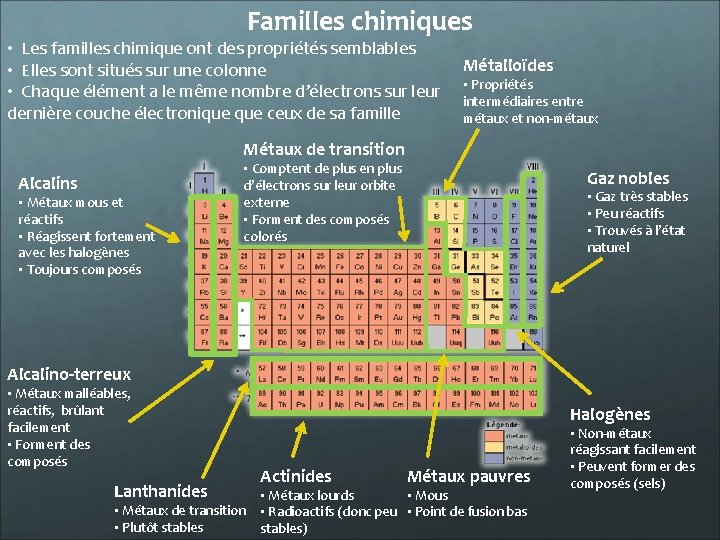
Familles chimiques • Les familles chimique ont des propriétés semblables • Elles sont situés sur une colonne • Chaque élément a le même nombre d’électrons sur leur dernière couche électronique ceux de sa famille Métalloïdes • Propriétés intermédiaires entre métaux et non-métaux Métaux de transition Alcalins • Métaux mous et réactifs • Réagissent fortement avec les halogènes • Toujours composés • Comptent de plus en plus d’électrons sur leur orbite externe • Forment des composés colorés Gaz nobles • Gaz très stables • Peu réactifs • Trouvés à l’état naturel Alcalino-terreux • Métaux malléables, réactifs, brûlant facilement • Forment des composés Lanthanides • Métaux de transition • Plutôt stables Halogènes Actinides Métaux pauvres • Métaux lourds • Mous • Radioactifs (donc peu • Point de fusion bas stables) • Non-métaux réagissant facilement • Peuvent former des composés (sels)
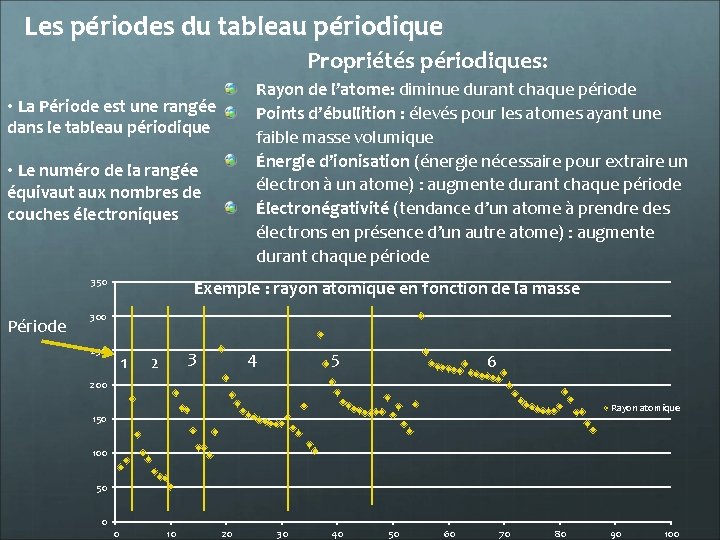
Les périodes du tableau périodique Propriétés périodiques: Rayon de l’atome: diminue durant chaque période Points d’ébullition : élevés pour les atomes ayant une faible masse volumique Énergie d’ionisation (énergie nécessaire pour extraire un électron à un atome) : augmente durant chaque période Électronégativité (tendance d’un atome à prendre des électrons en présence d’un autre atome) : augmente durant chaque période • La Période est une rangée dans le tableau périodique • Le numéro de la rangée équivaut aux nombres de couches électroniques 350 Période Exemple : rayon atomique en fonction de la masse 300 250 1 3 2 4 5 6 200 Rayon atomique 150 100 50 0 0 10 20 30 40 50 60 70 80 90 100
- Slides: 6