Le second principe de la thermodynamique 1 Ncessit






































- Slides: 43

Le second principe de la thermodynamique

1. Nécessité du second principe de la thermodynamique.

Premier principe : DU = W + Q

Premier principe : DU = W + Q Principe de conservation de l’énergie.

Premier principe : DU = W + Q Principe de conservation de l’énergie. Ne fixe pas le sens des échanges d’énergie.

Mélange de 100 g d’eau à 10 °C et de 100 g d’eau à 50 °C dans un calorimètre. Température finale : TF = 30 °C Q 1 = m 1. c. DT 1 = 0, 1*4185*(30 -10) = + 9370 J Q 2 = m 2. c. DT 2 = 0, 1*4185*(30 -50) = -9370 J DU = Q 1 +Q 2 = 0

On peut imaginer que les 100 g d’eau à 10 °C passent à 0 °C et les 100 g à 50 °C passent à 60 °C. Q 1 = m 1. c. DT 1 = 0, 1*4185*(0 -10) = - 4185 J Q 2 = m 2. c. DT 2 = 0, 1*4185*(60 -50) = +4185 J DU = Q 1 +Q 2 = 0

Les deux hypothèses vérifient le premier principe.

Il faut donc compléter le premier principe pour pouvoir rendre compte du sens des transformations (fixer le sens de la « flèche du temps » ).

2. Le second principe de la thermodynamique et la fonction entropie.

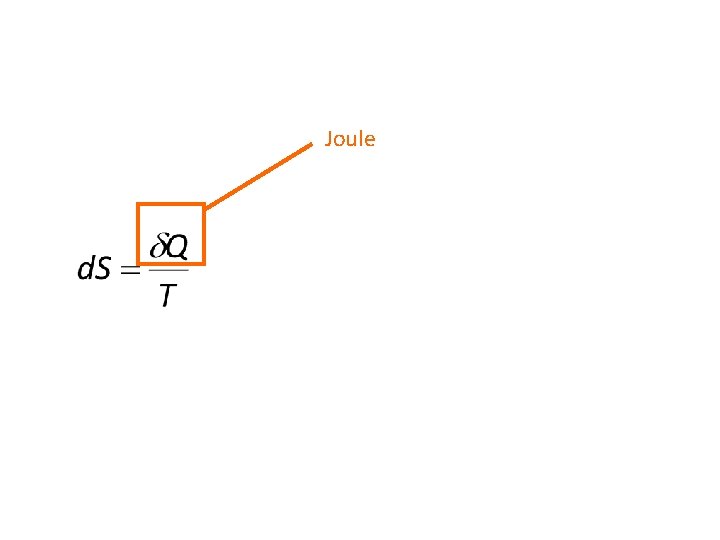
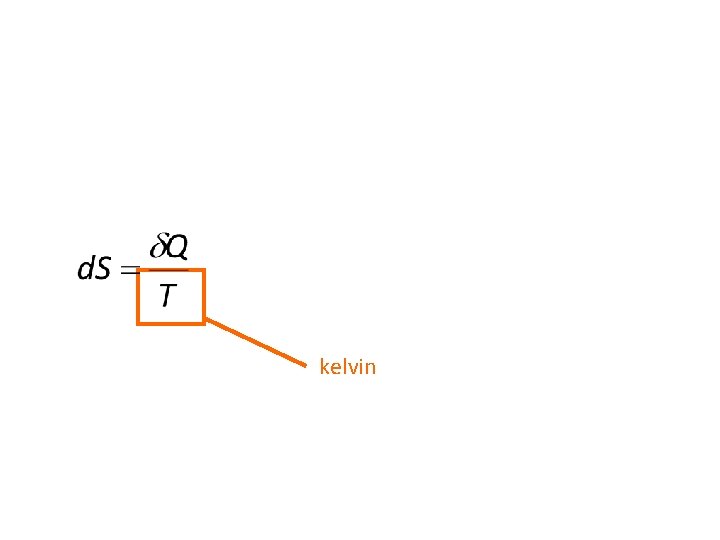
2. 1. Énoncé. À tout système fermé est associée la fonction d’état entropie S dont les variations sont données par :

Fonction définie par Clausius (1865). Je préfère emprunter aux langues anciennes les noms des quantités scientifiques importantes, afin qu'ils puissent rester les mêmes dans toutes langues vivantes; je proposerai donc d'appeler la quantité S l'entropie du corps, d'après le mot grec η τροπη une transformation. C'est à dessein que j'ai formé ce mot entropie, de manière qu'il se rapproche autant que possible du mot énergie; car ces deux quantités ont une telle analogie dans leur signification physique qu'une analogie de dénomination m'a paru utile.

d. Q : chaleur reçue par le système. Te : température de la source de chaleur. di. S, Di. S : termes positifs ou nuls.

2. 2. Commentaires et propriétés.


Joule

kelvin

L’entropie est en joules par kelvin (J. K-1).

Cas d’un système isolé : d. Q = 0 : pas de chaleur reçue de l’extérieur. d. S = di. S

Cas d’un système isolé : d. Q = 0 : pas de chaleur reçue de l’extérieur. d. S = di. S est positive

Cas d’un système isolé : d. Q = 0 : pas de chaleur reçue de l’extérieur. d. S = di. S est positive

Cas d’un système isolé : d. Q = 0 : pas de chaleur reçue de l’extérieur. d. S = di. S est positive L’entropie d’un système isolé ne peut qu’augmenter.

Pour l’Univers : L’entropie de l’Univers ne peut qu’augmenter.

Prévision des évolutions d’un système : Les seules transformations possibles sont celles qui font augmenter l’entropie de l’Univers.

Prévision des évolutions d’un système : Les seules transformations possibles sont celles qui font augmenter l’entropie de l’Univers. Un système cesse d’évoluer (équilibre) quand l’entropie de l’Univers n’augmente plus : d. S = 0

Transformation réversible : Une transformation réversible est une transformation infiniment lente renversable à chaque instant. On a alors : di. S = 0 Donc :

On sait donc calculer la variation d’entropie dans le cas d’une transformation réversible.

S est une fonction d’état. S est extensive : DSA+B = DSA + DSB

2. 3. Signification physique de l’entropie.

Entropie = mesure du désordre

Entropie = mesure du désordre Une transformation quelconque ne peut qu’augmenter le désordre de l’Univers.

2. 4. Principe de détermination de l’entropie. Identité thermodynamique.

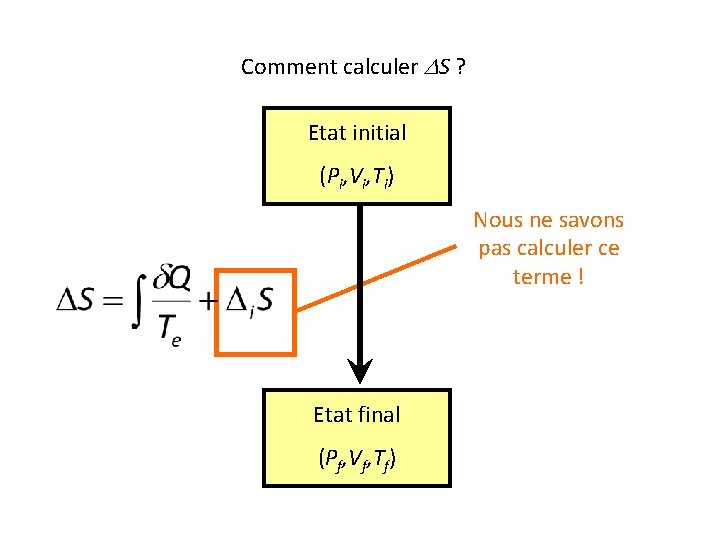
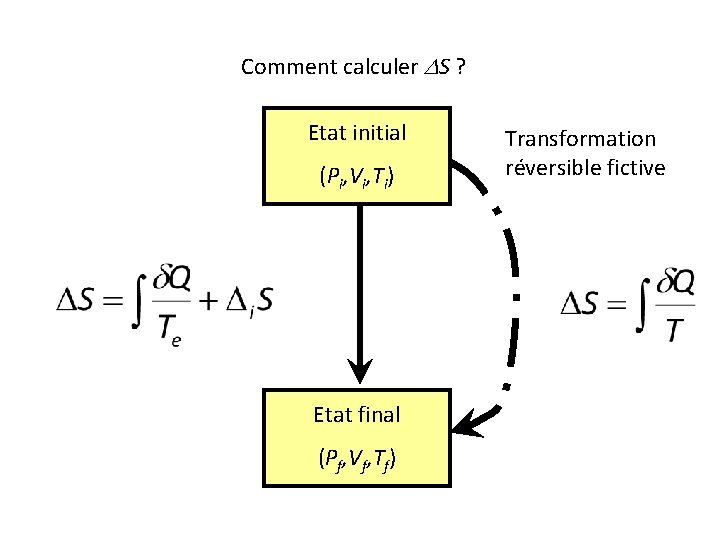
Comment calculer DS ? Etat initial (Pi, Vi, Ti) Etat final (Pf, Vf, Tf)

Comment calculer DS ? Etat initial (Pi, Vi, Ti) Nous ne savons pas calculer ce terme ! Etat final (Pf, Vf, Tf)

Mais S est une fonction d’état !

Comment calculer DS ? Etat initial (Pi, Vi, Ti) Etat final (Pf, Vf, Tf) Transformation réversible fictive

Utilisation de l’identité thermodynamique.

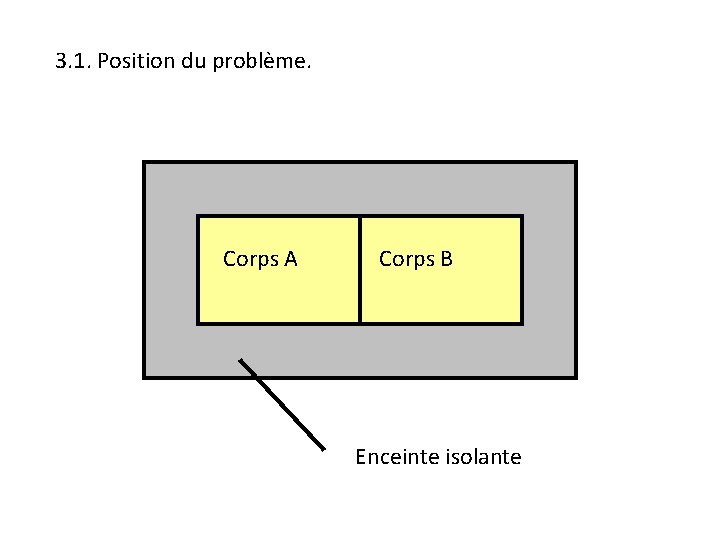
3. Exemple d’utilisation de l’entropie : étude du contact thermique entre deux corps.

3. 1. Position du problème. Corps A Corps B Enceinte isolante

Corps A : masse m, capacité thermique c, température initiale TA. Corps B : masse m, capacité thermique c, température initiale TB.

3. 2. Sens de l’évolution.

3. 3. Variation d’entropie.

4. Entropie du gaz parfait.
 Transformation adiabatique
Transformation adiabatique U en thermodynamique
U en thermodynamique 1er principe de la thermodynamique
1er principe de la thermodynamique 1 er principe thermo
1 er principe thermo Thermodynamique
Thermodynamique Thermodynamique
Thermodynamique Transfert thermique
Transfert thermique Enthalpie
Enthalpie Thermodynamique gaz parfait
Thermodynamique gaz parfait 27 miles per gallon into kilometers per liter
27 miles per gallon into kilometers per liter Fotos de la reina ester
Fotos de la reina ester équation de van deemter
équation de van deemter Bistouri électrique principe fonctionnement
Bistouri électrique principe fonctionnement Principe haccp
Principe haccp Principe chromecast
Principe chromecast Principe de superposition exemple
Principe de superposition exemple Principe de heisenberg
Principe de heisenberg Réactif de drabkin
Réactif de drabkin Principe de routage
Principe de routage Ekstraksi sinambung
Ekstraksi sinambung Principe de dénombrement
Principe de dénombrement Principe de secourisme
Principe de secourisme Kleurencirkel nm
Kleurencirkel nm Principe de fonctionnement d'un ascenseur
Principe de fonctionnement d'un ascenseur Principe de bernoulli
Principe de bernoulli El principe alacran mensaje
El principe alacran mensaje Grade nnn
Grade nnn Recouvrement ferraillage poutre
Recouvrement ferraillage poutre Nnn principe
Nnn principe Les maximes de grice
Les maximes de grice Sophisme pente fatale
Sophisme pente fatale Ionchromatografie principe
Ionchromatografie principe Amargos abismos
Amargos abismos Gauss el principe de las matematicas
Gauss el principe de las matematicas Principe du bionettoyage
Principe du bionettoyage Istituto il principe san casciano
Istituto il principe san casciano Principe fondamental de la statique
Principe fondamental de la statique Schema de principe ciseaux
Schema de principe ciseaux Principes de gelman
Principes de gelman Linking pin principe
Linking pin principe Primul principe al romei
Primul principe al romei Contraposée du principe d'inertie
Contraposée du principe d'inertie Principe de désenfumage
Principe de désenfumage Isoélectrofocalisation principe
Isoélectrofocalisation principe