LE MILIEU DE HUGH ET LEIFSON Source de





- Slides: 13

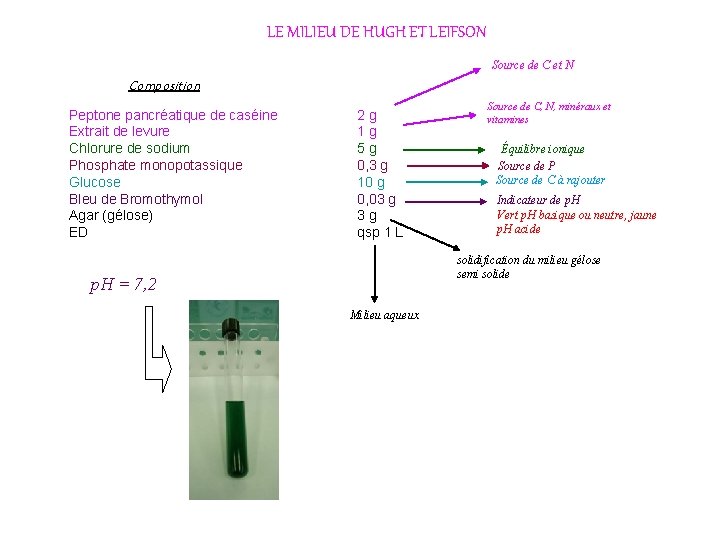
LE MILIEU DE HUGH ET LEIFSON Source de C et N Composition Peptone pancréatique de caséine Extrait de levure Chlorure de sodium Phosphate monopotassique Glucose Bleu de Bromothymol Agar (gélose) ED 2 g 1 g 5 g 0, 3 g 10 g 0, 03 g 3 g qsp 1 L Source de C, N, minéraux et vitamines Équilibre ionique Source de P Source de C à rajouter Indicateur de p. H Vert p. H basique ou neutre, jaune p. H acide solidification du milieu gélose semi solide p. H = 7, 2 Milieu aqueux

Technique d’ ensemencement 1 - Régénérer le tube 20 minutes au bain marie bouillant 2 - Ajouter le volume de solution de glucose stérile dans le milieu en surfusion: à 45°C 3 - A jouter trois gouttes de suspension bactérienne et refroidir immédiatement le tube sous l’eau froide. 4 - Ne pas visser le tube à fond 5 - Incuber 24 heures à 37°C lecture Virage de l’indicateur de p. H au jaune dans tout le tube. Le milieu est devenu acide. Il y a eu production d’acides lors de l’utilisation du glucose par les bactéries en présence et en absence d’O 2. Les bactéries sont fermentatives vis-à-vis du glucose. Virage de l’indicateur de p. H au jaune dans la partie supérieure du tube. Le milieu est devenu acide. Il y a utilisation du glucose par les bactéries en présence d’ O 2. Les bactéries sont oxydatives vis-à-vis du glucose. Le milieu reste tel qu’il était avant ensemencement. Il n’y a pas de culture. Les bactéries sont inertes vis-à-vis du glucose

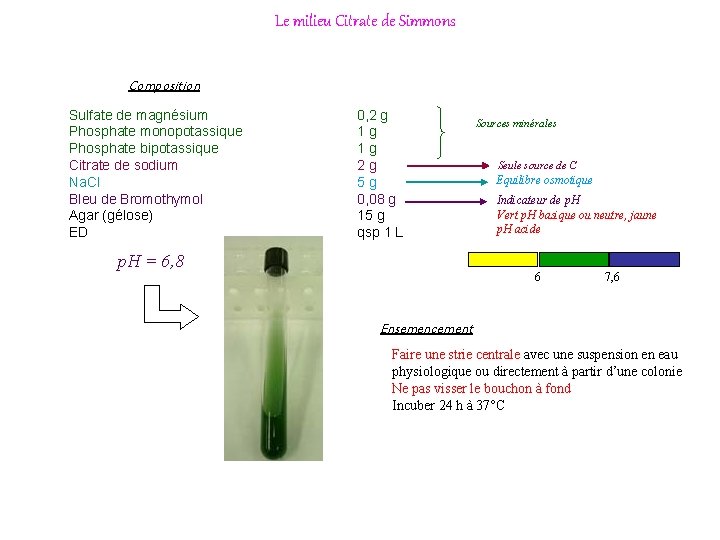
Le milieu Citrate de Simmons Composition Sulfate de magnésium Phosphate monopotassique Phosphate bipotassique Citrate de sodium Na. Cl Bleu de Bromothymol Agar (gélose) ED 0, 2 g 1 g 1 g 2 g 5 g 0, 08 g 15 g qsp 1 L p. H = 6, 8 Sources minérales Seule source de C Equilibre osmotique Indicateur de p. H Vert p. H basique ou neutre, jaune p. H acide 6 7, 6 Ensemencement Faire une strie centrale avec une suspension en eau physiologique ou directement à partir d’une colonie Ne pas visser le bouchon à fond Incuber 24 h à 37°C

Milieu de Clark et Lubs Composition Peptone trypsique ou polypeptone Glucose Phosphate bipotassique ED p. H = 7 5à 7 g 5 g 5 g qsp 1 L Sources minérales Source de C Source minérale Ensemencement Ensemencer avec 5 à 10 gouttes de suspension bactérienne. Ne pas visser le bouchon à fond Incuber 24 h à 37°C Test RM Après incubation, prélever 2 m. L du milieu et les déposer dans un tube à hémolyse. Ajouter 1 à 2 gouttes de rouge de méthyle. Observer. Test VP 4, 5 6, 8 Après incubation, prélever 1 m. L du milieu et les déposer dans un tube à hémolyse. Ajouter 0, 5 m. L d’ -naphtol et 0, 5 m. L de soude. Mélanger et incliner le tube. Faire la lecture après 10 à 15 min de contact.

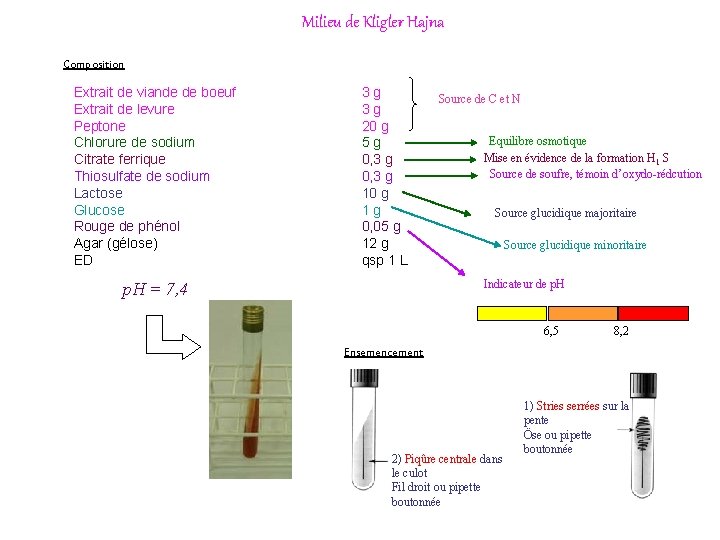
Milieu de Kligler Hajna Composition Extrait de viande de boeuf Extrait de levure Peptone Chlorure de sodium Citrate ferrique Thiosulfate de sodium Lactose Glucose Rouge de phénol Agar (gélose) ED 3 g 3 g 20 g 5 g 0, 3 g 10 g 1 g 0, 05 g 12 g qsp 1 L Source de C et N Equilibre osmotique Mise en évidence de la formation H 1 S Source de soufre, témoin d’oxydo-rédcution Source glucidique majoritaire Source glucidique minoritaire Indicateur de p. H = 7, 4 6, 5 8, 2 Ensemencement 2) Piqûre centrale dans le culot Fil droit ou pipette boutonnée 1) Stries serrées sur la pente Öse ou pipette boutonnée

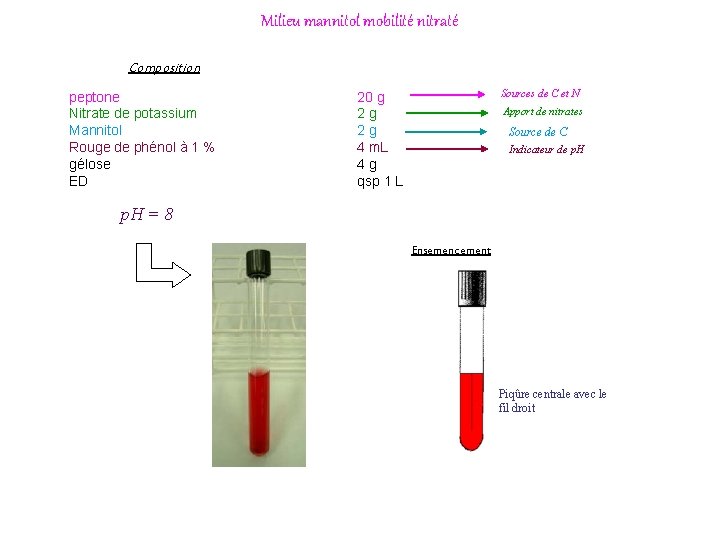
Milieu mannitol mobilité nitraté Composition peptone Nitrate de potassium Mannitol Rouge de phénol à 1 % gélose ED Sources de C et N 20 g 2 g 2 g 4 m. L 4 g qsp 1 L Apport de nitrates Source de C Indicateur de p. H = 8 Ensemencement Piqûre centrale avec le fil droit

Lecture des milieux Citrate de Simmons 1ère lecture possible 2 nde lecture possible Le milieu ne présente aucune culture. Les bactéries n’utilisent pas le citrate comme source de carbone : CITRATE - Le milieu présente une culture, l’indicateur de p. H a viré au bleu le milieu est devenu basique. Les bactéries ont utilisé le citrate comme source de carbone en produisant des composés alcalinisant le milieu: CITRATE +

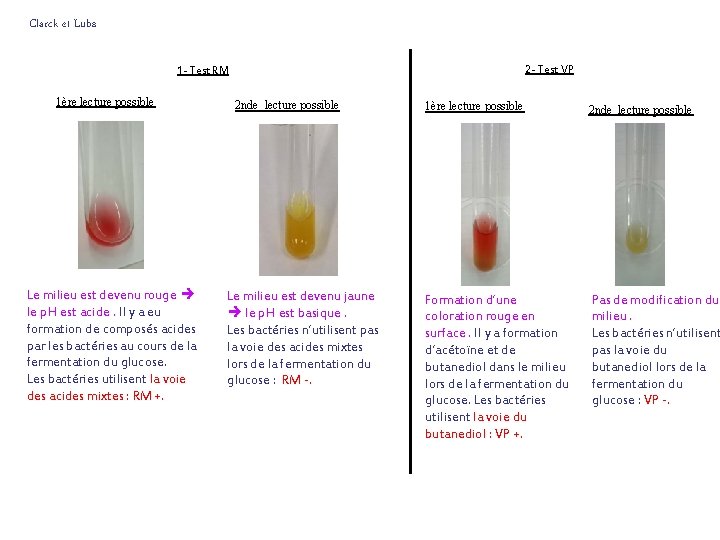
Clarck et Lubs 2 - Test VP 1 - Test RM 1ère lecture possible Le milieu est devenu rouge le p. H est acide. Il y a eu formation de composés acides par les bactéries au cours de la fermentation du glucose. Les bactéries utilisent la voie des acides mixtes : RM +. 2 nde lecture possible Le milieu est devenu jaune le p. H est basique. Les bactéries n’utilisent pas la voie des acides mixtes lors de la fermentation du glucose : RM -. 1ère lecture possible 2 nde lecture possible Formation d’une coloration rouge en surface. Il y a formation d’acétoïne et de butanediol dans le milieu lors de la fermentation du glucose. Les bactéries utilisent la voie du butanediol : VP +. Pas de modification du milieu. Les bactéries n’utilisent pas la voie du butanediol lors de la fermentation du glucose : VP -.

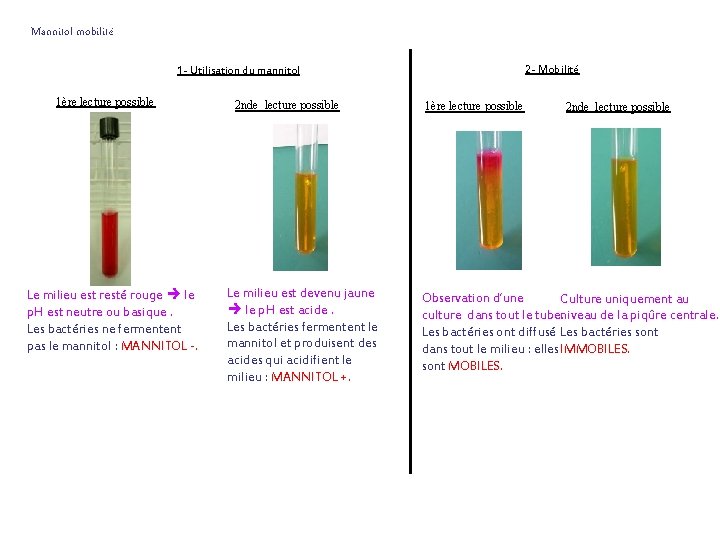
Mannitol mobilité 2 - Mobilité 1 - Utilisation du mannitol 1ère lecture possible Le milieu est resté rouge le p. H est neutre ou basique. Les bactéries ne fermentent pas le mannitol : MANNITOL -. 2 nde lecture possible Le milieu est devenu jaune le p. H est acide. Les bactéries fermentent le mannitol et produisent des acides qui acidifient le milieu : MANNITOL +. 1ère lecture possible 2 nde lecture possible Observation d’une Culture uniquement au culture dans tout le tube. niveau de la piqûre centrale. Les bactéries ont diffusé Les bactéries sont dans tout le milieu : elles IMMOBILES. sont MOBILES.

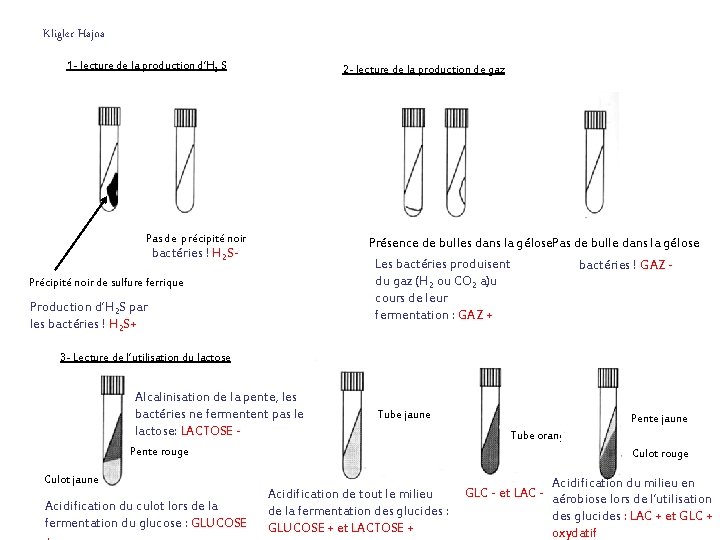
Kligler Hajna 1 - lecture de la production d’H 2 S Précipité noir de sulfure ferrique. Pas de précipité noir bactéries ! H 2 SProduction d’H S par 2 les bactéries ! H 2 S+ 2 - lecture de la production de gaz Présence de bulles dans la gélose Pas de bulle dans la gélose Les bactéries produisent bactéries ! GAZ du gaz (H 2 ou CO 2) au cours de leur fermentation : GAZ +

3 - Lecture de l’utilisation du lactose Acidification de tout le milieu lors de la fermentation des glucides : GLUCOSE + et LACTOSE + Alcalinisation de la pente, les bactéries ne fermentent pas le lactose: LACTOSE - Acidification du culot lors de la fermentation du glucose : GLUCOSE + Le milieu reste orangé. Les bactéries n’utilisent pas le glucose et le lactose. GLC - et LAC - Pente jaune Culot rouge Acidification du milieu en aérobiose lors de l’utilisation des glucides : LAC + et GLC + oxydatif

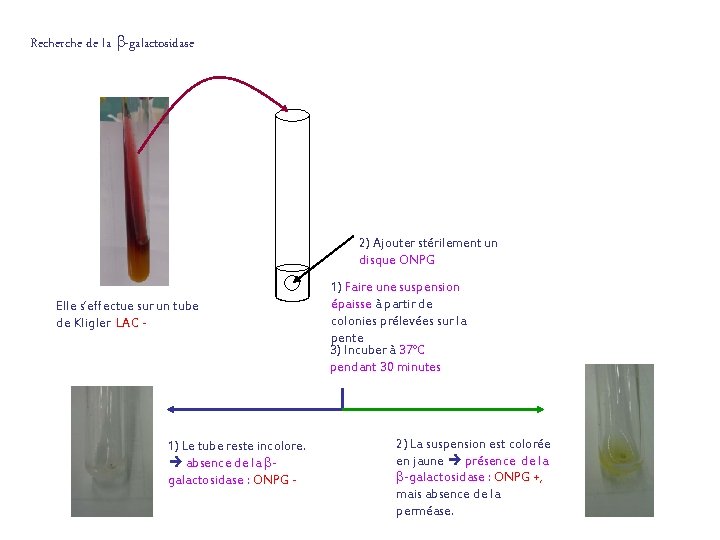
Recherche de la -galactosidase 2) Ajouter stérilement un disque ONPG Elle s’effectue sur un tube de Kligler LAC - 1) Le tube reste incolore. absence de la galactosidase : ONPG - 1) Faire une suspension épaisse à partir de colonies prélevées sur la pente 3) Incuber à 37°C pendant 30 minutes 2) La suspension est colorée en jaune présence de la -galactosidase : ONPG +, mais absence de la perméase.

Kligler Hajna 1 - lecture de la production d’H 2 S 2 - lecture de la production de gaz Pas de précipité noir Présence de bulles dans la gélose. Pas de bulle dans la gélose Les bactéries produisent bactéries ! GAZ du gaz (H 2 ou CO 2 a)u cours de leur fermentation : GAZ + bactéries ! H 2 S- Précipité noir de sulfure ferrique Production d’H 2 S par les bactéries ! H 2 S+ 3 - Lecture de l’utilisation du lactose Alcalinisation de la pente, les bactéries ne fermentent pas le lactose: LACTOSE Pente rouge Culot jaune Acidification du culot lors de la fermentation du glucose : GLUCOSE Tube jaune Pente jaune Tube orange Culot rouge Acidification du milieu en Acidification de tout le milieu lors GLC - et LAC - aérobiose lors de l’utilisation de la fermentation des glucides : LAC + et GLC + GLUCOSE + et LACTOSE + oxydatif