LE MALATTIE CROMOSOMICHE Il corredo cromosomico della specie






















































































- Slides: 89

LE MALATTIE CROMOSOMICHE

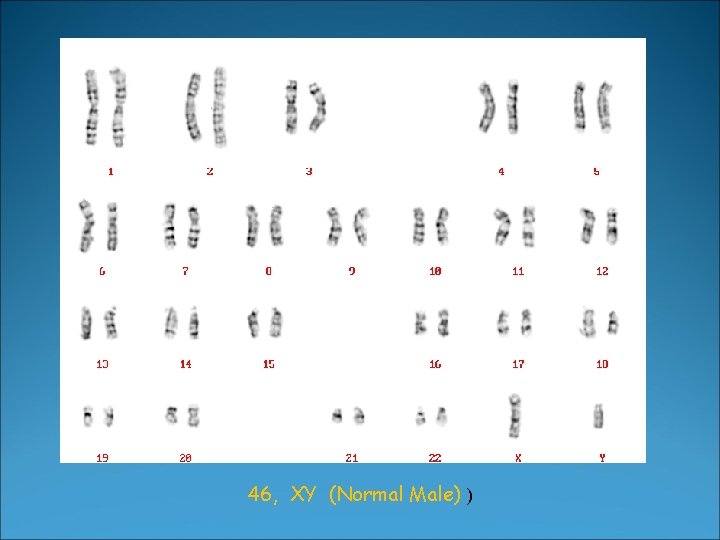
�Il corredo cromosomico della specie umana è costituito da 46 elementi, distribuiti in 22 coppie di autosomi e una coppia di cromosomi sessuali. �Il cariotipo normale per un soggetto di sesso femminile è 46, XX e per un soggetto di sesso maschile 46, XY

46, XY (Normal Male) )

46, XX (Normal Female)

Epidemiologia �Incidenza: 0, 9% dei nati vivi �Responsabili di almeno il 50% di aborti spontanei �Almeno il 10% di tutti i prodotti del concepimento dell’uomo ha un’alterazione cromosomica.

Classificazione delle alterazioni cromosomiche Numeriche trisomie monosomie triploidie tetraploidie Strutturali traslocazioni inversioni delezioni duplicazioni

�Cellula Aploide: cellula con 23 cromosomi �Cellula Euploide: cellula con un numero di cromosomi multiplo del numero aploide (46, 69, 92) �Cellula Diploide: cellula con 46 cromosomi �Cellula Poliploide: cellula con un numero di cromosomi multiplo di 23 ma superiore a 46

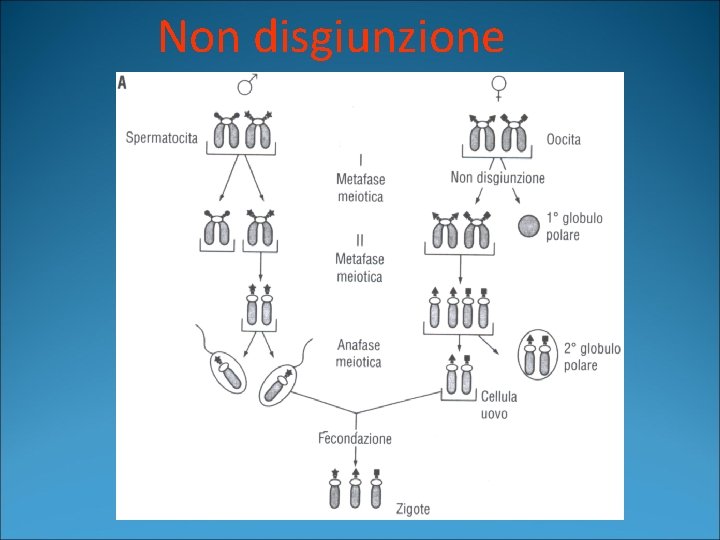
Non disgiunzione

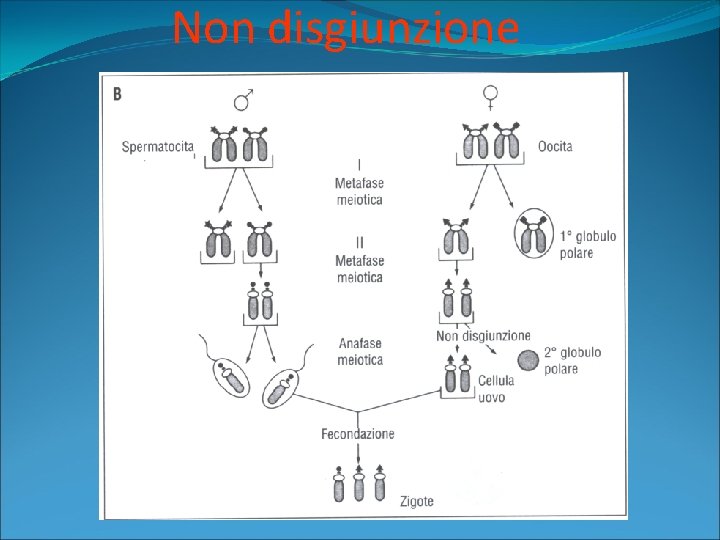
Non disgiunzione

Aberrazioni cromosomiche numeriche �Trisomia: presenza di un cromosoma in più a carico di una coppia �Monosomia: mancanza di un intero cromosoma Normalmente, nella fase precedente la meiosi avviene una congiunzione fra i due cromosomi omologhi, cui fa seguito la separazione, dopo la quale ogni cromosoma si localizza ai due diversi poli della cellula in divisione meiotica.

Aberrazioni cromosomiche numeriche �La mancata separazione porta a una NON DISGIUNZIONE di una coppia di cromosomi, per cui si avrà una cellula con 24 cromosomi e una cellula con 22. �L’unione di una cellula con 24 cromosomi con un gamete normale con 23 cromosomi porta a una cellula trisomica con 47 cromosomi �L’unione di una cellula con 22 cromosomi con un gamete normale con 23 cromosomi porta ad una cellula con MONOSOMIA (45 cromosomi).

Aberrazioni cromosomiche numeriche �Quando la non disgiunzione avviene nella cellula in mitosi si determina il MOSAICISMO, cioè la presenza nello stesso individuo di cellule con corredo cromosomico diverso �Gli errori cromosomici da non disgiunzione, e quindi la probabilità di trisomia, sono tanto più frequenti quanto maggiore è l’età della madre.

Aberrazioni cromosomiche strutturali � Si tratta di alterazioni in cui il numero di cromosomi è normale (46), ma sono presenti rotture o riarrangiamenti: �DELEZIONE �DUPLICAZIONE �INVERSIONE �ISOICROMOSOMA �CROMOSOMA AD ANELLO �TRASLOCAZIONE

Aberrazioni cromosomiche strutturali �DELEZIONE PERDITA DI MATERIALE IN UN CROMOSOMA 1. DELEZIONE TERMINALE: la regione mancante riguarda il telomero 2. DELEZIONE INTERSTIZIALE: la regione mancante riguarda la regione prossimale al centromero del braccio corto o del braccio lungo

Aberrazioni cromosomiche strutturali �DUPLICAZIONE PRESENZA IN DUPLICE COPIA DI UN TRATTO CROMOSOMICO La regione duplicata può essere con lo stesso orientamento del tratto originale oppure inserita con orientamento opposto.

Aberrazioni cromosomiche strutturali �INVERSIONE DUPLICE ROTTURA LUNGO L’ASSE DEL CROMOSOMA CON ROTAZIONE DI 180 GRADI DEL TRATTO INTERESSATO E REINSERIMENTO DI QUESTO NEI DUE PUNTI DI ROTTURA

Aberrazioni cromosomiche strutturali 1. INVERSIONE PERICENTRICA: il tratto interessato comprende il centromero 2. INVERSIONE PARACENTRICA: i punti di rottura si trovano entrambi sullo stesso braccio cromosomico Le inversioni, non comportando generalmente perdita di materiale cromosomico, non danno luogo a effetti fenotipici, che possono però presentarsi quando l’inversione determina un effetto di posizione, una microdelezione o l’interruzione della sequenza informativa

Aberrazioni cromosomiche strutturali �ISOCROMOSOMA Si origina da un’anomala divisione del centromero che avviene lungo l’asse trasversale anziché lungo l’asse longitudinale, dando origine a uno o due cromosomi costituiti da due copie delle braccia lunghe o delle braccia corte del cromosoma di origine. Questa aberrazione comporta una monosomia di tutti i geni localizzati sul braccio deleto e una trisomia di quelli che hanno sede sul braccio presente in due copie

Aberrazioni cromosomiche strutturali �CROMOSOMA AD ANELLO Si verifica quando si ha la perdita delle due regioni terminali e la chiusura ad anello della regione intermedia. L’effetto fenotipico è legato all’entità delle informazioni perdute, a causa delle due delezioni.

Aberrazioni cromosomiche strutturali �TRASLOCAZIONE E’ una delle più frequenti aberrazioni cromosomiche, soprattutto a carico dei cromosomi acrocentrici: essa è dovuta allo scambio di materiale tra due o più cromosomi

Aberrazioni cromosomiche strutturali �TRASLOCAZIONE 1. TRASLOCAZIONI RECIPROCHE: quando avviene uno scambio di segmenti fra due cromosomi non omologhi 2. TRASLOCAZIONE ROBERTSONIANA: si verifica nel caso di cromosomi acrocentrici in cui la fusione si verifica a livello centromerico

Aberrazioni cromosomiche strutturali �TRASLOCAZIONE Nelle traslocazioni in genere la rottura avviene in corrispondenza dei siti fragili, vicino al centromero o nei punti di connessione tra eucromatina (porzione geneticamente attiva del genoma) ed eterocromatina (cromatina priva di capacità informativa).

Aberrazioni cromosomiche strutturali �TRASLOCAZIONE Anche le traslocazioni, come le inversioni, non comportano perdita di materiale genetico informativo e quindi non hanno alcun effetto fenotipico, a eccezione di quei casi in cui si verifica una microdelezione, un effetto di posizione o l’interruzione di una sequenza informativa. I problemi possono sorgere unicamente a livello riproduttivo, in quanto nella prole si possono originare gameti sbilanciati

Aberrazioni cromosomiche strutturali �TRASLOCAZIONE Nella TRASLOCAZIONE BILANCIATA i soggetti sono fenotipicamente normali, ma eterozigoti per un’alterazione strutturale, che può interferire con la capacità riproduttiva. La loro frequenza nella popolazione è molto elevata (circa 1/200 soggetti, cioè uno dei genitori su 100 coppie. La probabilità di avere un feto affetto dipende dal tipo di traslocazione e dal sesso del genitore che ne è portatore: l’incidenza può variare nei figli dall’ 1 al 30%

Fratture cromatidiche, cromosomiche e “gap” �Nella maggior parte dei casi le FRATTURE CROMOSOMICHE che si verificano nei vari periodi della divisione cellulare sono riparate spontaneamente, con enzimi specifici, senza che si verifichi alcuna anomalia. Quando è interessato un solo cromatide si parla di fratture cromatidiche, mentre quando sono coinvolti ambedue i cromatidi nello stesso punto si parla di fratture cromosomiche. Queste ultime comportano la separazione di un tratto di cromosoma.

Fratture cromatidiche, cromosomiche e “gap” �Per GAP si intende invece l’attenuazione della colorazione di un tratto di cromosoma, che appare discontinuo, anche se mantiene la normale posizione in asse: le alterazioni fenotipiche sono dovute a un’alterazione della struttura del DNA, in corrispondenza del gap. Le due regioni adiacenti sono funzionalmente separate, anche se in effetti sono unite da una sottile, alterata struttura di DNA.

Fratture cromatidiche, cromosomiche e “gap” �L’interesse clinico delle fratture e dei gap sta nel fatto che possono in tal modo perdersi regioni cromosomiche essenziali. Inoltre i cromosomi fratturati hanno la tendenza a unirsi rapidamente con altri, dando origine a traslocazioni, isocromosomi e cromosomi ad anello.

Siti fragili �Si tratta di punti specifici, a livello cromosomiale, che presentano le seguenti caratteristiche: 1. Vengono ereditati secondo il modello mendeliano; 2. Si riscontrano sempre a carico del medesimo cromosoma, in corrispondenza della stessa banda; 3. Appaiono come un gap scarsamente colorato, di misura variabile, che generalmente interessa entrambi i cromatidi.

Incidenza delle alterazioni cromosomiche fra i nati vivi 1. 2. 3. 4. 5. 6. 7. Trisomia 21 Trisomia 13 Trisomia 18 S. di Turner S. di Klinefelter X fragile: maschi X fragile: femmine 1/750 1/6. 000 1/8. 000 1/2. 000 1/500 1/2. 000 1/1. 000 8. Riarrangiamenti strutt. bilanciati 1/850

Sindrome di Down �La più comune aberrazione cromosomica e la più frequente forma di ritardo mentale della specie umana. �Incidenza: 1/750 nati vivi �La frequenza aumenta con l’aumentare dell’età della madre: (da 1/2. 500 nei nati da madri < 20 anni a 1/50 -100 nei nati da madri > 40 anni)

�CAUSE: Sindrome di Down �Nel 95% dei casi è dovuta a una non-disgiunzione cromosomica di un cromosoma 21 durante la gametogenesi (meiosi) che è quasi sempre quella materna �Nel 4% dei casi è legata ad una traslocazione robertsoniana del cromosoma 21, che viene ad attaccarsi ad un altro cromosoma acrocentrico, per cui la conta totale dei cromosomi di questi pazienti è di 46, ma la massa cromatinica del cromosoma 21 è rappresentata per 3 volte. Spesso si verifica de novo ma può anche essere trasmessa da uno dei genitori nel quale è presente una traslocazione bilanciata.

Sindrome di Down �Infine, l’ 1% circa dei pazienti ha un mosaicismo cromosomico per nondisgiunzione mitotica post-zigotica, con la presenza, quindi, di una linea cellulare a cariotipo normale e una con trisomia 21. �Questi ultimi pazienti possono manifestare un quadro clinico con segni più sfumati. �Il rischio di ricorrenza per una coppia che abbia già avuto un figlio affetto è solo dell’ 1% e tale percentuale aumenta in caso di traslocazione bilanciata in uno dei due genitori.

Sindrome di Down �CLINICA: 1. Occhi piccoli con piccole macchie grigiastre lungo la zona mediana dell’iride (MACCHIE DI BRUSHFIELD) 2. Fessure palpebrali obblique dal basso verso l’alto e dall’interno verso l’esterno 3. Epicanto (terza palpebra) 4. Strabismo (spesso)

Sindrome di Down �CLINICA: 5. Volto piccolo, rotondeggiante con profilo piatto 6. Naso piccolo, con radice piatta e rivolto verso l’alto 7. Brachicefalia 8. Microcrania 9. Occipite piatto 10. Bocca piccola e lingua prominente

Sindrome di Down �CLINICA: 11. Palato duro, alto e stretto 12. La lingua spesso mostra solchi trasversali (LINGUA SCROTALE) 13. Orecchie piccole, rotonde, a basso impianto, con lobulo piccolo e spesso aderente 14. Collo corto e tozzo 15. Pelle del collo spesso sovrabbondante

Sindrome di Down �CLINICA: 16. Mimica facciale caratteristica: movimenti non coordinati dei muscoli del volto, protrusione della lingua e movimenti veloci senza alcuno scopo 17. Alla nascita peso e lunghezza inferiori alla media e bassa statura nelle età successive

Sindrome di Down �CLINICA: 18. Alla nascita nell’ 80% dei casi ipotonia marcata con notevole lassità ligamentosa, caratteristiche si attenuano col tempo e talora scompaiono 19. Addome disteso e spesso diastasi dei muscoli retti ed ernia ombelicale 20. Mani larghe e corte, con metacarpi e falangi di minor lunghezza 21. Clinodattilia del quinto dito

Sindrome di Down �CLINICA: 22. Solco palmare unico, mono- o bilaterale 23. Triradio assiale in posizione distale 24. Plica unica di flessione al quinto dito 25. Eccesso di anse ulnari sui polpastrelli delle dita 26. Nel 40% dei casi malformazione cardiaca (canale atrio-ventricolare, comunicazione interventricolare e interatriale, persistenza del sotto arterioso

Sindrome di Down � CLINICA: 27. Frequenti anche le malformazioni a carico dell’intestino (atresia intestinale, ano imperforato, megacolon congenito) Il ritardo mentale è costante ed è tanto più evidente quanto maggiore è l’età. Nonostante ciò, l’affettività e la capacità di socializzazione sono mantenute, per cui questi bambini si inseriscono bene nella famiglia

Sindrome di Down � CLINICA: Durante lo sviluppo si rende evidente un deficit staturale, oltre che dello sviluppo psicomotorio, la cute diviene anelastica, i capelli secchi e fragili I maschi sono sterili nella maggioranza dei casi, mentre le femmine hanno le mestruazioni e possono raramente essere fertili

Sindrome di Down � CLINICA: I bambini con S. di Down contraggono di frequente le comuni malattie infettive delle vie aeree superiori. La letalità dei primi anni di vita è elevata. Può intervenire un difetto dell’immunità cellulo-mediata ed è più elevata l’incidenza di patologia autoimmune (diabete, tiroidite, celiachia, alopecia) e di leucemia (LLA e LMA).

Sindrome di Down �Il riconoscimento della sindrome non è tanto legato alla presenza di uno dei segni sopra riportati, ma alla presenza della combinazione, diversa da caso, di molti di essi. �Presi singolarmente, infatti, i diversi segni si riscontrano anche nella popolazione generale

Sindrome di Down �L’indagine citogenetica è l’unico esame che permette di porre una diagnosi di certezza. Viene eseguita dopo la nascita su una coltura di linfociti del sangue periferico o in epoca prenatale, nel primo o nel secondo trimestre di gravidanza, su colture di cellule derivate dai villi coriali o dal liquido amniotico. Un’amniocentesi è infatti indicata nelle donne in stato di gravidanza di età superiore ai 35 anni.

Sindrome di Down �La sopravvivenza media è assai migliorata negli ultimi decenni e oltrepassa i 50 anni �Nel soggetto Down in età adulta è documentato un maggior rischio di malattia di Alzheimer �Non esiste alcun trattamento farmacologico specifico

Sindrome di Down �FOLLOW-UP: Il follow-up della S. di Down prevede una serie di valutazioni longitudinali tese al periodico bilancio di salute dei bambini e alla diagnosi precoce della patologia associata

Sindrome di Edwards (Trisomia 18) �Aneuploidia cromosomica �Prevalenza alla nascita: 1/8. 000 nati vivi �Più spesso si ha una trisomia libera del cromosoma 18, talvolta in mosaico o da traslocazione e può anche associarsi ad altre aneuploidie �Il 90% dei feti affetti viene abortito spontaneamente �Alla nascita il sesso femminile appare più colpito, per una possibile maggiore incidenza di aborti spontanei tra i maschi affetti

Sindrome di Edwards (Trisomia 18) �CLINICA: 1. Basso peso alla nascita 2. Cranio dolicocefalico con occipite prominente 3. Orecchie malformate (DA FAUNO) e a impianto basso 4. Ipoplasia della mandibola 5. Mani flesse con indice sovrapposto al medio (A UNCINO) 6. Solco palmare unico 7. Piedi in equino-varismo con tallone prominente

Sindrome di Edwards (Trisomia 18) �CLINICA: Frequenti sono le malformazioni cardiache, delle vie urinarie e dell’apparato digerente Un segno malformativo evidente in epoca prenatale quale l’onfalocele può costituire un marcatore precoce della trisomia 18 e rende opportuno lo studio del cariotipo fetale Il 30% dei pazienti muore entro il primo mese di vita per le gravi malformazioni viscerali e solo il 10% sopravvive oltre l’età di un anno con un severo ritardo dello sviluppo psicomotorio

Sindrome di Patau (Trisomia 13) �Aneuploidia cromosomica �Prevalenza alla nascita: 1/10. 000 nati vivi �Più spesso dovuta ad una trisomia libera del cromosoma 13, talvolta a traslocazione o più raramente a mosaicismo

Sindrome di Patau (Trisomia 13) �CLINICA: 1. Basso peso alla nascita 2. Cranio piccolo trigonocefalico (per deficiente sviluppo delle bozze frontali) 3. Aree di aplasia cutanea sul cuoio capelluto 4. Labiopalatoschisi 5. Microftalmia 6. Ipotelorismo di grado variabile fino alla ciclopia

Sindrome di Patau (Trisomia 13) �CLINICA: 7. Polidattilia e/o sindattilia postassiale 8. Atteggiamento in flessione forzata delle dita della mano 9. Solco palmare unico 10. Convessità della pianta del piede 11. Criptorchidismo nei maschi

Sindrome di Patau (Trisomia 13) �Sono spesso presenti malformazioni viscerali (specie cardiache e renali) �La sindrome è generalmente fatale entro il primo anno di vita e si rende responsabile di un grave deficit di sviluppo per coloro che sopravvivono oltre il primo anno

Sindrome di Cri du Chat, 5 p�È dovuta ad una delezione di entità variabile del braccio corto del cromosoma 5. �In genere è un evento sporadico “de novo” �Nel 15% circa dei casi si riscontra una traslocazione bilanciata in uno dei due genitori

Sindrome di Cri du Chat, 5 p�Il nome della sindrome deriva dal caratteristico pianto dei neonati affetti, somigliante al miagolio di un gatto, causato dalla ipoplasia delle cartilagini del laringe, che però scompare con il passare dei mesi

Sindrome di Cri du Chat, 5 p�Le principali note fenotipiche sono: 1. Microcefalia 2. Facies rotondeggiante “a luna piena” 3. Ipertelorismo 4. Epicanto 5. Radice nasale larga e piatta 6. Micrognazia

Sindrome di Cri du Chat, 5 p� Alla nascita è presente ipotonia muscolare generalizzata. Nel corso dello sviluppo compare un ipertono localizzato agli arti, il viso si allunga evidenziando così maggiormente la micrognazia, e si rende evidente un ritardo mentale profondo. � In assenza di malformazioni viscerali associate, la sopravvivenza è piuttosto lunga.

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) � La sindrome deve il suo nome attuale alla fragilità della regione terminale del braccio lungo del cromosoma X ed è oggi inquadrata nel contesto delle sindromi da mutazioni dinamiche

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) � Essa è infatti dovuta ad un’abnorme amplificazione delle triplette CGG del gene denominato FMR-1, localizzato nella regione Xq 27. 3 � In condizioni normali il numero di queste triplette varia tra 6 e 50 con una media di 30

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) � Un numero tra 50 e 200 identifica i soggetti con premutazione � Un numero superiore a 200 si riscontra nei soggetti affetti � La transizione dallo stato di premutazione a quello di mutazione è possibile solo nell’ambito della meiosi femminile in seguito ad un meccanismo di imprinting materno

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) � L’amplificazione abnorme induce una ipermetilazione del gene che è responsabile della sua mancata trascrizione e ne condiziona anche la fragilità e la tendenza alla frattura cromatidica

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) � Il gene FMR-1 codifica per una proteina di circa 70 k. Da espressa ubiquitariamente nelle cellule dei soggetti normali (prevalentemente neuroni e spermatogoni) e non in quella dei soggetti affetti, che sembra agire come fattore di regolazione dei processi di trascrizione del DNA

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) � CLINICA: 1. Alta statura 2. Macrocefalia con tendenza alla dolicocefalia 3. Facies allungata con mento prominente 4. Ipotelorismo 5. Padiglioni auricolari ampi e sporgenti 6. Palato ogivale 7. Iperlassità articolare

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) � CLINICA: 8. Prolasso della valvola mitrale 9. Ipercheratosi palmo-plantare 10. Macroorchidismo con esordio puberale 11. Ipotonia muscolare 12. Ritardo mentale 13. Turbe comportamentali 14. Tratti autistici

Sindrome del cromosoma X-Fragile (Sindrome di Martin-Bell) I soggetti eterozigoti di sesso femminile possono presentare alcuni elementi della sindrome, di solito con minore espressività clinica La diagnosi clinica deve essere confermata dall’analisi del DNA che consente di identificare i soggetti con mutazioni e premutazioni anche in ambito di diagnosi prenatale

Sindrome di Turner � È la più frequente disgenesia gonadica a espressione fenotipica femminile � È associata ad una monosomia funzionale del braccio corto del cromosoma X � Incidenza 1/2. 000 soggetti di sesso femminile nati vivi � È presente nell’ 1, 5% dei prodotti del concepimento, ma nel 95% dei casi si verifica un aborto spontaneo, per cui la S. di Turner è responsabile del 5 -10 % di tutti gli aborti spontanei

Sindrome di Turner � Nel 50% dei casi è dovuta ad una monosomia del cromosoma X (45, X 0) e nel 60% dei casi manca quello di origine paterna � In circa il 30% dei casi si tratta di un mosaicismo (45 X 0/46 XX o 45 X 0/47 XXX o, più di rado, 45 X 0/46 XY) � Altri mosaicismi sono rappresentati da un isocromosoma o da un cromosoma ad anello

Sindrome di Turner � Alcuni soggetti con S. di Turner, pur avendo due cromosomi X, mostrano una mancanza parziale di uno dei due � Quando manca il braccio corto (p) non è colpita la funzione ovarica, mentre è presente la bassa statura (gene SHOX) � Se, invece, è presente una delezione del braccio lungo (q) di uno dei due cromosomi X, nella banda q 13 -q 27, si manifesta un mancato sviluppo ovarico

Sindrome di Turner � CLINICA: 1. Ipostaturalismo Principalmente legato all’insufficienza del gene PHOG/SHOX, sito nella regione pseudoautosomale del braccio corto dei cromosomi X ed Y Alla nascita le bambine mostrano un peso inferiore alla media e un deficit di crescita staturale. La velocità di crescita può essere normale nelle prime fasi della vita, per poi ridursi drasticamente verso i 6 -8 anni. L’altezza finale risulta in media attorno a 142 -143 cm e sempre inferiore a 150 cm

Sindrome di Turner � CLINICA: 2. Amenorrea primaria 3. Assente sviluppo dei caratteri sessuali secondari e infantilismo sessuale alla pubertà 4. Gonadi rudimentali sotto forma di banderelle fibrose in assenza, sin dalla nascita, di cellule germinali e di produzione di ormoni steroidei 5. Collo corto e palmato (PTERIGIO) 6. Impianto basso delle orecchie

Sindrome di Turner � CLINICA: 7. Alterazioni dentarie 8. Gomito valgo 9. Linfedema delle mani e dei piedi In epoca neonatale può costituire l’unico elemento per cui sospettare una S. di Turner e regredisce spontaneamente nel tempo. È dovuto allo scarso sviluppo delle vie linfatiche durante tutta la vita fetale.

Sindrome di Turner � CLINICA: 10. Possibili malformazioni vascolari viscerali: a) Stenosi aortica b) Coartazione aortica c) Rene ptosico d) Rene a ferro di cavallo 11. Nevi pigmentati 12. Tendenza alla formazione di cheloidi e

Sindrome di Turner � CLINICA: 13. Alterazioni scheletriche a) Maturazione scheletrica normale o modestamente ritardata nell’infanzia e deficitaria nell’adolescenza (deficit di steroidi). b) scoliosi 14. Capezzoli allontanati dalla linea mediana, invertiti

Sindrome di Turner � CLINICA: 15. Otite media bilaterale ricorrente nel 75% dei casi (per tale motivo sono frequenti i disturbi neurosensoriali a carico dell’udito) 16. Displasia delle unghie (unghie iperconvesse) 17. Alterazioni degli occhi (strabismo, ambliopia) 18. Ritardo mentale nell’ 11 -17% dei casi

Sindrome di Turner Poiché i soggetti con S. di Turner hanno un solo cromosoma X, pur avendo un fenotipo femminile, presentano la stessa probabilità dei maschi di essere affetti da malattie legate al sesso, come l’Emofilia A e B o la Distrofia muscolare di Duchenne

Sindrome di Turner DIAGNOSI: � Molti anni fa la diagnosi, in una bambina con bassa statura, veniva posta tardivamente � Oggi sempre più spesso la diagnosi viene posta alla nascita, per la presenza di edema notevole a carico delle mani e dei piedi

Sindrome di Turner DIAGNOSI: � Esami di laboratorio: a) elevati livelli di gonadotropine (FSH ed LH) b) Estrogeni bassi o indosabili � All’ecografia pelvica le ovaie appaiono come benderelle fibrose � Rx mano: età ossea ritardata � La diagnosi di conferma si basa sull’ANALISI CROMOSOMICA

Sindrome di Turner TERAPIA: Comprende inizialmente la terapia della bassa statura e successivamente, a partire dal 12°-13° anno di età, la terapia dell’ipogonadismo

Sindrome di Turner TERAPIA DELLA BASSA STATURA: - Ormone somatotropo ricombinante umano (h. Gh) per via s. c. alla dose di 0, 045 – 0, 050 mg/Kg/die Il trattamento va iniziato precocemente, prima che la statura scenda al di sotto del 3°-10° centile, in genere intorno a 25 anni. Va continuato sino a quando l’incremento dell’altezza tende ad attenuarsi (<2 cm/anno) e/o l’età ossea è > 15 anni

Sindrome di Turner TERAPIA DELL’IPOGONADISMO: Stimola l’induzione dei caratteri sessuali secondari e la comparsa delle mestruazioni, ma non può ovviare alla sterilità. Non va iniziata prima del 12° -13° anno di età al fine di evitare l’effetto negativo sull’accrescimento causato dalla saldatura delle cartilagini epifisarie.

Sindrome di Turner TERAPIA DELL’IPOGONADISMO: Il trattamento sarà sostitutivo estroprogestinico: - Etinilestradiolo: 5 mcg/die per os - Estradiolo transdermico: 25 mcg/2 volte a settimana

Sindrome di Turner TERAPIA DELL’IPOGONADISMO: Dopo l’induzione della pubertà, cioè 6 -12 mesi dopo l’inizio della somministrazione, si passa alla terapia ciclica con : - Etinilestradiolo: 10 -20 mcg/die dal 1° al 21° giorno - Medrossiprogesterone: 10 mg/die dal 12° al 21° giorno - Sospensione del trattamento per 1 settimana

Sindrome di Klinefelter � È una delle cause più frequenti di ipogonadismo primario e di infertilità nel maschio � Relativamente frequente: 1 caso/500 maschi nati vivi � L’analisi cromosomica mostra un cariotipo caratteristico con 47 XXY (nell’ 80% dei casi) derivante dalla combinazione di un gamete femminile con doppio cromosoma sessuale, per mancata disgiunzione alla meiosi e di un gamete maschile normale.

Sindrome di Klinefelter � In un numero inferiore di casi si riscontra un mosaicismo (47 XXY/46 XY oppure 47 XXY/46 XX) o una delle seguenti varianti: 48 XXXY, 48 XXYY e 49 XXXXY � La compromissione dello sviluppo e mentale aumenta con l’aumentare del numero degli extra X: ogni extra X riduce il QI di 15 -16 punti

Sindrome di Klinefelter � La malattia si associa ad un’età materna avanzata � L’esame microscopico dei testicoli mostra ialinizzazione e atrofia dei tubuli seminiferi, con scomparsa dell’epitelio germinale ed iperplasia delle cellule interstiziali.

Sindrome di Klinefelter � CLINICA: 1. Fenotipo maschile, con caratteri eunucoidi: alta statura e alto rapporto arti/tronco (gli androgeni stimolano la saldatura cartilaginea che, pertanto, avviene in ritardo) 2. Spesso ritardo psichico 3. Ginecomastia nell’ 80% dei casi

Sindrome di Klinefelter � CLINICA: 4. Scarso sviluppo dei caratteri sessuali secondari: peluria scarsa, pene piccolo e testicoli duri e di dimensioni ridotte (5 -6 mm) 5. Potenza sessuale e libido spesso diminuite 6. Distribuzione dell’adipe di tipo femminile 7. Sono riscontrabili, inoltre, alterazioni ossee, alterazioni cutanee, solco palmare unico, prolasso della mitrale, taurodontismo e intolleranza al glucosio che spesso sfocia in un franco diabete mellito

Sindrome di Klinefelter � CLINICA: Nei casi di mosaicismo si riscontrano quadri monosintomatici Nell’infanzia gli aspetti più spesso presenti sono: - Ritardo nell’acquisizione del linguaggio - Difficoltà di apprendimento e scolastiche - Rapida crescita nella 3ª infanzia e, a volte, obesità del tronco - Problemi comportamentali - Ritardo puberale

Sindrome di Klinefelter Esami di laboratorio: 1. Alla pubertà i livelli di FSH ed LH sono particolarmente elevati (soprattutto l’FSH con aumentata responsività al Gn. RH 2. Aumento dell’SHBG 3. Testosterone basso o ai limiti inferiori della norma 4. Aumento degli estrogeni circolanti La diagnosi di certezza richiede l’esame del cariotipo

Sindrome di Klinefelter TERAPIA: La terapia è sostitutiva e va iniziata alla pubertà, mimando la maturazione normale. Si somministra: - Testosterone enantato: una iniezione i. m. ogni 4 settimane, partendo da 50 mg e aumentando gradualmente la dose ogni 6 mesi, fino ad una posologia adulta di 200 mg ogni 2 -3 settimane. La terapia sostitutiva di mantenimento può essere espletata anche per via transdermica La ginecomastia va corretta chirurgicamente
 Charles darwin origine della specie
Charles darwin origine della specie Charles darwin origine della specie
Charles darwin origine della specie Cartine rivelatrici
Cartine rivelatrici Macchia mediterranea bioma
Macchia mediterranea bioma Basmul este o specie a genului epic
Basmul este o specie a genului epic Specie pesci favignana
Specie pesci favignana Regole di riempimento degli orbitali
Regole di riempimento degli orbitali Cv voltammetry
Cv voltammetry Dominio regno phylum classe ordine famiglia genere specie
Dominio regno phylum classe ordine famiglia genere specie Piante mellifere
Piante mellifere Genul epic specii
Genul epic specii Elettrodo di terza specie
Elettrodo di terza specie Biodiversità
Biodiversità Malattie croniche
Malattie croniche Cromatidio
Cromatidio Malattie
Malattie Malattie multifattoriali esempi
Malattie multifattoriali esempi Kousmine malattie autoimmuni
Kousmine malattie autoimmuni Malattie dismielinizzanti
Malattie dismielinizzanti Malattie epifitiche
Malattie epifitiche Malattie cardiovascolari
Malattie cardiovascolari Malattie croniche
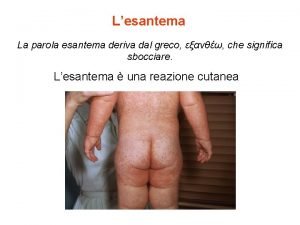
Malattie croniche Esantema roseoliforme
Esantema roseoliforme Malattie epifitiche
Malattie epifitiche Fioretta del vino
Fioretta del vino Serie di bowen
Serie di bowen Culture e formati della televisione e della radio
Culture e formati della televisione e della radio Fasi della lavorazione della seta
Fasi della lavorazione della seta Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni La coccinella alla ricerca della felicità
La coccinella alla ricerca della felicità Umberto saba
Umberto saba Elena bettinelli
Elena bettinelli Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Prove della sfericità della terra
Prove della sfericità della terra Il racconto delle scienze naturali soluzioni
Il racconto delle scienze naturali soluzioni Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Prove sulla sfericità della terra
Prove sulla sfericità della terra Moti millenari della terra zanichelli
Moti millenari della terra zanichelli I tre principi dell'io di fichte
I tre principi dell'io di fichte Disturbo oppositivo provocatorio sostegno
Disturbo oppositivo provocatorio sostegno Pei disturbo misto della condotta e della sfera emozionale
Pei disturbo misto della condotta e della sfera emozionale Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali I mari della spagna
I mari della spagna Statica delle strutture
Statica delle strutture Piedi poesia satirica greca e latina
Piedi poesia satirica greca e latina Regole della comunicazione
Regole della comunicazione Dormitio virginis gerusalemme
Dormitio virginis gerusalemme Massimo della gamma
Massimo della gamma Nervi
Nervi Cipì il signore della notte
Cipì il signore della notte Ufficio dell'aiuto e della protezione
Ufficio dell'aiuto e della protezione Leggi di keplero
Leggi di keplero Evoluzione della misurazione del tempo
Evoluzione della misurazione del tempo Soglia differenziale esempio
Soglia differenziale esempio Idoli della spelonca
Idoli della spelonca Chi é
Chi é Scomposizione varianza
Scomposizione varianza Ln derivata
Ln derivata La nascita della letteratura italiana
La nascita della letteratura italiana Proprietà macroscopiche della materia
Proprietà macroscopiche della materia Symbolism theatre
Symbolism theatre Codici del linguaggio logico matematico
Codici del linguaggio logico matematico Schema narrativo
Schema narrativo Lo storico è come l'orco della fiaba
Lo storico è come l'orco della fiaba Periodo sin^2 x
Periodo sin^2 x Entropia zanichelli
Entropia zanichelli Fasi della globalizzazione
Fasi della globalizzazione Le molecole della vita
Le molecole della vita Cartina fisica della campania
Cartina fisica della campania Massimo della gamma
Massimo della gamma Where is michelangelo buried
Where is michelangelo buried Saccadizzazione
Saccadizzazione 3 nomi derivati di mare
3 nomi derivati di mare I sei libri della repubblica
I sei libri della repubblica 4 assioma della comunicazione
4 assioma della comunicazione Nirvana europe tour
Nirvana europe tour Sfere zemlje
Sfere zemlje Schedarionline
Schedarionline Produzione della pasta per carta cellulosa
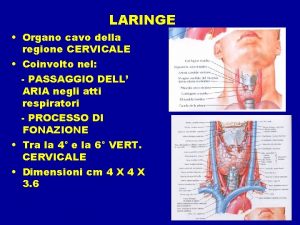
Produzione della pasta per carta cellulosa Membrane elastiche laringe
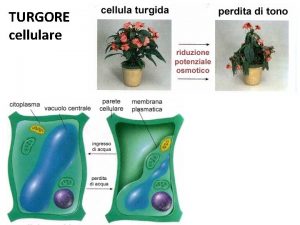
Membrane elastiche laringe Turgore cellula
Turgore cellula Trasformazione eutettoidica
Trasformazione eutettoidica Teoria della dominanza sociale
Teoria della dominanza sociale Guida allo studio della storia 4
Guida allo studio della storia 4 Es est percipi
Es est percipi Umidometro
Umidometro Dimenticare quanto fui felice commento
Dimenticare quanto fui felice commento Modelli di gestione della classe glasser
Modelli di gestione della classe glasser Tabella pressione arteriosa in base all'età
Tabella pressione arteriosa in base all'età La favolosa storia della radice quadrata di due
La favolosa storia della radice quadrata di due