Le chimiste amricain L PAULING a calcul llectrongativit











![[H 3 O+] [OH-]= (55. 4)2 Keq=Kw= 10 -14 à 25°C Dans l ’eau [H 3 O+] [OH-]= (55. 4)2 Keq=Kw= 10 -14 à 25°C Dans l ’eau](https://slidetodoc.com/presentation_image_h/e2d1ed39690a4ac867ef10daff0b6fa8/image-23.jpg)








- Slides: 34

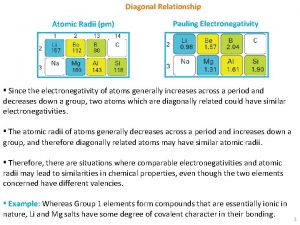
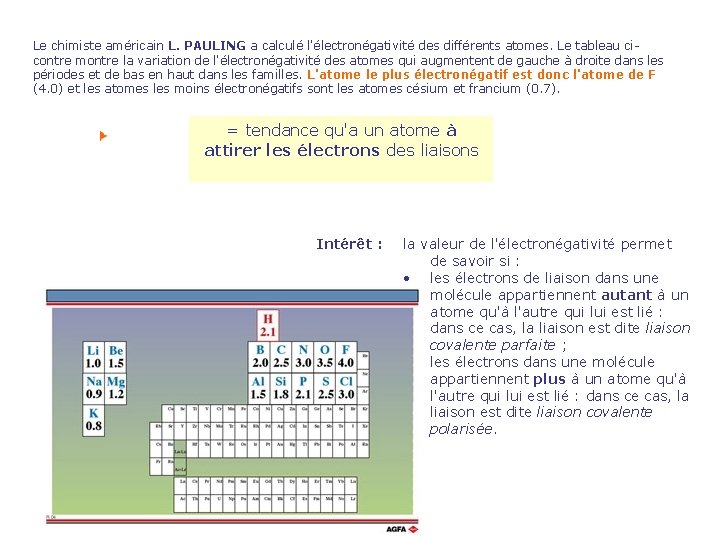
Le chimiste américain L. PAULING a calculé l'électronégativité des différents atomes. Le tableau cicontre montre la variation de l'électronégativité des atomes qui augmentent de gauche à droite dans les périodes et de bas en haut dans les familles. L'atome le plus électronégatif est donc l'atome de F (4. 0) et les atomes les moins électronégatifs sont les atomes césium et francium (0. 7). L. PAULING = tendance qu'a un atome à attirer les électrons des liaisons Intérêt : la valeur de l'électronégativité permet de savoir si : • les électrons de liaison dans une molécule appartiennent autant à un atome qu'à l'autre qui lui est lié : dans ce cas, la liaison est dite liaison covalente parfaite ; • les électrons dans une molécule appartiennent plus à un atome qu'à l'autre qui lui est lié : dans ce cas, la liaison est dite liaison covalente polarisée.

Molécule polaire

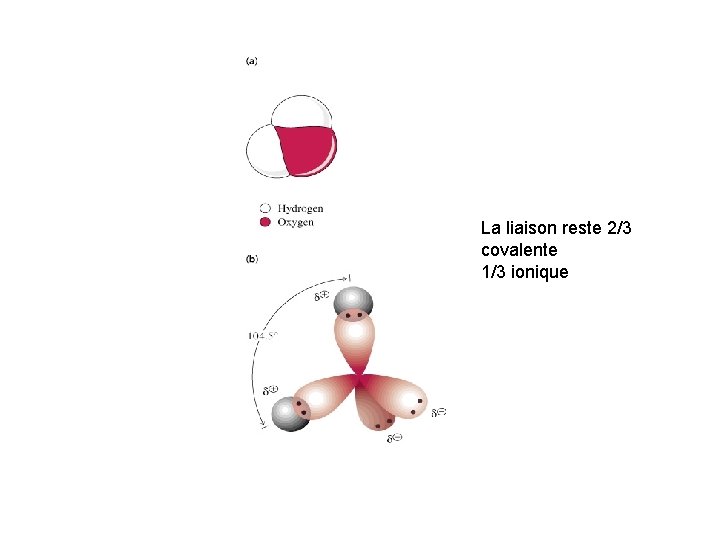
La liaison reste 2/3 covalente 1/3 ionique

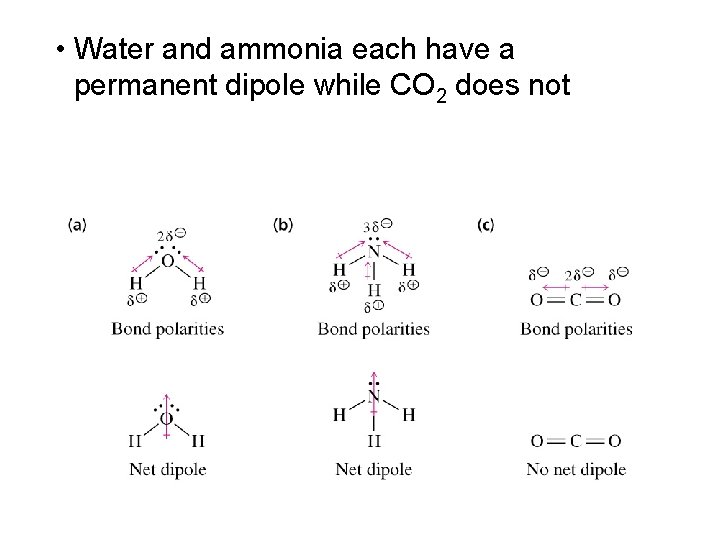
• Water and ammonia each have a permanent dipole while CO 2 does not

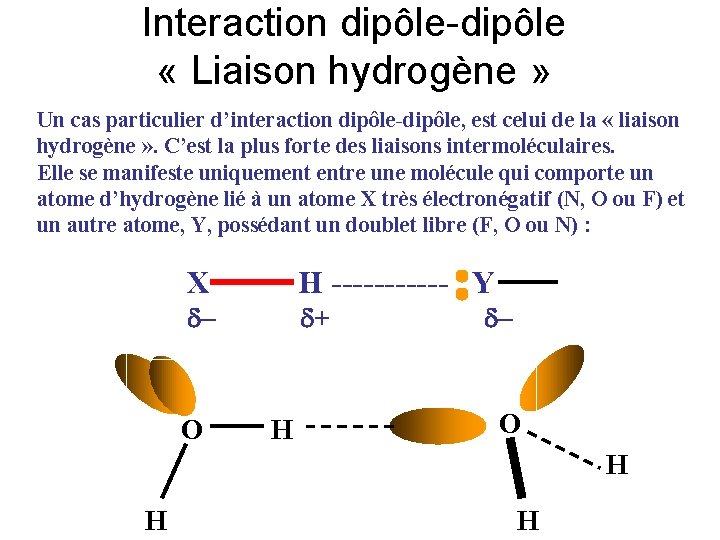
Interaction dipôle-dipôle « Liaison hydrogène » Un cas particulier d’interaction dipôle-dipôle, est celui de la « liaison hydrogène » . C’est la plus forte des liaisons intermoléculaires. Elle se manifeste uniquement entre une molécule qui comporte un atome d’hydrogène lié à un atome X très électronégatif (N, O ou F) et un autre atome, Y, possédant un doublet libre (F, O ou N) : X H ------ Y - O + - H O H H H

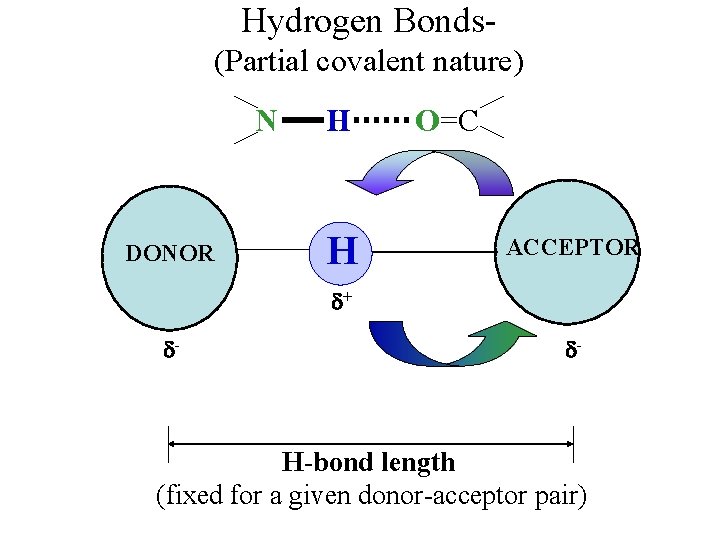
Hydrogen Bonds- (Partial covalent nature) N H O=C DONOR H ACCEPTOR + - - H-bond length (fixed for a given donor-acceptor pair)

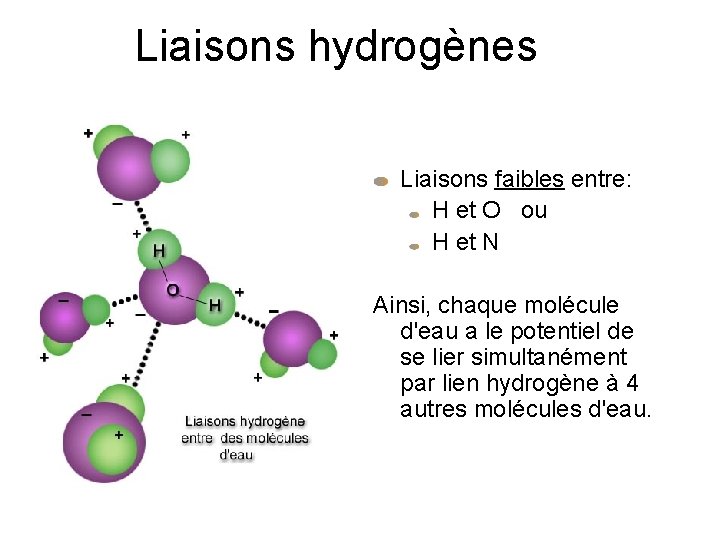
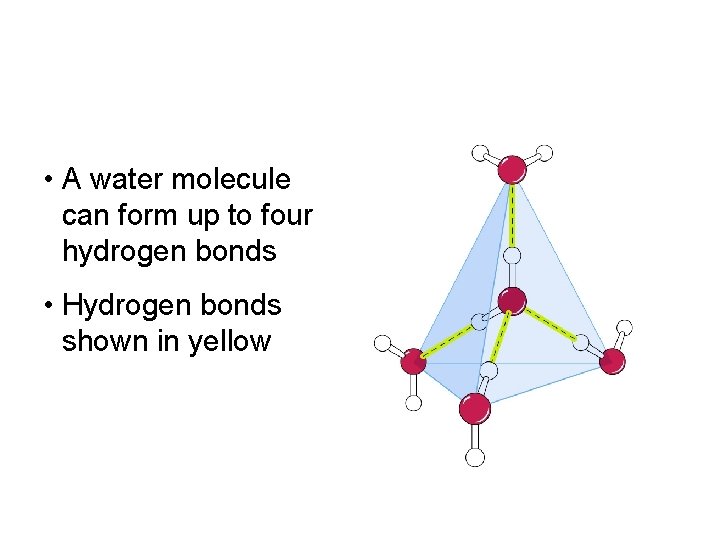
Liaisons hydrogènes Liaisons faibles entre: H et O ou H et N Ainsi, chaque molécule d'eau a le potentiel de se lier simultanément par lien hydrogène à 4 autres molécules d'eau.

Liaison de faible énergie 4, 5 Kcal/mol

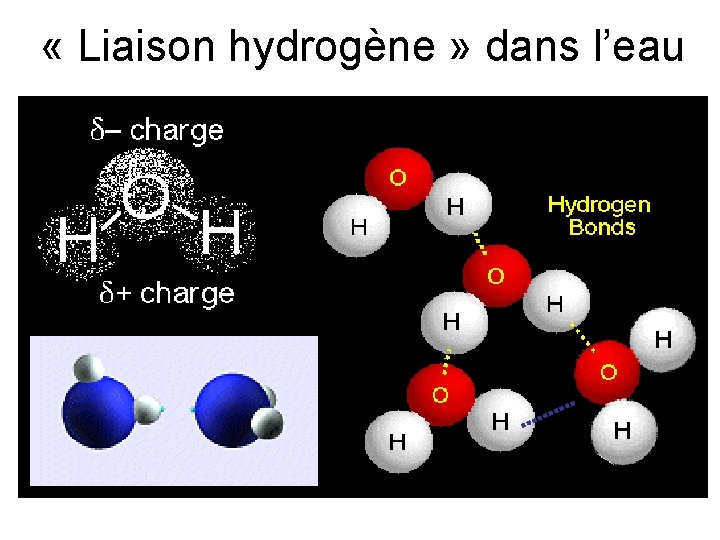
« Liaison hydrogène » dans l’eau

• A water molecule can form up to four hydrogen bonds • Hydrogen bonds shown in yellow

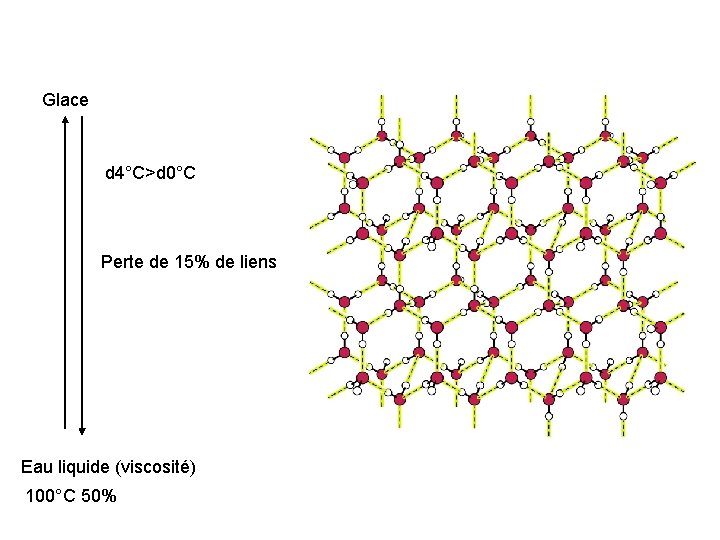
Glace d 4°C>d 0°C Perte de 15% de liens Eau liquide (viscosité) 100°C 50%


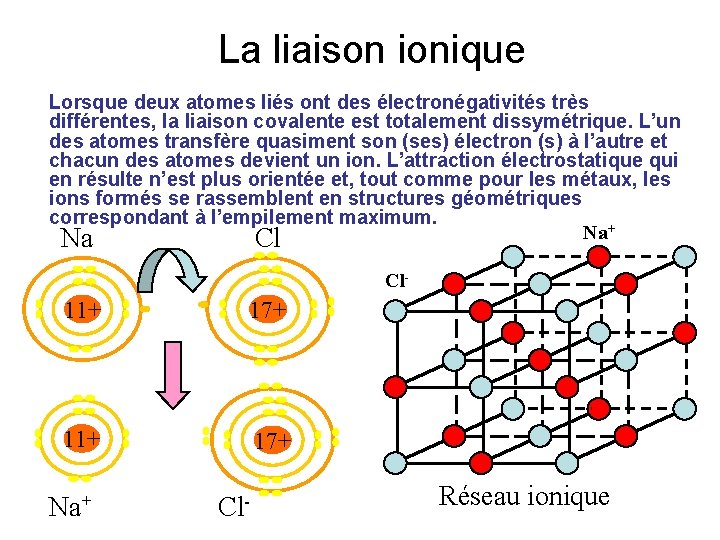
La liaison ionique Lorsque deux atomes liés ont des électronégativités très différentes, la liaison covalente est totalement dissymétrique. L’un des atomes transfère quasiment son (ses) électron (s) à l’autre et chacun des atomes devient un ion. L’attraction électrostatique qui en résulte n’est plus orientée et, tout comme pour les métaux, les ions formés se rassemblent en structures géométriques correspondant à l’empilement maximum. Na+ Na Cl Cl- 11+ 17+ Na+ Cl- Réseau ionique

Interaction ion-dipôle : solvatation L’interaction entre un ion et une molécule de solvant polaire est en 1/r 3, forte et de longue portée. Elle est liée à la taille de l’ion (cation < anion) et à sa charge, ainsi qu’au moment dipolaire du solvant. AH H + M+ 2 - + O 2 H H O Hydratation d’un anion et d’un cation q+ q- Z+ Elle explique la solubilité des composés ioniques dans l’eau, et leur insolubilité dans les solvants apolaires. L’interaction entre l’eau et les cations peut aller jusqu’à la formation de complexes liés.

Interaction ion-dipôle : solvatation F=e 1 e 2/Dr 2 DH 2 O= 80 DBenzene= 3, 3 Interaction ionique 10 Kcal/mol Chaque ion solvaté s’entoure statistiquement d’ions de charge opposée solvatés. A distance égale, l’attraction entre deux ions est 80 fois plus faible dans l’eau que dans le vide. Les ions n’ont plus tendance à s’y regrouper.




Interprétation de l’hydrophobie • L’hydrophobie ne résulte pas d’une répulsion entre les molécules d’eau et d’alcane. Il n’y a que des forces d’attraction en jeu ! • Cependant, la tendance des molécules d’eau à s’attirer les unes les autres par des liens hydrogène est forte, alors que les liens du type dipôle-dipôle induit entre molécules d’eau et d’alcane sont nettement plus faibles. • Le regroupement naturel des molécules d’eau abaisse l’énergie potentielle du système et le mélange ne se fait pas. « Liaisons hydrogène » Interactions de London

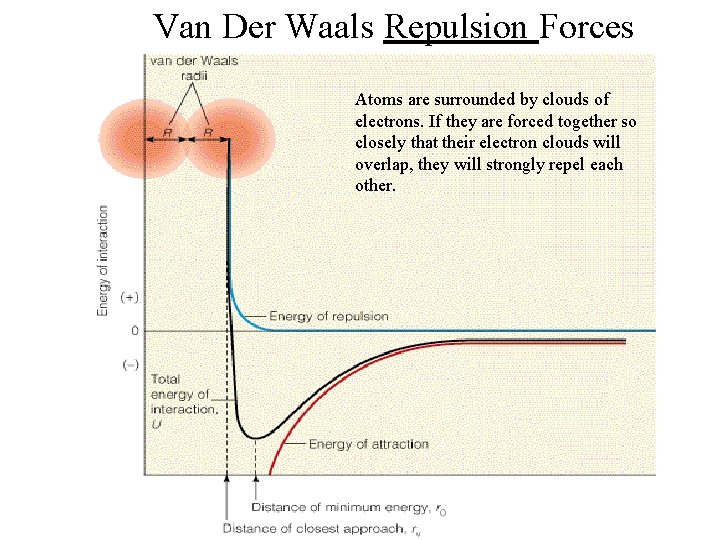
Van Der Waals Repulsion Forces Atoms are surrounded by clouds of electrons. If they are forced together so closely that their electron clouds will overlap, they will strongly repel each other.

Ionization of Water • Pure water consists of a low concentration of hydronium ions (H 3 O+) and an equal concentration of hydroxide ions (OH-) • Liaison O-H 110 Kcal/mol • Acids are proton donors (e. g. H 3 O+) and bases are proton acceptors (e. g. OH-)

Ionisation de l ’eau: L ’eau se dissocie en ions H 2 O H+ OHEn solution l ’ion H+ est solvaté H 2 O + H+ H 3 O+ La constante d ’équilibre est [H 3 O+] [OH-] Keq = [H 2 O]2
![H 3 O OH 55 42 KeqKw 10 14 à 25C Dans l eau [H 3 O+] [OH-]= (55. 4)2 Keq=Kw= 10 -14 à 25°C Dans l ’eau](https://slidetodoc.com/presentation_image_h/e2d1ed39690a4ac867ef10daff0b6fa8/image-23.jpg)
[H 3 O+] [OH-]= (55. 4)2 Keq=Kw= 10 -14 à 25°C Dans l ’eau pure on a [H 3 O+] = [OH-] = 10 -7 M Si [H 3 O+] > [OH-] la solution est acide Si [H 3 O+] < [OH-] la solution est basique On définit le p. H = -log [H 3 O+] une solution acide a un p. H<7 une solution basique a un p. H>7 La variation d'une unité p. H correspond à une variation facteur 10 de la concentration en ion H+

Un acide fort se dissocie totalement dans l ’eau HCl H+ + Cl- Un acide faible se dissocie partiellement dans l ’eau, il s ’établit alors un équilibre entre les différentes formes en solution AH H+ + A- AH est l ’acide et A- la base conjuguée

Pour un acide HA, la relation entre le p. Ka, les concentrations des formes protonées et déprotonées et le p. H est de la forme: p. H = p. Ka + log 10 [A-] [HA] Si p. H= p. Ka [AH] = [A-] Si p. H<p. Ka la forme AH prédomine Si p. H>p. Ka la forme A- prédomine



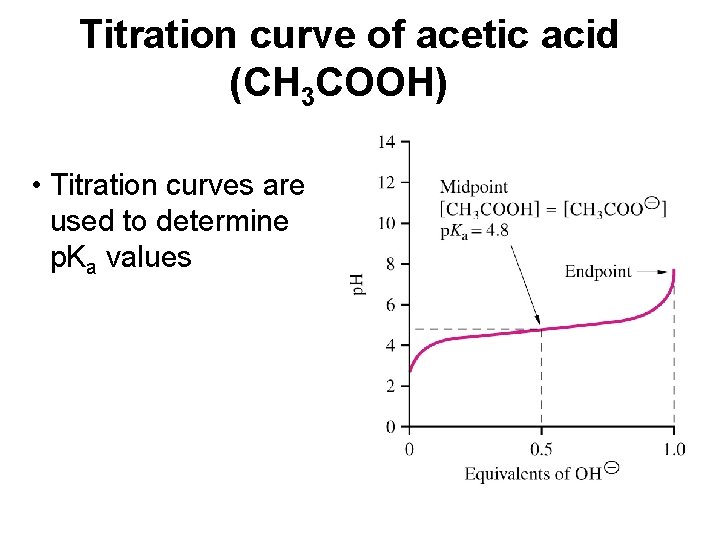
Titration curve of acetic acid (CH 3 COOH) • Titration curves are used to determine p. Ka values

Titration curve for phosphori c acid (H 3 PO 4) +/-




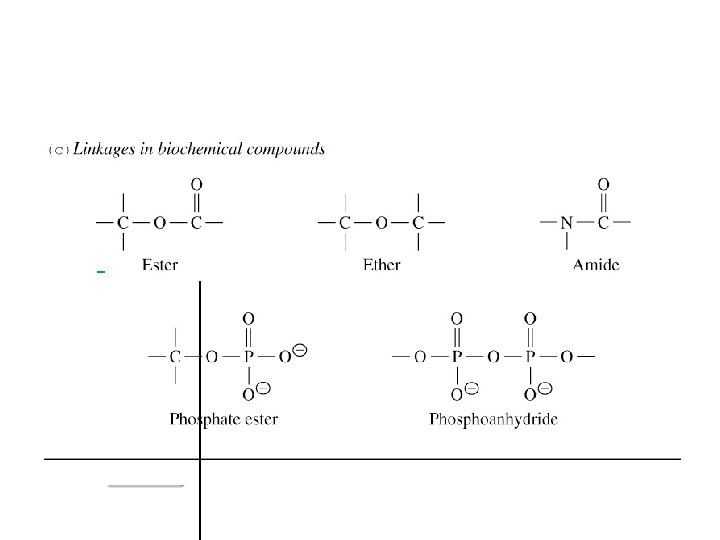
Les protéines - Ce sont les composés organiques les plus abondants dans les cellules: ils constituent plus de 50% de leur masse sèche. - Les protéines jouent un rôle prédominant dans le fonctionnement cellulaire. - La « brique » de base qui constitue les protéines est l’acide aminé. a Sauf pour la glycine, on distingue pour chaque acide aminé 2 énantiomères (Ca de configuration absolue R ou S).

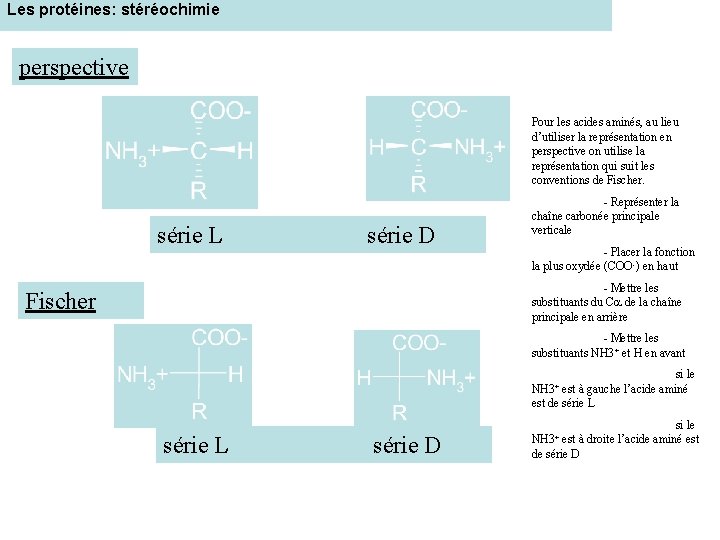
Les protéines: stéréochimie perspective Pour les acides aminés, au lieu d’utiliser la représentation en perspective on utilise la représentation qui suit les conventions de Fischer. série L série D - Représenter la chaîne carbonée principale verticale - Placer la fonction la plus oxydée (COO-) en haut - Mettre les substituants du Ca de la chaîne principale en arrière Fischer - Mettre les substituants NH 3+ et H en avant si le NH 3+ est à gauche l’acide aminé est de série L série D si le NH 3+ est à droite l’acide aminé est de série D
 Loi de pauling
Loi de pauling Segunda regla de pauling
Segunda regla de pauling Eletronegatividade de pauling
Eletronegatividade de pauling Linus pauling
Linus pauling Diagrama de pauling
Diagrama de pauling Programmviren
Programmviren Diagrama de linus pauling
Diagrama de linus pauling Como se mide el radio ionico
Como se mide el radio ionico Diagrama de linus pauling
Diagrama de linus pauling Diagonal relationship definition
Diagonal relationship definition Tabela de linus pauling
Tabela de linus pauling Fluorite structure
Fluorite structure Diagrama linus pauling
Diagrama linus pauling Pauling's rules oxoacids
Pauling's rules oxoacids Centrage long et court
Centrage long et court Volume de hexagonal
Volume de hexagonal Tmst calcul
Tmst calcul Score de mac isaac def
Score de mac isaac def Calcul mental pourcentage
Calcul mental pourcentage Taux de marge
Taux de marge Prédim
Prédim Calcul écrit fois
Calcul écrit fois Ogrh
Ogrh Calage moteur avion rc
Calage moteur avion rc Calcul du courant admissible iz
Calcul du courant admissible iz Arc boutement calcul
Arc boutement calcul Teorema de pitagora
Teorema de pitagora Calcul de la charge de travail
Calcul de la charge de travail Calcul point de rosée toiture terrasse
Calcul point de rosée toiture terrasse Cifoza definitie
Cifoza definitie Structura generala a unui sistem de calcul
Structura generala a unui sistem de calcul Calcul poussée butée
Calcul poussée butée Structura generala a unui sistem de calcul
Structura generala a unui sistem de calcul Coef de rotation calcul
Coef de rotation calcul Calcul ajr
Calcul ajr