Las reacciones Qumicas Silvia Citlalli Gama Gonzlez Mariano















- Slides: 25

Las reacciones Químicas Silvia Citlalli Gama González Mariano Sánchez Castellanos

¿Qué hace la química? Controlar Predecir Aprovechar Manipular

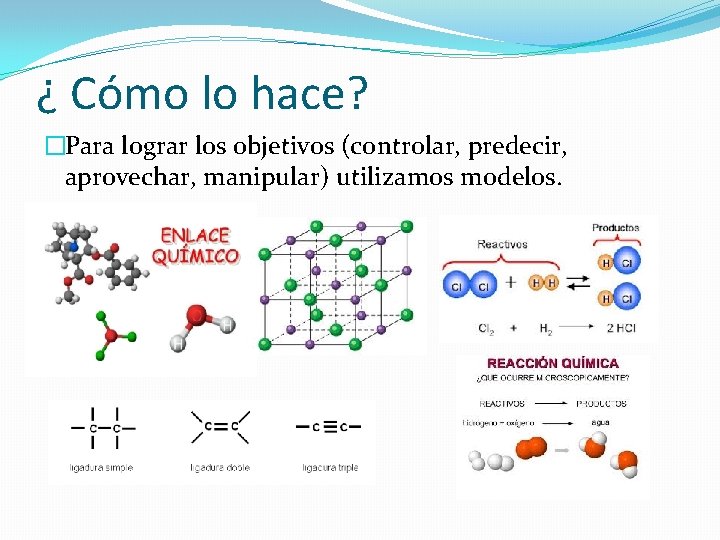
¿ Cómo lo hace? �Para lograr los objetivos (controlar, predecir, aprovechar, manipular) utilizamos modelos.

El modelo de la reacción química Símbolo reacción no completa CO 2(g) + H 2 O H 2 CO 3(ac) Na. Cl(s) + (n+m)H 2 O Na+(n. H 2 O) + Cl-(m. H 2 O) Símbolo reacción completa

El modelo de la reacción química en Química Analítica Aceptor Base + H+ Ácido • Acido-base • CH 3 COO- + H+ CH 3 COOH Brønsted-Lowry + Partícula Oxidante + e- Donador Reductor • Óxido –reducción • Cu 2+ + e- Cu 0 Metal + L Complejo • Complejos • Cu 2+ + NH 3 Cu. NH 32+

Objetivos �Usar las reacciones químicas para la caracterización química de diferentes muestras de agua, comerciales y del suministro estatal �Estudiar y analizar las propiedades de las reacciones químicas. �Usar métodos de análisis químico tanto cualitativos como cuantitativos, tanto clásicos como instrumentales. �Tratar y analizar los resultados obtenidos para generar conclusiones basadas en lo obtenido experimentalmente.

Justificación �¿Por qué el agua?

Análisis cualitativo �Determinar la composición de una matriz de interés de manera acotada según la necesidad específica. �¿Qué podemos encontrar en el agua? �Aniones (sulfatos, cloruros) �Cationes (calcio, magnesio, sodio) �Gases (oxigeno, nitrogeno) �Orgánicos (farmacos, surfactantes, grasas)

Identificación de cationes y aniones �Para calcio �Ca 2+ + -OOC-COO- = Ca. C 2 O 4(S) Precipitado blanco �Para hierro (III) �Fe 3+ + 6 SCN- = [Fe(SCN)6]3 - Solución acuosa rojo sangre � Para hierro (II) �Fe 2+ + 3 C 12 H 8 N 2 = [Fe(C 12 H 8 N 2)3]2+ Solución acuosa anaranjada �Para sulfatos �SO 42 - + Ba 2+ = Ba. SO 4(S) Precipitado blanco � Para cromo (III) �Cr 3+ + HOOH + OH- = Cr. O 42 - Solución acuosa amarilla �Cr. O 42 - + H 2 SO 4 = Cr. O 5(S) Precipitado azul muy inestable �Para cloruros �Cl- + Ag+ = Ag. Cl(S) Precipitado blanco

Análisis cuantitativio �Determinación del contenido presente de una o varias especies de interés en una matriz que debe reportarse con un intervalo de confianza.

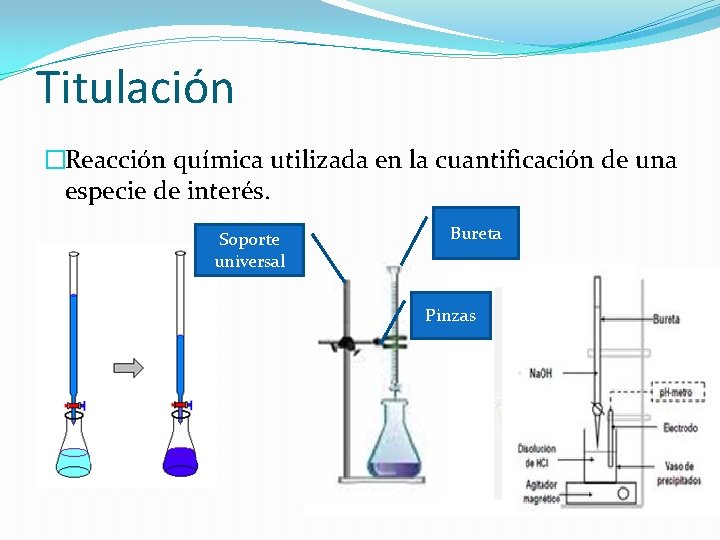
Titulación �Reacción química utilizada en la cuantificación de una especie de interés. Soporte universal Bureta Pinzas

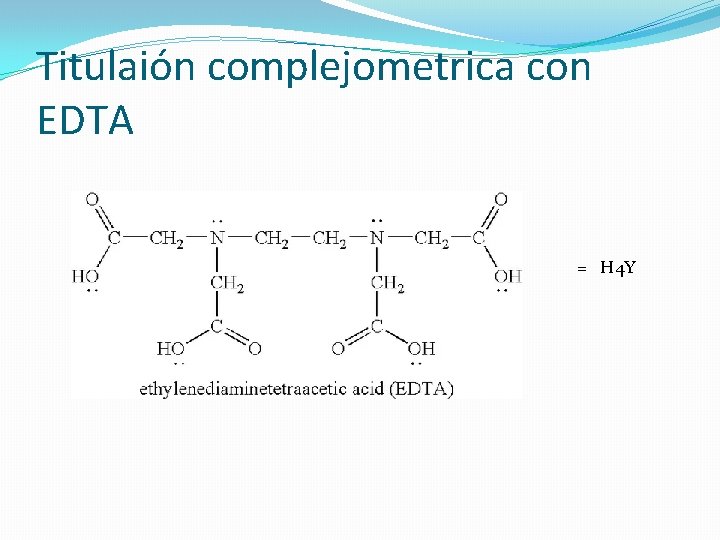
Titulaión complejometrica con EDTA = H 4 Y

Titulación �Reacción muy cuantitativa �Relación de estequiometría conocida �Reacción cineticamente rápida Na+, K+, Ca 2+, Mg 2+, Fe 3+, Cr 3+, etc p. H= 10 + y 4 Negro de eriocromo T z-4 -

Normalización �Proceso de conocer la concentración de un reactivo en una disolución usando una reacción química cuantitativa para ello. �A la disolución final se le denomina patrón secundario. �El patrón secundario se utiliza para cuantificar al analito de interés. �Se usa un patrón primario �Estable �Masa molar conocida y elevada �No higroscópico

Normalización de HCl �El ácido clorhídrico es una disolución formada al burbujear el gas cloruro de hidrógeno en un disolvente, agua en este caso, por lo que al preparar una disolución no se puede conocer su concentración. �Se normaliza por titulación con carbonato de sodio. �Como indicador se utiliza una disolución acuosa de anaranjado de metilo

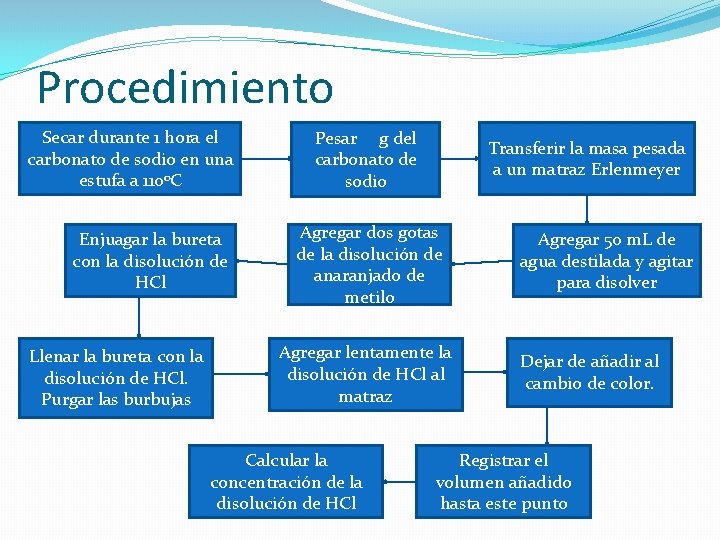
Procedimiento Secar durante 1 hora el carbonato de sodio en una estufa a 1100 C Enjuagar la bureta con la disolución de HCl Llenar la bureta con la disolución de HCl. Purgar las burbujas Pesar g del carbonato de sodio Transferir la masa pesada a un matraz Erlenmeyer Agregar dos gotas de la disolución de anaranjado de metilo Agregar lentamente la disolución de HCl al matraz Calcular la concentración de la disolución de HCl Agregar 50 m. L de agua destilada y agitar para disolver Dejar de añadir al cambio de color. Registrar el volumen añadido hasta este punto

Normalización de Na. OH �El hidróxido de sodio es un reactivo sólido altamente higroscópico por lo que al preparar una disolución no se puede conocer su concentración a partir de la masa pesada del reactivo y el volumen al cual se llevó. �Se normaliza por titulación con ftalato ácido de potasio.

Procedimiento Secar durante 1 hora el ftalato ácido de potasio en una estufa a 1100 C Enjuagar la bureta con la disolución de Na. OH Llenar la bureta con la disolución de Na. OH. Purgar las burbujas Pesar g del ftalato ácido de potasio Transferir la masa pesada a un matraz Erlenmeyer Agregar dos gotas de la disolución de fenoftlaleina Agregar lentamente la disolución de Na. OH al matraz Calcular la concentración de la disolución de Na. OH Agregar 50 m. L de agua destilada y agitar para disolver Dejar de añadir ante la mas ligera tonalidad rosa. Registrar el volumen añadido hasta este punto

Concentración

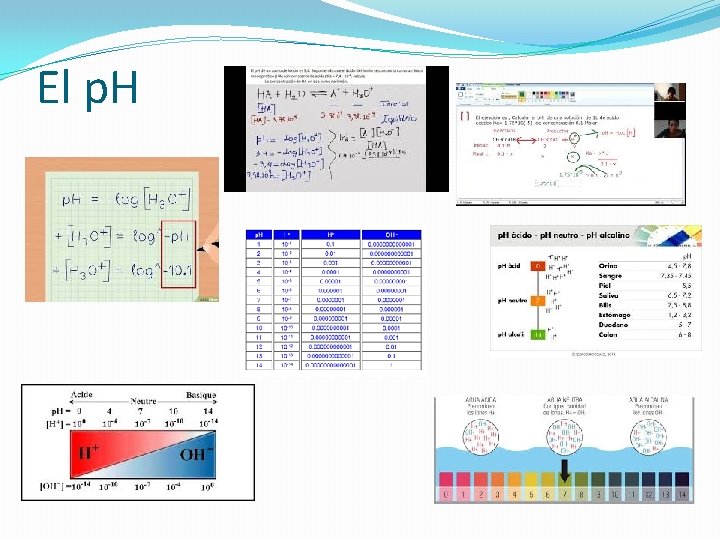
El p. H

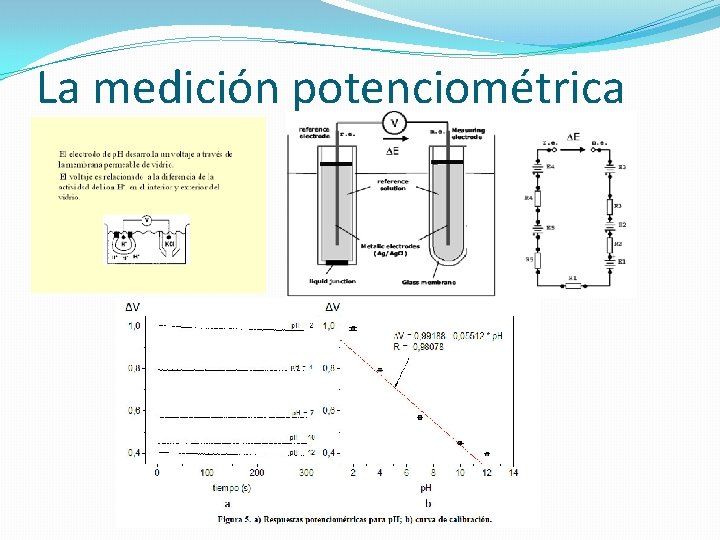
La medición de p. H

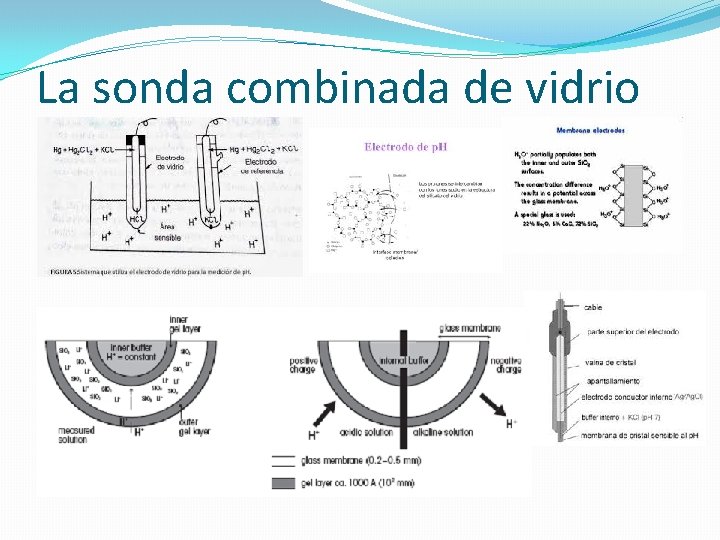
La sonda combinada de vidrio

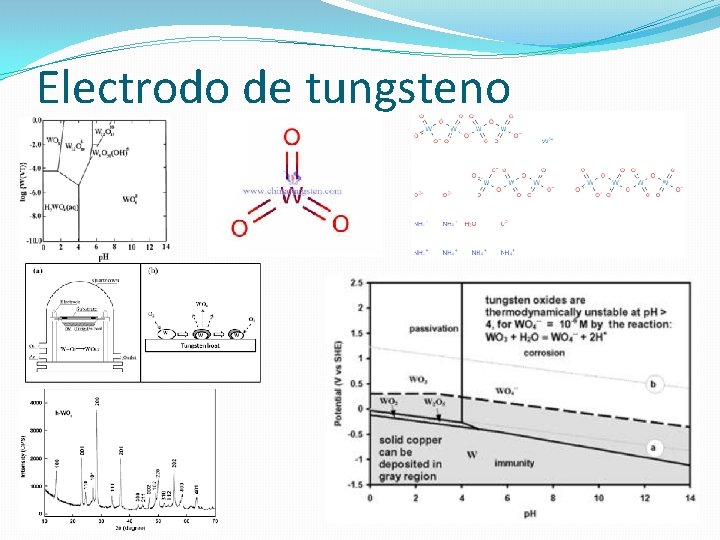
Electrodo de tungsteno

La medición potenciométrica

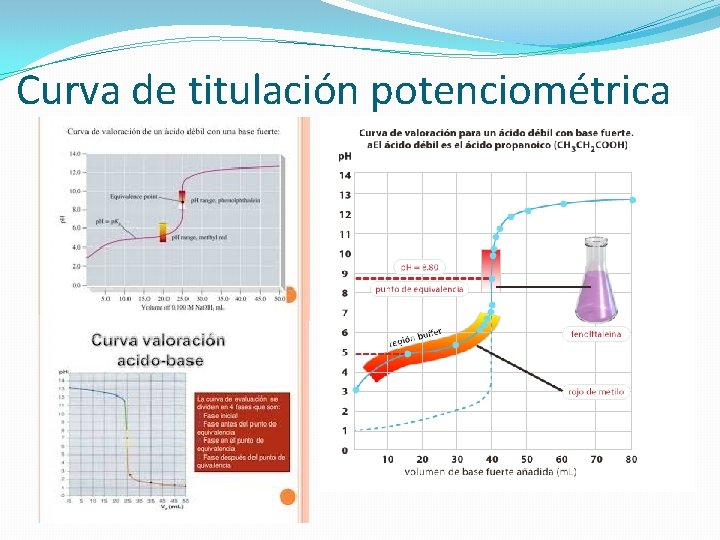
Curva de titulación potenciométrica
 Mariano sanchez castellanos
Mariano sanchez castellanos Citlalli dominguez
Citlalli dominguez Qumicas
Qumicas Fosfatase alcalina
Fosfatase alcalina Gonzlez
Gonzlez Vfetch
Vfetch Dalton gmez
Dalton gmez Reacciones ireversibles ejemplos
Reacciones ireversibles ejemplos La debilidad de las reacciones
La debilidad de las reacciones Cuales son las reacciones del ciclo de krebs
Cuales son las reacciones del ciclo de krebs Agente reductor y oxidante
Agente reductor y oxidante Las reacciones endergónicas son aquellas que
Las reacciones endergónicas son aquellas que Catabolismo de proteínas
Catabolismo de proteínas Mariano di vanni
Mariano di vanni Mes de mayo mariano
Mes de mayo mariano Oscar fuentes lira
Oscar fuentes lira Colegio mariano hidalgo
Colegio mariano hidalgo Rizal inventions in dapitan
Rizal inventions in dapitan Dogmas mariano
Dogmas mariano Q10 mariano moreno
Q10 mariano moreno Mariano de larrobla
Mariano de larrobla Universidad mariano galvez villa nueva
Universidad mariano galvez villa nueva Mariano galvez villa nueva
Mariano galvez villa nueva Mariano marcos state university
Mariano marcos state university Colegio barranquilla
Colegio barranquilla Foda de la universidad mariano galvez
Foda de la universidad mariano galvez
















































