Laboratorio n 8 Comportamiento de grupos funcionales Objetivo

Laboratorio nº 8 Comportamiento de grupos funcionales

Objetivo 1. Identificar diferentes grupos funcionales en los compuestos orgánicos con base en su comportamiento químico. 2. Reconocer a los compuestos orgánicos más importantes como son los alcoholes, aldehídos, cetonas y ácidos orgánicos, a través de sus reacciones características en ensayados comunes de identificación.

El comportamiento químico y físico de una molécula orgánica se debe principalmente a la presencia en su estructura de uno o varios grupos, funciones o familias químicas. Los grupos funcionales: son grupos de átomos responsables del comportamiento químico de la molécula que lo contiene. Familia de compuestos: conjunto de compuestos orgánicos que contienen el mismo grupo funcional. Identificación de grupos funcionales orgánicos: esta será posible en base a una serie de reacciones características para cada grupo funcional

Materiales vtubos de ensayo vplancha para calentar goteros de vidrio v. Policial vvasos químicos

Reactivos Bicarbonato de Potasio Fórmula: KHCO 3 Forma Física: Sólido cristalino, blanco, sin olor Peso Molecular: 100, 12 g/mol Punto de Ebullición: se descompone Punto De Fusión/Congelación: 100 -120 o. C Solubilidad: 33, 7 g por 100 ml de Agua a 20ºC. Bicarbonato de Sodio: Fórmula: Na. HCO 3 Apariencia sólido, granular, blanco Densidad: 2, 173 g/cm 3 Masa molar 84 g/mol Punto de fusión 109 °C Punto de descomposición 543, 15 K Solubilidad: ligeramente soluble en etanol, 10, 3 g/100 g H 2 O

Ácido Acético (vinagre) Fórmula: CH 3 COOH Forma Física: Líquido claro y sin color, olor muy picante (vinagre). Peso Molecular: 60, 5 g/mol Punto de Ebullición: 118 o. C Punto De Fusión/Congelación: 16, 6 o. C Solubilidad: Soluble en agua, alcohol, glicerina y éter. Insoluble en sulfuro de carbono etanol Fórmula: CH 3 CH 2 OH/C 2 H 5 OH Masa molecular: 46. 1 g/mol Punto de ebullición: 78°C Punto de fusión: -114°C Densidad relativa (agua = 1): 0. 79 g/m. L Solubilidad en agua: Miscible Aspecto: Líquido, color incoloro, de olor característico.

Ácido Benzoico Fórmula: C 6 H 5 COOH Forma Física: Cristales o polvo sólidos, incoloros, ligero olor característico Peso Molecular: 122, 2 g/mol Punto de Ebullición: Se descompone en 249 o. C Punto De Fusión/Congelación: 122 o. C Solubilidad: soluble en alcohol, éter, cloroformo, benceno, sulfuro de carbono, tetracloruro de carbono. Poco soluble en agua Benzaldehído Fórmula: C 6 H 5 CHO Forma Física: Líquido, incoloro, olor agradable a almendras y característico Peso Molecular: 106, 13 g/mol Punto de Ebullición: 178 o. C Punto De Fusión/Congelación: -26 o. C Solubilidad: 0. 3 g/100 g agua

Acetofenona Fórmula: C 6 H 5 COCH 3 Forma Física: Líquido o cristales, incoloros de olor característico Peso Molecular: 120, 1 g/mol Punto de Ebullición: 202 o. C Punto De Fusión/Congelación: 20 o. C Solubilidad: en agua escasa Reactivo de Brady (disolución alcohólica de sulfato 2, 4 dinitrofenilhidrazina) Fórmula: C 6 H 6 N 4 O 4 Forma Física: Líquido o cristales, incoloros o blancos, de olor característico Peso Molecular: 198, 14 g/mol Punto De Fusión/Congelación: 193, 85 o. C Solubilidad: insoluble

Cloruro de Acetilo Fórmula: CH 3 COCl Forma Física: Líquido humeante, incoloro, de olor acre Peso Molecular: 78, 5 g/mol Punto de Ebullición: 51 o. C Punto De Fusión/Congelación: -112 o. C Solubilidad: reacciona con el agua. Terc-butanol Fórmula: (CH 3)3 COH Forma Física: Líquido incoloro de olor característico Peso Molecular: 74, 1 g/mol Punto de Ebullición: 83 o. C Punto De Fusión/Congelación: 25 o. C Solubilidad: miscible en agua
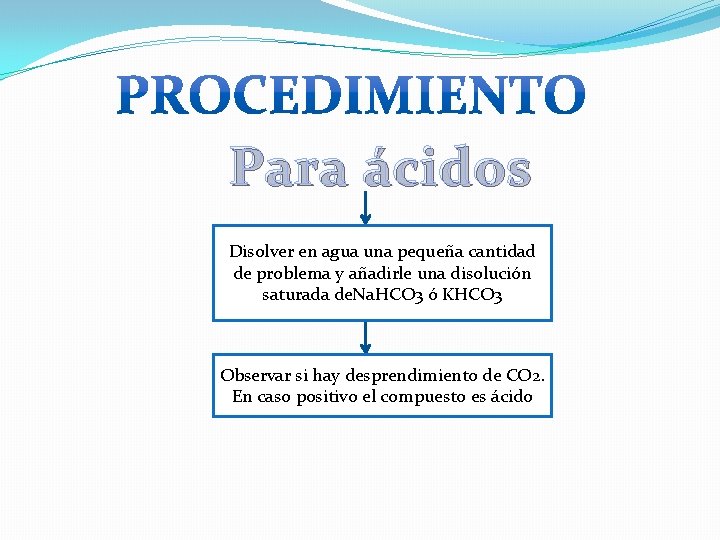
Para ácidos Disolver en agua una pequeña cantidad de problema y añadirle una disolución saturada de. Na. HCO 3 ó KHCO 3 Observar si hay desprendimiento de CO 2. En caso positivo el compuesto es ácido
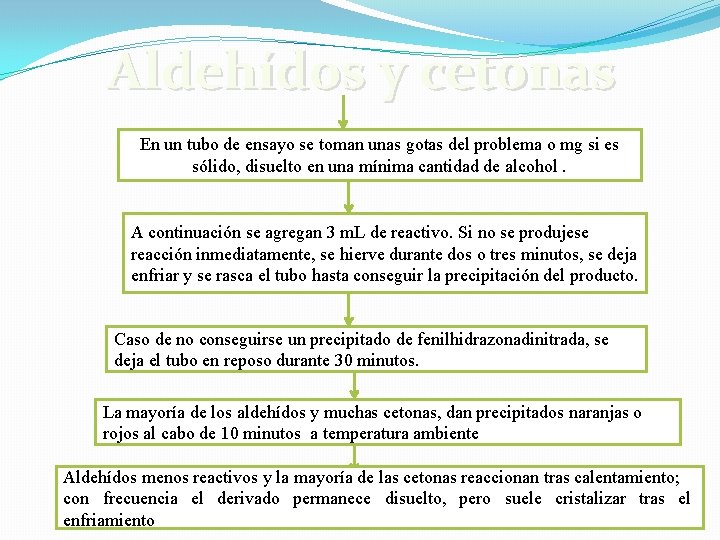
Aldehídos y cetonas En un tubo de ensayo se toman unas gotas del problema o mg si es sólido, disuelto en una mínima cantidad de alcohol. A continuación se agregan 3 m. L de reactivo. Si no se produjese reacción inmediatamente, se hierve durante dos o tres minutos, se deja enfriar y se rasca el tubo hasta conseguir la precipitación del producto. Caso de no conseguirse un precipitado de fenilhidrazonadinitrada, se deja el tubo en reposo durante 30 minutos. La mayoría de los aldehídos y muchas cetonas, dan precipitados naranjas o rojos al cabo de 10 minutos a temperatura ambiente Aldehídos menos reactivos y la mayoría de las cetonas reaccionan tras calentamiento; con frecuencia el derivado permanece disuelto, pero suele cristalizar tras el enfriamiento

Procedimiento para diferenciar aldehídos y cetonas Mezclar 2 m. L de Ag. NO 3 acuoso al 5% con una gota de sosa y se añade amoniaco al 10% hasta que se disuelva el precipitado pardo oscuro de óxido de plata inicialmente formado (no agregar exceso de amoníaco) • A continuación se añaden 5 mg de problema sólido o la menor cantidad posible de problema líquido y se agita. Si no hay reacción se calienta en un baño de agua a 50 -60°C sin que llegue a hervir. Si hay aldehído aparecerá un espejo de plata en el fondo del tubo de ensayo. Las cetonas no dan esta reacción, excepto algunas que tienen carácter reductor Exceso de calentamiento, de amoníaco o de problema o suciedad en el tubo de ensayo, originan malos resultados • Terminado el ensayo, arrastrar la mezcla reaccionante con agua, ya que con el tiempo o al secarse, se pueden formar productos explosivos. El espejo de plata puede eliminarse con acido nítrico caliente
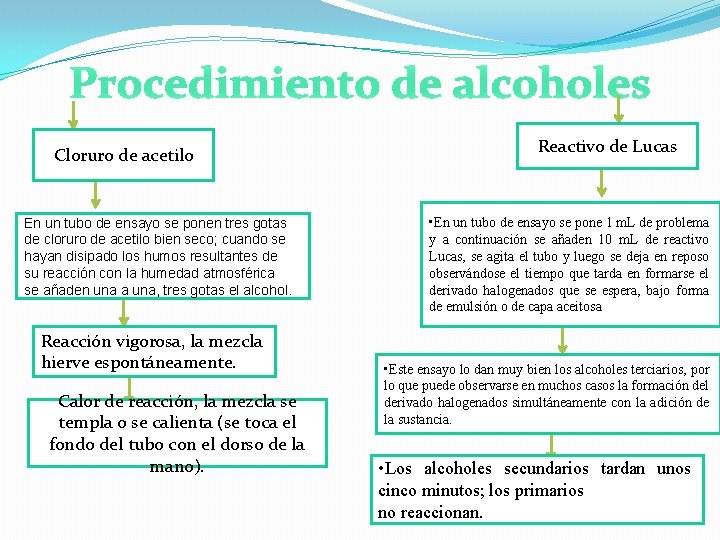
Procedimiento de alcoholes Cloruro de acetilo En un tubo de ensayo se ponen tres gotas de cloruro de acetilo bien seco; cuando se hayan disipado los humos resultantes de su reacción con la humedad atmosférica se añaden una a una, tres gotas el alcohol. Reacción vigorosa, la mezcla hierve espontáneamente. Calor de reacción, la mezcla se templa o se calienta (se toca el fondo del tubo con el dorso de la mano). Reactivo de Lucas • En un tubo de ensayo se pone 1 m. L de problema y a continuación se añaden 10 m. L de reactivo Lucas, se agita el tubo y luego se deja en reposo observándose el tiempo que tarda en formarse el derivado halogenados que se espera, bajo forma de emulsión o de capa aceitosa • Este ensayo lo dan muy bien los alcoholes terciarios, por lo que puede observarse en muchos casos la formación del derivado halogenados simultáneamente con la adición de la sustancia. • Los alcoholes secundarios tardan unos cinco minutos; los primarios no reaccionan.
- Slides: 13