Laboratorio n 2 Clasificacin por solubilidad de compuestos

Laboratorio nº 2 Clasificación por solubilidad de compuestos orgánicos

objetivos 1. Clasificar algunos compuestos orgánicos teniendo en cuenta su solubilidad. 2. Conocer el carácter polar y apolar de algunos compuestos orgánicos. 3. Verificar las fuerzas intermoleculares en la solubilidad de las sustancias analizadas.

Introducción Los compuestos orgánicos, de acuerdo con su polaridad se clasifican desde no polares (alcanos) hasta los de muy alta polaridad (ácidos carboxílicos y sinfónicos). Un compuesto no polar disolverá a otro no polar, debido a la facilidad de su mutua separación e interpretación a causa de sus débiles asociaciones intermoleculares. En forma análoga un compuesto polar se disolverá en un compuesto polar ya que ambos poseen enlaces con suficiente energía parea romper las fuertes interacciones del y entremezclarse. Solubilidad en agua: En general cuatro tipos de compuestos son solubles en agua, los electrolitos, los ácidos, las bases y los compuestos polares. En cuanto a los electrolitos, las especies iónicas se hidratan debido a las interacciones ion-dipolo entre las moléculas de agua y los iones. Solubilidad en éter o benceno: En general las sustancias no polares y ligeramente polares se disuelven en éter. El que un compuesto polar sea o no soluble en éter, depende de la influencia de los grupos polares con respecto a la de los grupos no polares presentes.

Solubilidad en ácido clorhídrico diluido: La mayoría de las sustancias solubles en agua y solubles en ácido clorhídrico diluido tienen un átomo de nitrógeno básico. Solubilidad en hidróxido de sodio: Los compuestos que son insolubles en agua, pero que son capaces de donar un protón a una base diluida, pueden formar productos solubles en agua. Solubilidad en bicarbonato de sodio: El concepto de acidez es relativo, y un compuesto es ácido o básico en comparación con otro. Los ácidos orgánicos se consideran ácidos débiles, pero dentro de ellos se pueden comparar entre menos o más débiles en comparación con el ácido carbónico. Solubilidad en ácido sulfúrico concentrado: Este ácido es un donante de protones muy efectivo, y es capaz de protonar hasta la base más débil.

Materiales v Gradilla. v Espátulas v Tubos de ensayo. v Pipeta de 5 ml.

Reactivos Solventes Fórmula: H 2 O Apariencia líquida, incolora, inodora, insípida. Densidad: 1, 00 g/cm 3 Masa molar 18 g/mol Punto de fusión 0 °C Punto de ebullición: 100ºC Solubilidad: Disolvente universal (disuelve compuestos ionicos, ácidos, bases, algunos compuestos orgánicos).

Hidróxido de Sodio (10%) Fórmula: Na. OH Masa molecular: 40. 0 g/mol Punto de ebullición: 1390°C Punto de fusión: 318°C Densidad relativa (agua = 1): 2. 1 g/m. L Solubilidad en agua, g/100 ml a 20°C: 109 Aspecto: Sólido Color: blanco, delicuescente en diversas formas e inodoro.

Benceno Fórmula: C 6 H 6 Masa molecular: 78, 11 g/mol Color: incoloro Punto de ebullición 80. 1°C Punto de fusión: 5, 5 °C Densidad: (g/ml): 0. 8789 (20 o. C) y 0. 8736 (25 o. C). Aspecto: líquido de olor característico. Solubilidad en agua: soluble en 1430 partes de agua o 1780 mg/ml (a 20 o. C) , miscible en etanol, cloroformo, éter, disulfuro de carbono, tetracloruro de carbono, ácido acético glacial, acetona y aceites.

Ácido Clorhídrico (5%) Fórmula: HCl Apariencia líquido incoloro o levemente amarillo Densidad: 1190 (solución 37%), 1160 solución 32%, 1120 solución 25% kg/m 3; 1, 12 g/cm 3 Masa molar 36, 46 g/mol Punto de fusión 247 K (-26 °C) Punto de ebullición 321 K (48 °C)

Ácido Sulfúrico Fórmula: H 2 SO 4 Masa molecular: 98, 1 g/mol Color: incoloro Punto de ebullición (se descompone): 340°C Punto de fusión: 10°C Densidad: 1, 8 g/m. L Aspecto: líquido higroscópico - aceitoso e inodoro. Solubilidad en agua: Miscible

Bicarbonato de Sodio (5%) Fórmula: Na. HCO 3 Apariencia sólido, granular, blanco Densidad: 2, 173 g/cm 3 Masa molar 84 g/mol Punto de fusión 109 °C Punto de descomposición 543, 15 K Solubilidad: ligeramente soluble en etanol, 10, 3 g/100 g H 2 O

Etilendiamina Fórmula: C 2 H 8 N 2 Masa molecular: 60, 1 g/mol Punto de ebullición 117 - 118°C Punto de fusión: 10, 7 °C Densidad: 0, 898 g/m. L Aspecto: líquido higroscópico de incoloro a amarillo, de olor acre. Solubilidad en agua: miscible

Etanol Fórmula: CH 3 CH 2 OH/C 2 H 5 OH Masa molecular: 46. 1 g/mol Punto de ebullición: 78°C Punto de fusión: -114°C Densidad relativa (agua = 1): 0. 79 g/m. L Solubilidad en agua: Miscible Aspecto: Líquido, color incoloro, de olor característico. Acetato de Etilo Fórmula: C 4 H 8 O 2, CH 3 COOCH 2 CH 3 Masa molecular: 88, 1 g/mol Punto de ebullición: 77°C Punto de fusión: -83°C Densidad relativa (agua = 1): 0. 898 g/m. L Solubilidad: Miscible en etanol, acetona, cloroformo, éter. 1 m. L es soluble en 10 m. L de agua. Aspecto: líquido, color incoloro, de olor afrutado.

Triclorometano Fórmula: CHCl 3 Masa molecular: 119, 39 g/mol Punto de ebullición: 61, 26°C Punto de fusión: -63, 5°C Densidad: 1, 498 g/m. L Solubilidad en agua: 10, 62 g /100 g agua Aspecto: líquido incoloro con olor dulce característico, muy volátil. HEXANO Fórmula: C 6 H 14 Masa molecular: 86. 2 g/mol Punto de ebullición: 121°C Punto de fusión: -41. 6°C Densidad: Solubilidad en agua: Miscible Aspecto: Líquido Color: incoloro volátil, de olor característico

Metanol Fórmula: CH 3 OH Masa molecular: 119, 39 g/mol Punto de ebullición: 65°C Punto de fusión: -97°C Densidad: 0, 79 g/m. L Solubilidad en agua: etanol, éter, acetona, cloroformo Aspecto: líquido incoloro, con olor leve a alcohol. Tolueno (metil benceno) Fórmula: C 6 H 5 CH 3 Peso molecular: 92 g/mol Punto de ebullición: 110. 6 °C Punto de fusión: -95 °C Densidad: 0. 8669 g/m. L Solubilidad en agua: 0. 05 g/m. L Aspecto: líquido incoloro, con olor característico.

Urea Fórmula: CO(NH 2)2 Peso molecular: 60, 06 g/mol Punto de fusión: 132, 7 °C Densidad: 1, 34 g/m. L Solubilidad en agua: 108 g/100 g de agua Aspecto: cristales blancos, con olor a amoniaco. Etilenglicol Fórmula: C 2 H 6 O 2 Peso molecular: 62, 068 g/mol Punto de ebullición: 197 °C Punto de fusión: -13 °C Densidad: 1, 11 g/m. L Solubilidad en agua: miscible Aspecto: líquido incoloro, inodoro.
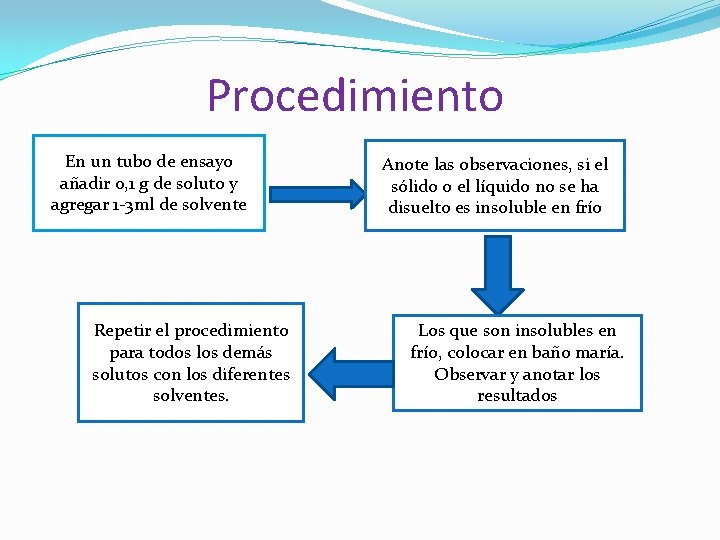
Procedimiento En un tubo de ensayo añadir 0, 1 g de soluto y agregar 1 -3 ml de solvente Repetir el procedimiento para todos los demás solutos con los diferentes solventes. Anote las observaciones, si el sólido o el líquido no se ha disuelto es insoluble en frío Los que son insolubles en frío, colocar en baño maría. Observar y anotar los resultados
- Slides: 17