LA TABLA PERIDICA Y PROPIEDADES QUIMICAS HISTORIA DE

LA TABLA PERIÓDICA Y PROPIEDADES QUIMICAS.
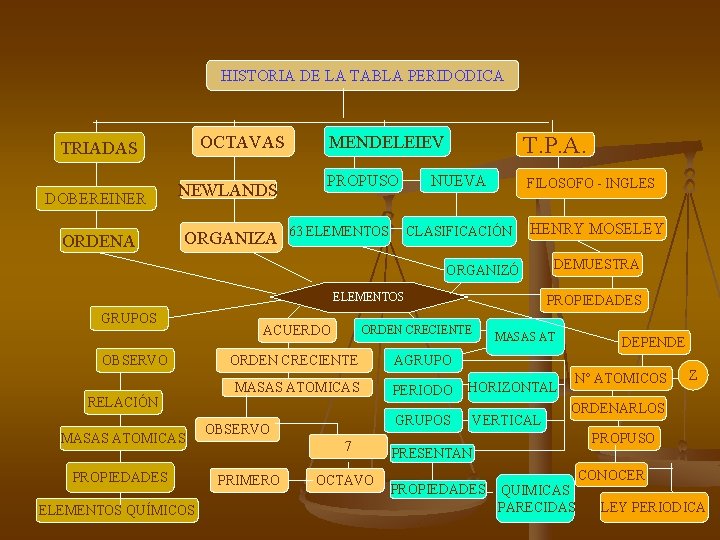
HISTORIA DE LA TABLA PERIDODICA OCTAVAS TRIADAS DOBEREINER NEWLANDS ORDENA ORGANIZA MENDELEIEV T. P. A. PROPUSO FILOSOFO - INGLES 63 ELEMENTOS NUEVA CLASIFICACIÓN HENRY MOSELEY ORGANIZÓ ELEMENTOS GRUPOS OBSERVO RELACIÓN MASAS ATOMICAS PROPIEDADES ELEMENTOS QUÍMICOS ACUERDO AGRUPO MASAS ATOMICAS PERIODO 7 OCTAVO MASAS AT HORIZONTAL GRUPOS OBSERVO PRIMERO PROPIEDADES ORDEN CRECIENTE DEMUESTRA VERTICAL DEPENDE N° ATOMICOS ORDENARLOS PROPUSO PRESENTAN PROPIEDADES Z QUIMICAS PARECIDAS CONOCER LEY PERIODICA

TABLA PERIODICA ACTUAL n n n Los químicos siempre han sentido la necesidad de clasificar los elementos para facilitar su estudio y el de los compuestos. Se intentaron varias clasificaciones, casi todas con defectos. En 1914 HENRY MOSELEY propone una clasificación sin los defectos de las anteriores.

n n Planteó la siguiente Ley Periódica: “Las propiedades físicas y químicas de los elementos son función periódica de la configuración electrónica y varían con el incremento de los números atómicos”. Para poner de manifiesto la reaparición de las propiedades se acostumbra a colocar a los elementos en la disposición llamada TABLA O SISTEMA PERIÓDICO.

n n El SISTEMA PERIÓDICO está representado de la siguiente forma: 1. GRUPOS O FAMILIAS: ordenaciones verticales de elementos. a) Grupos Principales: 1 -2 -13 -14 -15 -16 -1718. b) Grupos Secundarios: 3 -4 -5 -6 -7 -8 -9 -1011 -12 -13.

Los Grupos en la Tabla Periódica Los grupos con mayor número de elementos (1, 2, 13, 14, 15, 16, 17 y 18), se conocen como grupos principales, ubican su ultimo electrón en el ultimo nivel (orbital “s” u orbital “p”).

GRUPOS n Grupo Representativo “A” IA ns 1 ALCALINOS E IIA ns 2 ALCALINOS TERREOS E IIIA ns 2 np 1 BOROIDES E IVA ns 2 np 2 CARBONOIDES E VA ns 2 np 3 NITROGENOIDES E VIA ns 2 np 4 CALCOGENOS ó Anfigenos E VIIA ns 2 np 5 HALOGENOS E VIIIA ns 2 np 6 GASES NOBLES E

n Grupo de Transición “B” IIIB (n-1)d 1 ns 2 Fam. Scanio IVB (n-1)d 2 ns 2 Fam. Titanio VB (n-1)d 3 ns 2 Fam. Vanadio VIB (n-1)d 4 ns 2 Fam. Cromo VIIB (n-1)d 5 ns 2 Fam. Manganeso VIIIB (n-1)d 6 ns 2 Fam. del Hierro VIIIB (n-1)d 7 ns 2 Fam. del Cobalto VIIIB (n-1)d 8 ns 2 Fam. del Niquel IB (n-1)d 10 ns 1 Fam. del cobre IIB (n-1)d 10 ns 2 Fam. del Zinc

Análisis de la Tabla Periódica Actual Los grupos constan de 18 columnas verticales. Se nombran desde la izquierda a la derecha por números romanos y una letra A o B. También se designan con los números del 1 al 18. Periodos: Consta de 7 filas horizontales. Se numeran de arriba hacia abajo.

PERIODOS n Son siete filas horizontales señaladas con números arábigos ( 1; 2; 3, 4 ; 5; 6; 7). Los tres primeros son periódos cortos y los siguientes son largos.

Los Grupos en la Tabla Periódica Los elementos de la primera fila de elementos de transición interna se denominan lantánidos actínidos Los de la segunda fila son actínidos.

Capas de Valencia En las interacciones entre los distintos átomos sólo intervienen los electrones situados en la capa más externa. Los denominados electrones de valencia situados en la llamada capa de valencia, ya que al ser los electrones que se encuentran más lejanos del núcleo y más apantallados por los restantes electrones, son los que están retenidos más débilmente y los que con más facilidad se pierden. Todos los átomos tienden a tener en su capa de valencia únicamente ocho electrones. Así que el número real de electrones de su capa de valencia influirá también en sus propiedades.


Acomodo de orbitales en la Tabla Periódica El orden de los elementos en la tabla periódica, y la forma de ésta, con periodos de distintos tamaños, se debe a su configuración electrónica Una configuración especialmente estable es aquella en la que el elemento tiene en su última capa, la capa de valencia, 8 electrones, 2 en el orbital s y seis en los orbitales p, de forma que los orbitales s y p están completos. En un grupo, los elementos tienen la misma configuración electrónica en su capa de valencia. Así, conocida la configuración electrónica de un elemento sabemos su situación en la tabla y, a la inversa, conociendo su situación en la tabla sabemos su configuración electrónica.

Acomodo de orbitales en la Tabla Periódica Los primeros dos grupos están completando orbitales s, el correspondiente a la capa que indica el periodo. Así, el rubidio, en el quinto periodo, tendrá es su capa de valencia la configuración 5 s 1, mientras que el bario, en el periodo sexto, tendrá la configuración 6 s 2.

Acomodo de orbitales en la Tabla Periódica Los grupos 3 a 12 completan los orbitales d de la capa anterior a la capa de valencia, de forma que hierro y cobalto, en el periodo cuarto, tendrán las configuraciones 3 d 64 s 2 y 3 d 74 s 2, en la que la capa de valencia no se modifica pero sí la capa anterior. 4 5 6 7

Los Grupos en la Tabla Periódica Los grupos del 3 al 12 (identificados con letra B), están formados por los llamados elementos de transición Estos grupos (B), contienen los elementos que al desarrollar su configuración electrónica ubican su ultimo electrón en un nivel que no es el ultimo. Son elementos de transición externa si ubican su ultimo electrón en el penúltimo nivel (orbital “d”). Son elementos de transición interna los que ubican el ultimo electrón en el antepenúltimo nivel (orbital “f”).

Acomodo de orbitales en la Tabla Periódica Finalmente, en los elementos de transición interna, los elementos completan los orbitales f de su antepenúltima capa. 6 7

Acomodo de orbitales en la Tabla Periódica

Ejercicio. . . n De acuerdo a los criterios entregados anteriormente, clasifique los siguientes elementos: Cl, Cu, Sc, Ar, Zn, He, Po.
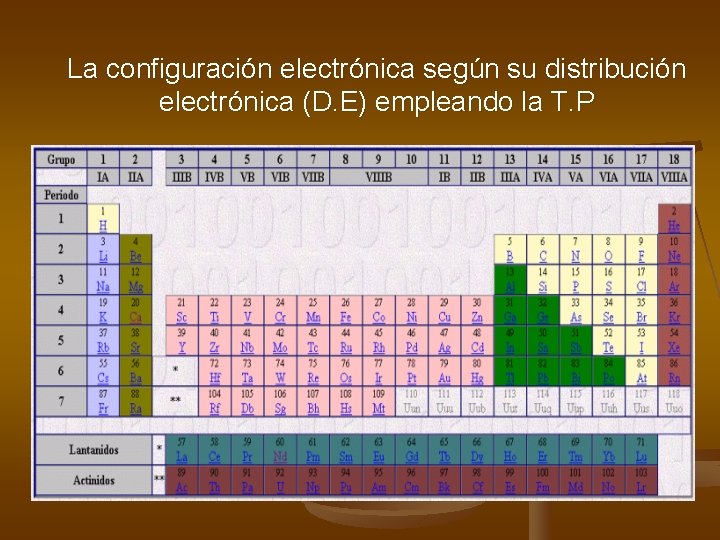
La configuración electrónica según su distribución electrónica (D. E) empleando la T. P

Para determinar la celda de cada elemento, en la cual se asigna su símbolo, hay que definir la columna (vertical) y la fila (horizontal), conocidas como Grupo y Periodo, basados en su distribución electrónica (DE) La columna (grupo)está dada por la “terminación” de la DE La fila (período), está dada por el máximo coeficiente del subnivel s Celda Como las columnas están dadas por la terminación de la DE, en la tabla periódica actual existen cuatro zonas: Zona s con dos columnas: s 1 y s 2 Zona p con seis columnas: desde p 1 hasta p 6 Zona d con diez columnas: desde d 1 hasta d 10 Zona f con catorce columnas: desde f 1 hasta f 14

Columna (Grupo), si la DE termina en: Øs se encuentra en la zona s, grupo A, columna I o II, depende de los electrones que estén en el subnivel. (en s solo puede haber 1 o 2). Ø p se encuentra en la zona p, grupo A, columna desde III a VIII (6 columnas), éste número resulta de sumar los electrones del subnivel s y p del mismo nivel. Ød se encuentra en la zona d, grupo B, columna desde III a II (10 columnas), se relacionan de acuerdo a los electrones presentes en este subnivel. III IV V VI VIII I II Fila (Periodo): Es el nivel mas alto en el que termina la DE y esta determinado por el subnivel s (el número mas alto que acompaña a s)

Si termina en: Ø s, está en la zona s grupo A la columna depende de los electrones que estén en el subnivel y como el subnivel s solo puede alojar 1 o 2 electrones (e-) estará en la columna I o II. Periodo 4 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 Grupo II A Ø p, está en la zona p, grupo A, la columna será la suma de los electrones presentes en s y p del mismo nivel. Grupo VIII A 1 s 2 2 p 6 3 s 2 3 p 6 Periodo 3

Ø d, está en la zona d, grupo B, la columna depende de los electrones que estén presentes en el subnivel, (orbital), si es 1 e- (d 1 ), está en la columna III y así sucesivamente como se indico en diapositiva anterior. Periodo 4 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 5 Grupo VII B III IV V VI VIII I II
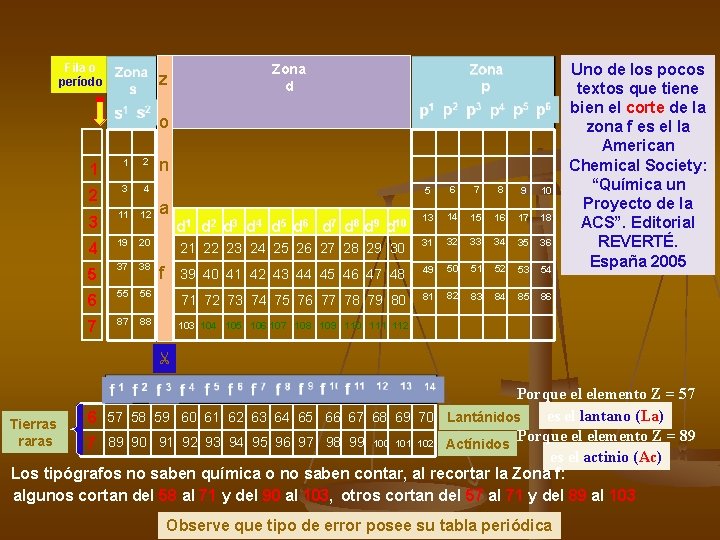
Fila o período z Zona d o 1 1 2 2 3 4 3 11 12 4 19 20 5 37 38 6 55 7 87 n 5 6 7 8 9 10 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9 d 10 13 14 15 16 17 18 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 56 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 88 103 104 105 106 107 108 109 110 111 112 a f Uno de los pocos textos que tiene bien el corte de la zona f es el la American Chemical Society: “Química un Proyecto de la ACS”. Editorial REVERTÉ. España 2005 Porque el elemento Z = 57 es el lantano (La) 6 57 58 59 60 61 62 63 64 65 66 67 68 69 70 Lantánidos Tierras raras 7 89 90 91 92 93 94 95 96 97 98 99 100 101 102 Actínidos Porque el elemento Z = 89 es el actinio (Ac) Los tipógrafos no saben química o no saben contar, al recortar la Zona f: algunos cortan del 58 al 71 y del 90 al 103, otros cortan del 57 al 71 y del 89 al 103 Observe que tipo de error posee su tabla periódica

Fila o período Zona d z p 1 p 2 p 3 p 4 p 5 p 6 o grupos II I 1 2 He 4 3 Zona p III n IV V VI 1 VIII 2 H 1 He 6 7 8 5 9 10 2 Li Be B C N O F Ne 11 12 a 13 14 15 16 17 18 3 Na Mg d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9 d 10 Aℓ Si P S Cℓ Ar 31 32 33 34 35 36 19 20 4 K Ca 21 22 23 24 25 26 27 28 29 30 Ga Ge As Se Br Kr 37 38 49 50 51 52 53 54 5 Rb Sr f 39 40 41 42 43 44 45 46 47 48 In Sn Sb Te I Xe 55 56 6 Cs Ba 88 7 Fr 87 Ra 82 84 103 104 105 106 107 108 109 110 111 112 Alcalino térreos alcalinos notas 83 86 71 72 73 74 75 76 77 78 79 80 Tℓ 81 Pb Bi Po At 85 Rn Gases nobles halógenos El helio (He), Z=2 exige estar a la derecha del período 1 El hidrógeno (H), Z=1 puede estara la izquierda del helio oa la izquierda del período 1 (como volando) Los elementos de las zonas s y p forman los grupos A de la tabla periódica y son ocho, se conocen c elementos representativos, el número del grupo coincide con el número de electrones de valencia

Los elementos de la zona d se llaman “elementos de transición” y forman los subgrupos Fila o período Se llaman de transición porque algunos de ellos auto modifican su DE haciendo una transición de uno o dos electrones desde el último subnivel s hasta el último subnivel d, generando una DE “excitada”. Z d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9 d 10 4 21 22 23 24 25 26 27 28 29 30 5 39 40 41 42 43 44 45 46 47 48 6 71 72 73 74 75 76 77 78 79 80 7 103 104 105 106 107 108 109 110 111 112 D. E. normal D. E. excitada Fila # de e- transferidos. 24 Cr 1 s. . . 4 s 2 / 3 d 4 1 s. . . 4 s 1 / 3 d 5 4 1 29 Cu 1 s. . . 4 s 2 / 3 d 9 1 s. . . 4 s 1 / 3 d 10 4 1 41 Nb 1 s. . . 5 s 2 / 4 d 3 1 s. . . 5 s 1 / 4 d 4 5 1 42 Mo 1 s. . . 5 s 2 / 4 d 4 1 s. . . 5 s 1 / 4 d 5 5 1 43 Tc 1 s. . . 5 s 2 / 4 d 5 1 s. . . 5 s 1 / 4 d 6 5 1 44 Ru 1 s. . . 5 s 2 / 4 d 6 1 s. . . 5 s 1 / 4 d 7 5 1 45 Rh 1 s. . . 5 s 2 / 4 d 7 1 s. . . 5 s 1 / 4 d 8 5 1 46 Pd 1 s. . . 5 s 2 / 4 d 8 1 s. . . 5 s 0 / 4 d 10 5 2 47 Ag 1 s. . . 5 s 2 / 4 d 9 1 s. . . 5 s 1 / 4 d 10 5 1 77 Ir 1 s. . . 6 s 2 / 4 f 145 d 7 1 s. . . 6 s 0 / 4 f 145 d 9 6 2 78 Pt 1 s. . . 6 s 2 / 4 f 145 d 8 1 s. . . 6 s 1 / 4 f 145 d 9 6 1 79 Au 1 s. . . 6 s 2 / 4 f 145 d 9 1 s. . . 6 s 1 / 4 f 145 d 10 6 1 Estos son los elementos que presentan modificación de la DE

Clasificación periódica de los elementos 1. Elementos representativos: Se distribuyen a lo largo de casi todos los grupos. Se excluyen los elementos del grupo 3 al 12 y el grupo 18. Tienen todos sus niveles completos a excepción del último. La configuración electrónica más externa comprende aquellas que van desde: ns 1 hasta ns 2 np 5

n 2. Elementos de transición: Son los correspondientes a los grupos 3 al 12 y se caracterizan por presentar el penúltimo subnivel d y /o el último niveles incompleto. La configuración electrónica externa de estos elementos, en general se puede representar como: (n-1)d 1 -----9 ns 2 3. Elementos de transición interna: Tienen un subnivel incompleto, el f. Estos elementos corresponden a los períodos 6 y 7 y no se clasifican en grupos.

n 4. Elementos Inertes o gases nobles: Se ubican en el grupo 18 y se caracteriza por tener todos sus niveles energéticos completos. Su configuración externa se representa por ns 2 np 6 a excepción del He que tiene una configuración del tipo 1 s 2.

Otra clasificación: metales, no metales y metaloides.

RADIO ATOMICO ENERGIA DE IONIZACION ELECTRONEGATIVIDAD CARÁCTER METALICO Variación en la Tabla Periódica

n Es la mitad de la distancia entre los centros de dos átomos vecinos o es la distancia promedio entre el último electrón del nivel más externo y el núcleo.

n LOS RADIOS ATOMICOS AUMENTAN EN TERMINOS GENERALES HACIA ABAJO EN UN GRUPO Y DISMINUYEN A LO LARGO DE UN PERIODO


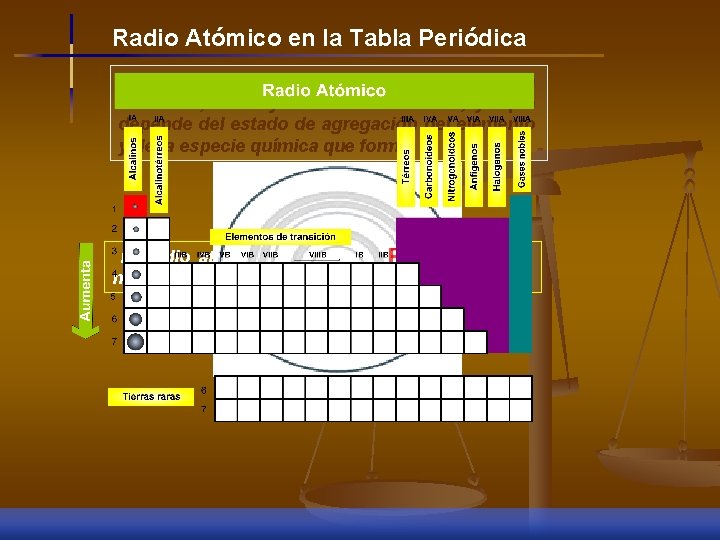
Radio Atómico en la Tabla Periódica El radio atómico, es decir, el tamaño exacto de un átomo, es muy difícil de determinar, ya que depende del estado de agregación del elemento y de la especie química que forma. El radio atómico dependerá de la distancia al núcleo de los electrones de la capa de valencia

Radio atómico: Distancia promedio que existe entre el núcleo de un átomo y la capa electrónica más externa. Grupo VII-A 9 F 17 Cl 35 Br 53 I radio atómico (Å) 0. 72 0. 99 1. 14 1. 33 Angstrom (Å): Unidad de medida de longitud siendo equivalente a 1 x 10 -10 m, no se utiliza en el Sistema Internacional de Unidades ( SI).

Período 2 / Elemento radio atómico (Å) 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 1. 34 0. 90 0. 82 0. 77 0. 75 0. 73 0. 72 1. 31
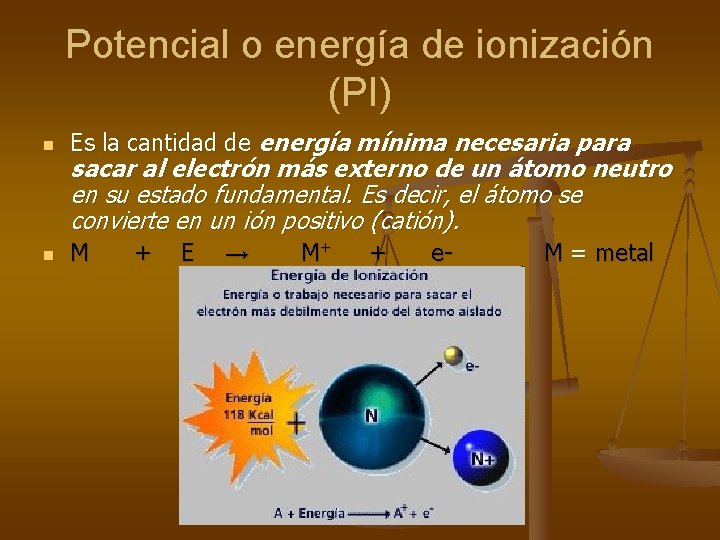
Potencial o energía de ionización (PI) n Es la cantidad de energía mínima necesaria para n M + E → M+ + e- sacar al electrón más externo de un átomo neutro en su estado fundamental. Es decir, el átomo se convierte en un ión positivo (catión). M = metal

Se define como la energía que se requiere para sacar al electrón más externo de un átomo neutro. La energía de ionización de un átomo mide que tan fuerte este retiene a sus electrones La energía de ionización es la energía mínima requerida para quitar un electrón de un átomo aislado gaseoso en su estado basal Ojo esto no se refiere a la energía requerida para quitar un electrón de las capas internas, acuérdate que esos están mas agarrados al átomo, porque están más cerca y porque les toca más carga del núcleo. Aquí nos referimos al estado basal del átomo completo, entonces el electrón que saldrá será el que tiene menos energía es decir el más lejano al núcleo. Para quitar los electrones restantes se requiere cada vez más energía (es decir la energía de ionización es mayor para cada electrón subsiguiente)

Variación en la TP n En un periodo, el PI aumenta de izquierda a derecha. En un grupo, el PI aumenta de abajo hacia arriba. Aumenta n Potencial de Ionización

Energía de ionizacion: Energía mínima necesaria para separar el electrón menos fuertemente atraído por un átomo aislado con la formación correspondiente de un ión (catión) monopositivo, también aislado. Grupo I-A 3 Li 11 Na 19 K 37 Rb 55 Cs energía de ionización (kcal / mol) 124 119 100 96 90 Se expresa en kcal / mol, k. J. Mol-1 o en e. V. mol-1

Período 2 / Elemento energía de ionización (kcal / mol) 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 124 215 191 260 336 314 402 497

Afinidad electrónica o electroafinidad (AE): n n Es la energía liberada cuando un átomo en estado neutro gana un electrón, para convertirse en un ión negativo (anión). X + e- → X- X = no metal

Variación en la TP n En un periodo, la AE aumenta de izquierda a derecha al aumentar el Z. En un grupo, la AE disminuye de arriba hacia abajo al aumentar el Z. Disminuye n

Electroafinidad: Cantidad de energía liberada cuando un átomo gana un electrón. . Grupo VII-A 9 F 17 Cl 35 Br 53 I electroafinidad (e. V) 3. 6 3. 75 3. 53 3. 2 Electrón - volt : La energía en los procesos elementales se mide en electrón-volt. Un electrón - volt (e. V) es la energía de un electrón acelerado a través de una diferencia de potencial de un volt.

Período 2 / Elemento electroafinidad (k. J / mol) O / O - 2 F / F - 1 - 15 919. 0 8 685. 0

Afinidad Electrónica en la Tabla Periódica La afinidad electrónica se define como la energía que liberará un átomo (elemento no metal), en estado gaseoso, cuando captura un electrón y se convierte en un ión negativo o anión. Como el potencial de ionización, la afinidad electrónica dependerá de la atracción del núcleo por el electrón que debe capturar, de la repulsión de los electrones existentes y del acercamiento o alejamiento a completar la capa de valencia con ocho electrones. Mientras que el potencial de ionización se puede medir directamente y con relativa facilidad, la medición de la afinidad electrónica es complicada y sólo en muy pocos casos puede realizarse de forma directa y los datos que se tienen no son fiables.
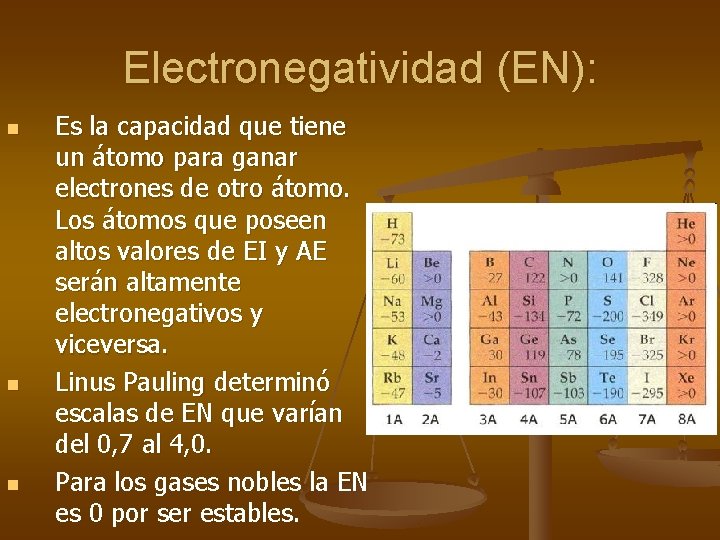
Electronegatividad (EN): n n n Es la capacidad que tiene un átomo para ganar electrones de otro átomo. Los átomos que poseen altos valores de EI y AE serán altamente electronegativos y viceversa. Linus Pauling determinó escalas de EN que varían del 0, 7 al 4, 0. Para los gases nobles la EN es 0 por ser estables.

Variación en la TP n En un periodo aumenta hacia la derecha. En un grupo aumenta hacia arriba. Aumenta n

Electronegatividad: Poder de atracción que ejerce una especie sobre el par de electrones compartidos. Grupo VII- electronegatividad (Escala de Pauling) A 9 F 4 17 Cl 3 35 Br 2. 8 53 I 2. 5

Período 2 / Elemento electronegatividad (Escala de Pauling) 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 1. 0 1. 5 2. 0 2. 5 3. 0 3. 5 4. 0

VARIACIÓN DE LAS PROPIEDADES PERIÓDICAS EN EL SISTEMA PERIÓDICO

Propiedades periódicas Variación en un Grupo Radio atómico Carácter metálico Energía de ionización Electroafinidad Electronegatividad Aumenta Disminuye Variación en un período Disminuye Aumenta
- Slides: 56