LA SPECTROSCOPIE PLAN INTRODUCTION GENERALITES PRINCIPES ET PHENOMENES

































- Slides: 69

LA SPECTROSCOPIE

PLAN • INTRODUCTION • GENERALITES • PRINCIPES ET PHENOMENES PHYSIQUES Ø Déplacement chimique, interaction spin-spin et couplage. Ø Matériel et logiciel requis en SRM Ø Homogénéité du champs , rapport signal/bruit et qualité du spectre Ø Spectroscopie mono-Voxel Ø Imagerie spectroscopique • MÉTABOLITES EXPLORÉS EN SRM ET NOYAU D’HYDROGÈNE • PRINCIPALES APPLICATIONS CLINIQUES EN SRM Ø Neurologie Ø Autres applications

INTRODUCTION

• La spectroscopie par résonance magnétique permet une exploration non invasive et in vivo de la composition moléculaire des tissus. • Identifier les métabolites, impliqués dans des processus physiologiques ou pathologiques. Noyaux d'hydrogène+++ • Développement d'antennes plus efficaces, une meilleure maîtrise des gradients, des champs plus élevés >>> Applications plus larges++

GENERALITES

• Grâce aux propriétés de résonance du noyau protonique et à son caractère ubiquitaire au sein de l’organisme, l’exploration de la composition moléculaire d’un tissu est possible. • La spectroscopie utilise deux phénomènes physiques essentiels: Ø Le déplacement chimique Ø Le couplage de spin.

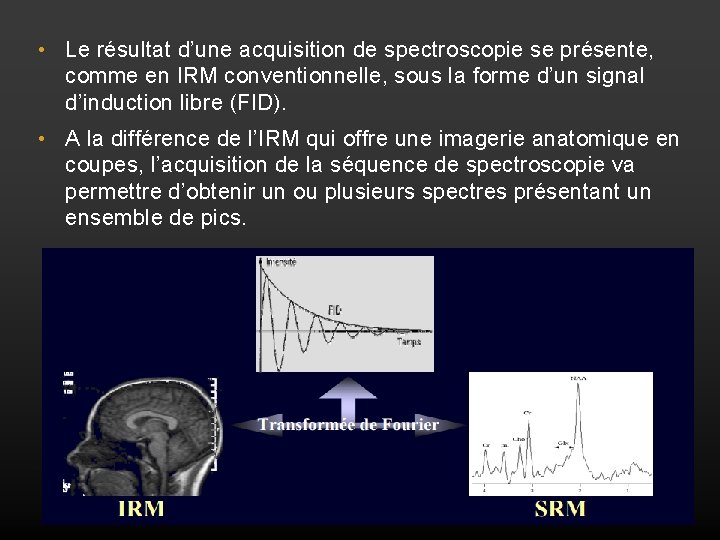
• Le résultat d’une acquisition de spectroscopie se présente, comme en IRM conventionnelle, sous la forme d’un signal d’induction libre (FID). • A la différence de l’IRM qui offre une imagerie anatomique en coupes, l’acquisition de la séquence de spectroscopie va permettre d’obtenir un ou plusieurs spectres présentant un ensemble de pics.

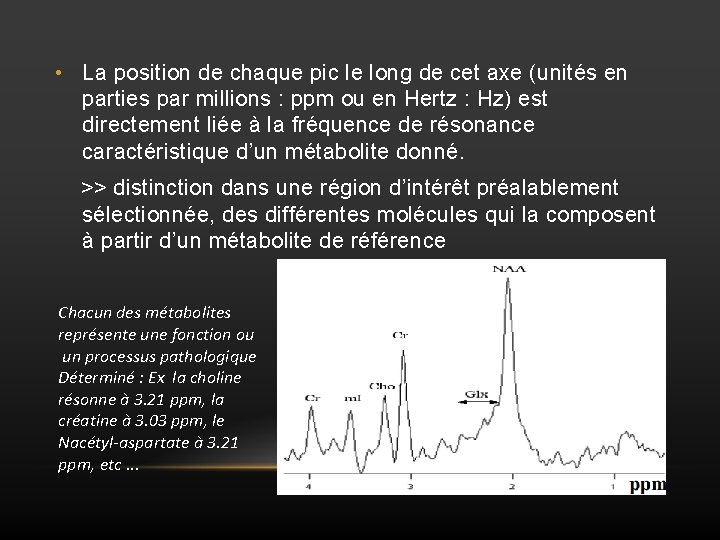
• La position de chaque pic le long de cet axe (unités en parties par millions : ppm ou en Hertz : Hz) est directement liée à la fréquence de résonance caractéristique d’un métabolite donné. >> distinction dans une région d’intérêt préalablement sélectionnée, des différentes molécules qui la composent à partir d’un métabolite de référence Chacun des métabolites représente une fonction ou un processus pathologique Déterminé : Ex la choline résonne à 3. 21 ppm, la créatine à 3. 03 ppm, le Nacétyl-aspartate à 3. 21 ppm, etc. . .

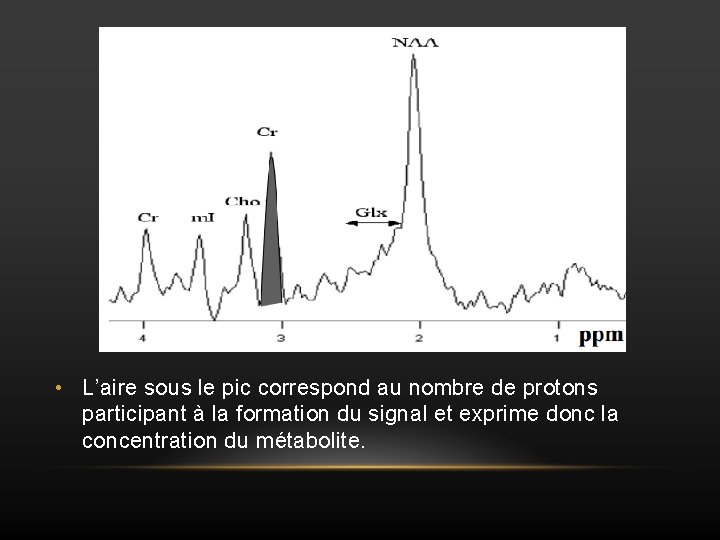
• L’aire sous le pic correspond au nombre de protons participant à la formation du signal et exprime donc la concentration du métabolite.

PRINCIPES ET PHÉNOMÈNES PHYSIQUES

1. Déplacement Chimique, Interaction Spinspin Et Couplage. 2. Matériel Et Logiciel Requis En SRM 3. Homogénéité Du Champs , Rapport Signal/Bruit Et Qualité Du Spectre 4. Spectroscopie Mono-Voxel 5. Imagerie Spectroscopique

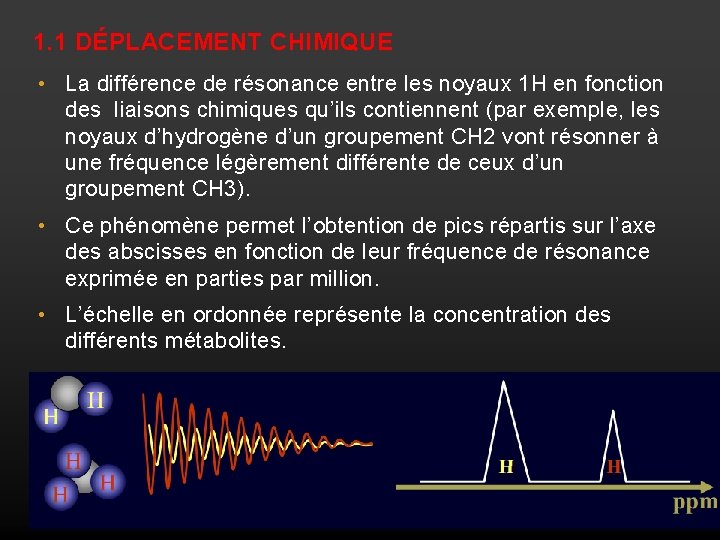
1. 1 DÉPLACEMENT CHIMIQUE • La différence de résonance entre les noyaux 1 H en fonction des liaisons chimiques qu’ils contiennent (par exemple, les noyaux d’hydrogène d’un groupement CH 2 vont résonner à une fréquence légèrement différente de ceux d’un groupement CH 3). • Ce phénomène permet l’obtention de pics répartis sur l’axe des abscisses en fonction de leur fréquence de résonance exprimée en parties par million. • L’échelle en ordonnée représente la concentration des différents métabolites.

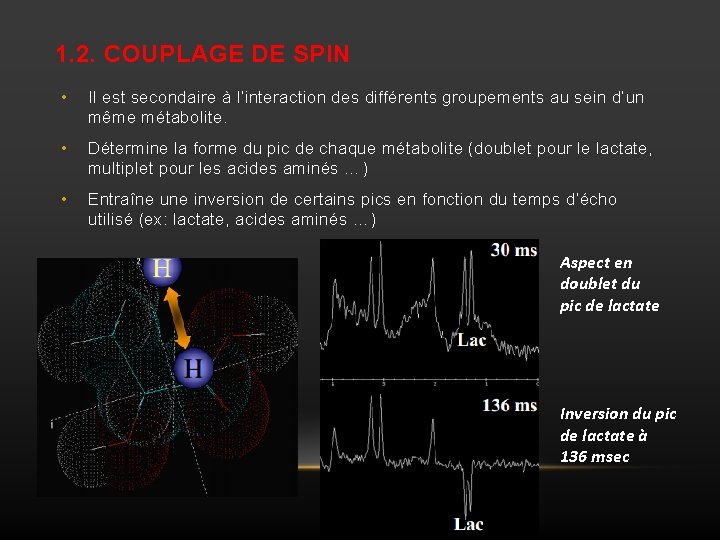
1. 2. COUPLAGE DE SPIN • Il est secondaire à l’interaction des différents groupements au sein d’un même métabolite. • Détermine la forme du pic de chaque métabolite (doublet pour le lactate, multiplet pour les acides aminés …) • Entraîne une inversion de certains pics en fonction du temps d’écho utilisé (ex: lactate, acides aminés …) Aspect en doublet du pic de lactate Inversion du pic de lactate à 136 msec

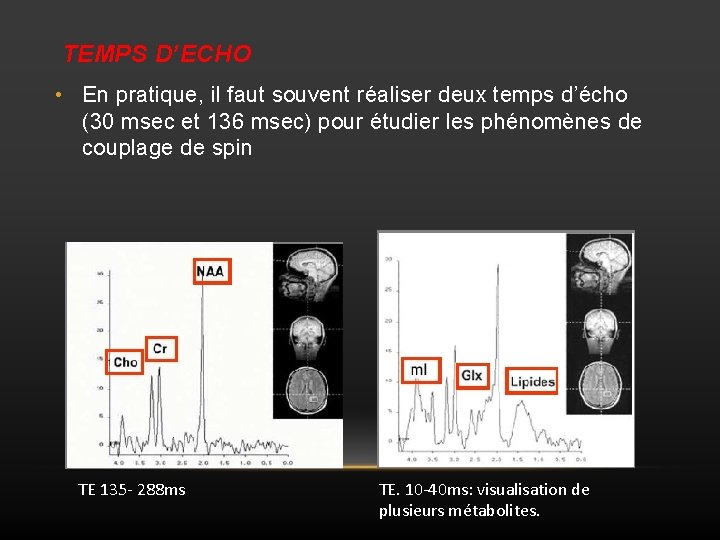
1. 3. TEMPS D’ECHO • Paramètre primordial en spectroscopie car en plus d’intervenir dans les phénomènes de couplage de spin, il détermine le nombre de métabolites détectables : Ø Un TE court permet de visualiser de nombreux métabolites mais l’interprétation spectrale et la quantification des métabolites sont délicates (avec superposition des différents pics si la résolution spectrale n’est pas suffisante). Ø Un temps d’écho intermédiaire ou long montre moins de métabolite mais la quantification est plus facile.

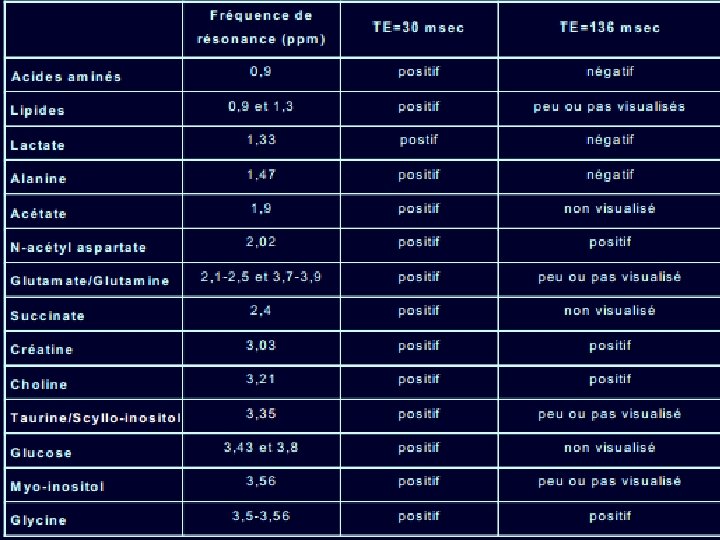
TEMPS D’ECHO • En pratique, il faut souvent réaliser deux temps d’écho (30 msec et 136 msec) pour étudier les phénomènes de couplage de spin TE 135 - 288 ms TE. 10 -40 ms: visualisation de plusieurs métabolites.

3. MATÉRIEL ET LOGICIELS REQUIS EN SRM • Un champ magnétique suffisamment puissant et très homogène, pour discerner les pics de résonance (au moins 1, 5 T) • Séquences spécifiques: deux types: Ø la spectroscopie MONOVOXEL qui ne recueille le spectre que d’un seul voxel. Ø Spectroscopie MULTIVOXEL: imagerie spectroscopique qui mesure les spectres en projection (1 D), sur une coupe (2 D) ou un volume (3 D). • Des logiciels de traitement des données adaptés

4. Homogénéité de champ, rapport signal / bruit et qualité du spectre: • Avant toute acquisition de SRM, une homogénéisation du champ magnétique (shimming) est effectuée sur la région d’intérêt. • Plus cette région est grande, plus il sera difficile de rendre le champ magnétique homogène sur son ensemble. • La qualité d’un spectre s’évalue sur deux critères principaux : Ø le rapport signal/bruit (hauteur des pics de métabolites par rapport au bruit de fond) Ø la résolution spectrale (largeur des pics, qui déterminent la possibilité de bien séparer les différents métabolites).

5. SPECTROSCOPIE MONOVOXEL q Réalisation d’une seule acquisition après avoir déterminé un volume d’intérêt de 1 à 10 cm 3. q Application: Lésions focales homogènes car son volume d’exploration est unique et petit. q 3 étapes : 1. Suppression du signal de l’eau : la quantité de noyaux d’hydrogène de molécules d’eau est telle dans l’organisme humain que le pic de l’eau à 4, 7 ppm "noie" et masque le signal spectroscopique des autres métabolites. Il est donc indispensable de supprimer le pic de l’eau pour observer les métabolites d’intérêt. 2. Sélection du voxel d’intérêt 3. Acquisition du spectre

SPECTROSCOPIE MONVOXEL • L’acquisition du signal provenant du voxel sélectionné peut être effectuée par deux types de séquences différentes : q STEAM (STimulated Echo Acquisition Mode) • succession de trois impulsions de radiofréquence de 90°. • utilisée lorsque l’on veut obtenir des temps d’écho très courts. • plus fiable dans la qualité de la localisation, mais présente un moins bon rapport signal sur bruit. q PRESS (Point Resolved Spectroscopy Select) : • première impulsion de radiofréquence de 90° dans l’axe X, une seconde impulsion de 180° dans l’axe Z et enfin une troisième impulsion de 180° selon l’axe Y. • présente un meilleur rapport signal sur bruit.

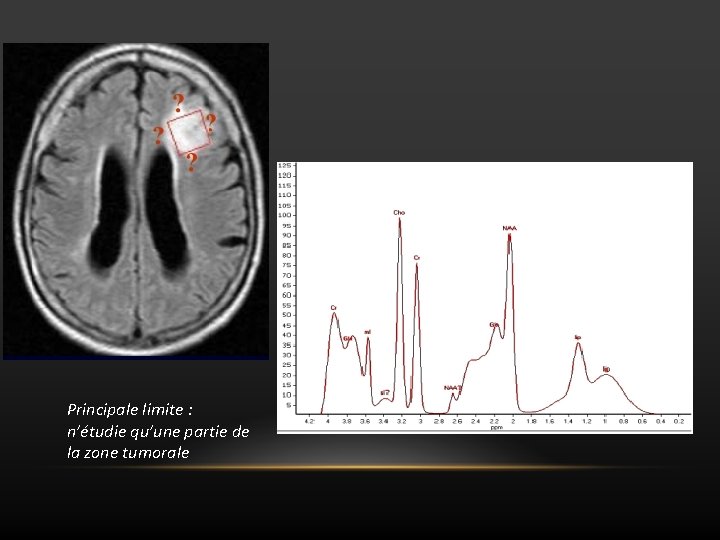
SPECTROSCOPIE MONVOXEL q Avantages • Acquisition rapide (2 à 4 min) • Traitement des données facile (1 seul spectre à traiter) • Bonne reproductibilité notamment à TE court q Inconvénients • Ne permet pas d’étudier les différentes composantes d’une lésion hétérogène • Ne permet pas d’étudier les limites de la tumeur • Risque de spectre normal dans l’étude des petites lésions (volume partiel) >>>>>Il faut dans ce cas essayer de réduire au maximum la taille du voxel pour que celui ci ne contienne que la lésion, en prenant soin d’augmenter le nombre d’acquisitions pour compenser la baisse du rapport signal sur bruit

Principale limite : n’étudie qu’une partie de la zone tumorale

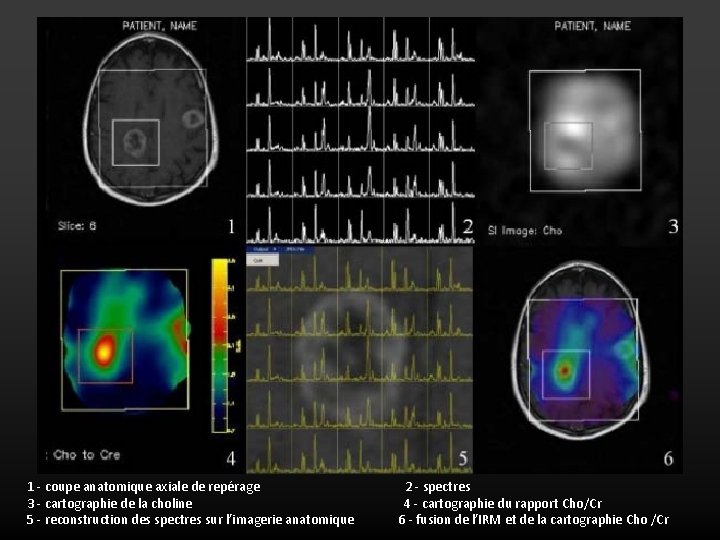
6. Spectroscopie MULTIVOXEL ou imagerie spectroscopique • L’acquisition de multiples spectres dans un volume d’intérêt, réalisant ainsi une cartographie métabolique. • Le principe de localisation reste similaire lorsque l’on réalise une spectroscopie multivoxel mais la région étudiée est ici définie par l’intersection de deux plans de coupes au lieu de trois. • L’acquisition de la séquence (appelée volume selective 2 D) repose sur le principe de l’excitation de sélection de volume : les spins contenus dans la région d’intérêt sont excités sélectivement, en excluant les spins situés en dehors de cette région

1 - coupe anatomique axiale de repérage 3 - cartographie de la choline 5 - reconstruction des spectres sur l’imagerie anatomique 2 - spectres 4 - cartographie du rapport Cho/Cr 6 - fusion de l’IRM et de la cartographie Cho /Cr

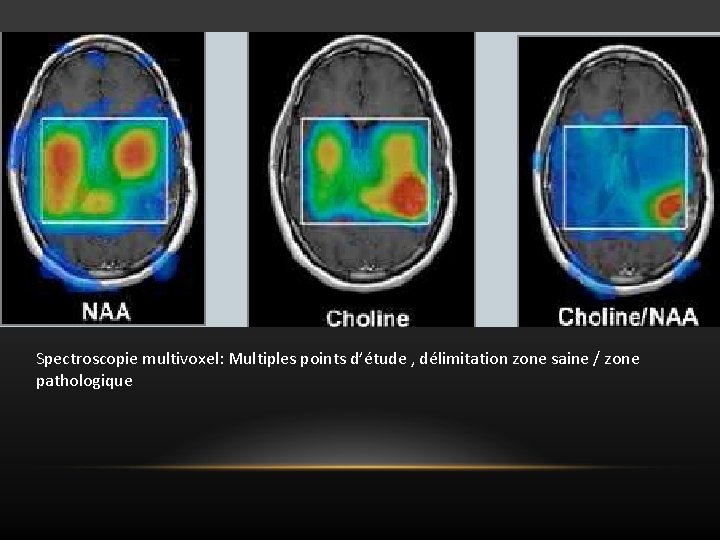
SPECTROSCOPIE MULTIVOXEL OU IMAGERIE SPECTROSCOPIQUE Ø Avantages • Multitude de spectres • Etude des différentes régions d’une lésion hétérogène • Délimitation zone saine/zone pathologique (très utile en pathologie tumorale >>> permet de définir si une tumeur est infiltrante ou non) Ø Inconvénients • Acquisition plus longue (8 min) • Traitement des données délicat (multitude de spectres)

Spectroscopie multivoxel: Multiples points d’étude , délimitation zone saine / zone pathologique

MÉTABOLITES EXPLORÉS EN SRM DU NOYAU D’HYDROGÈNE

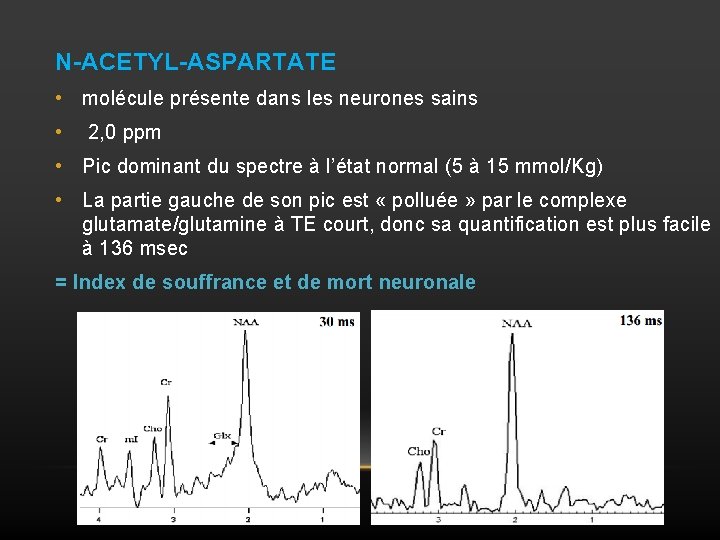
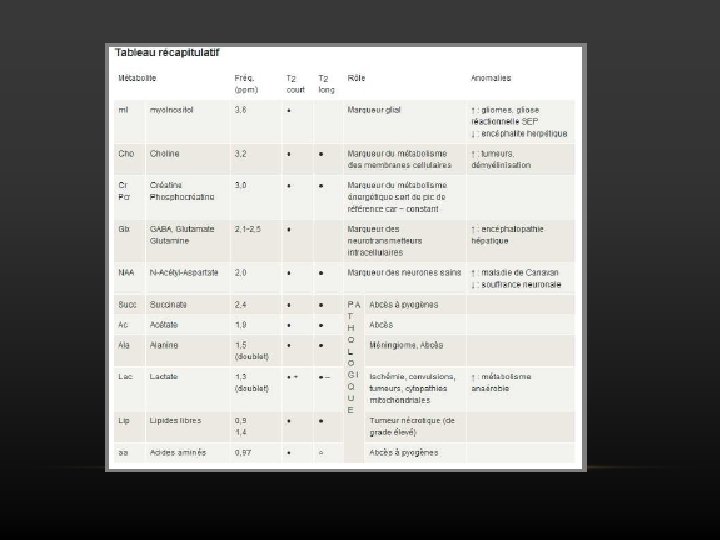
N-ACETYL-ASPARTATE • molécule présente dans les neurones sains • 2, 0 ppm • Pic dominant du spectre à l’état normal (5 à 15 mmol/Kg) • La partie gauche de son pic est « polluée » par le complexe glutamate/glutamine à TE court, donc sa quantification est plus facile à 136 msec = Index de souffrance et de mort neuronale

CREATINE • (Cr) Comprend la créatine, la phosphocréatine et l’acide γ -aminobutyrique • molécules du métabolisme énergétique • à 3, 0 ppm • Souvent utilisé comme référence car c’est un métabolite relativement stable à l’état normal et au cours des différents processus pathologiques

CHOLINE • 3. 21 ppm • Comprend la glycérophosphocholine, la phosphocholine et la choline libre • Reflet du métabolisme membranaire • Augmente dans de nombreux processus pathologiques (tumeurs, inflammation. . )

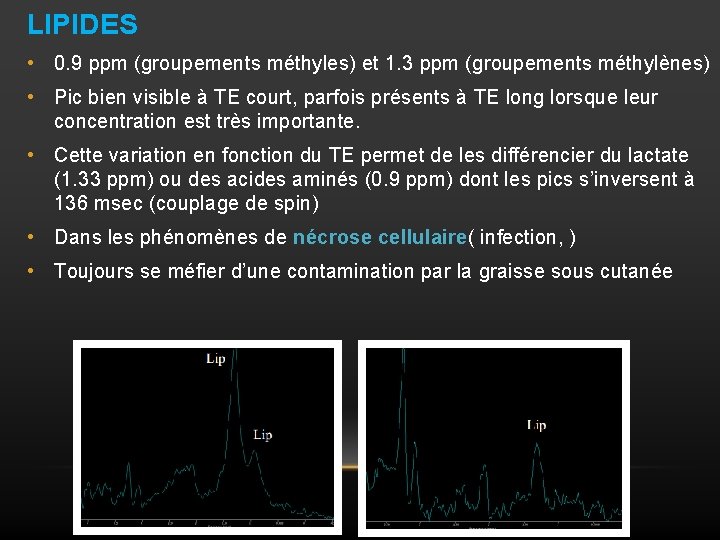
LIPIDES • 0. 9 ppm (groupements méthyles) et 1. 3 ppm (groupements méthylènes) • Pic bien visible à TE court, parfois présents à TE long lorsque leur concentration est très importante. • Cette variation en fonction du TE permet de les différencier du lactate (1. 33 ppm) ou des acides aminés (0. 9 ppm) dont les pics s’inversent à 136 msec (couplage de spin) • Dans les phénomènes de nécrose cellulaire( infection, ) • Toujours se méfier d’une contamination par la graisse sous cutanée

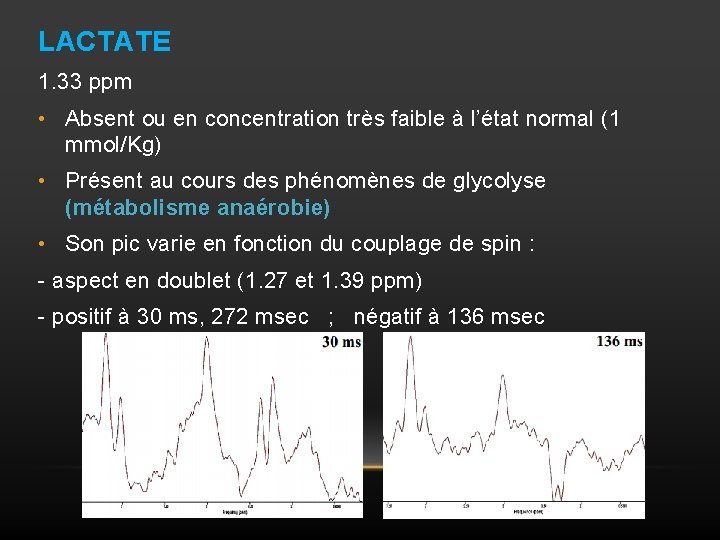
LACTATE 1. 33 ppm • Absent ou en concentration très faible à l’état normal (1 mmol/Kg) • Présent au cours des phénomènes de glycolyse (métabolisme anaérobie) • Son pic varie en fonction du couplage de spin : - aspect en doublet (1. 27 et 1. 39 ppm) - positif à 30 ms, 272 msec ; négatif à 136 msec

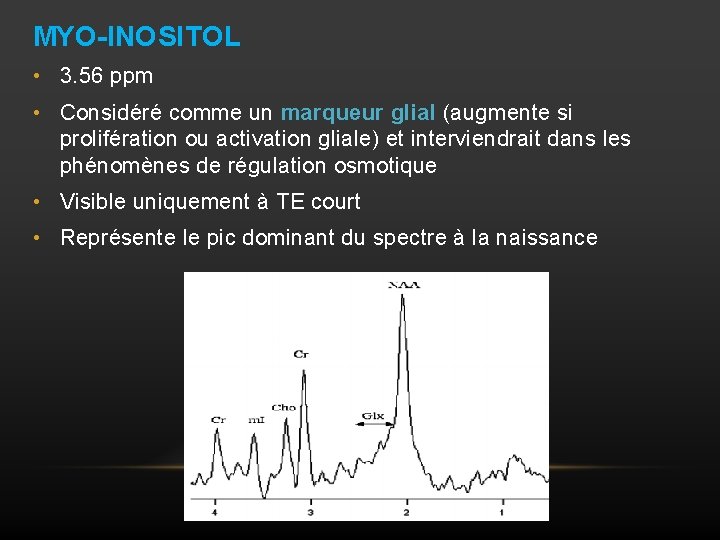
MYO-INOSITOL • 3. 56 ppm • Considéré comme un marqueur glial (augmente si prolifération ou activation gliale) et interviendrait dans les phénomènes de régulation osmotique • Visible uniquement à TE court • Représente le pic dominant du spectre à la naissance

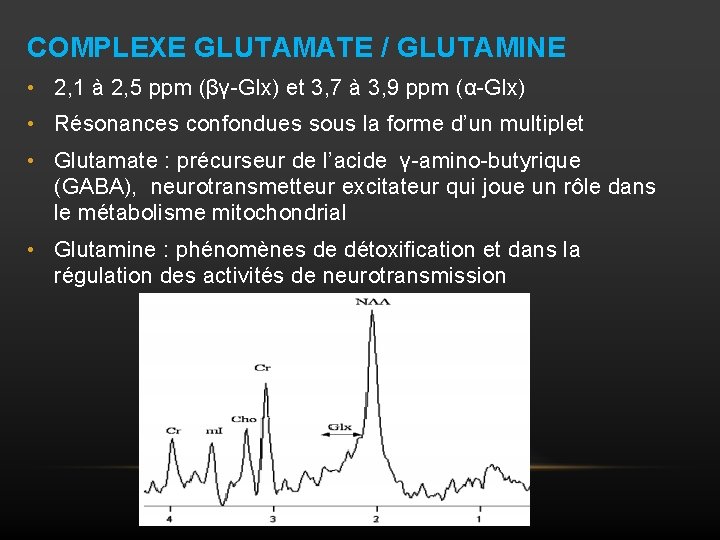
COMPLEXE GLUTAMATE / GLUTAMINE • 2, 1 à 2, 5 ppm (βγ-Glx) et 3, 7 à 3, 9 ppm (α-Glx) • Résonances confondues sous la forme d’un multiplet • Glutamate : précurseur de l’acide γ-amino-butyrique (GABA), neurotransmetteur excitateur qui joue un rôle dans le métabolisme mitochondrial • Glutamine : phénomènes de détoxification et dans la régulation des activités de neurotransmission

ACIDES AMINES • 0, 9 ppm • Forme de multiplet • Pic inversé à 136 msec (couplage de spin) permettant de les différencier du groupement méthyle des lipides • Ils comprennent la leucine, l’isoleucine et la valine (produits de dégradation des protéines) • Très évocateurs d’abcès cérébraux • Multiples: ALANINE: fonction précise mal connue TAURINE : stabilisation membranaire , osmolarité régulation du métabolisme calcique. Scyllo-inositol : augmente en cas d’intoxication éthylique chronique



PRINCIPALES APPLICATIONS CLINIQUES DE LA SRM

NEUROLOGIE

A. DEROULEMENT D’UNE SRM CEREBRALE: 1 - IRM conventionnelle ( +Gado) 2 - Sélection de la séquence et de ses paramètres o mono ou multivoxel o TE court, intermédiaire ou long o TR (environ 2500 ms en monovoxel, 1600 ms 2 D CSI) o Taille de la région d’intérêt (RSB VS volume partiel) o Matrice en multivoxel: 8 x 8 ou 16 x 16 cm 3 - Positionnement de la région d’intérêt 4 - Saturation de l’eau et des lipides 5 - Homogénéisation du champ magnétique 6 - Réglage des gradients 7 - Acquisition de la séquence • Monovoxel : 2 à 4 minutes • Multivoxel : 8 minutes

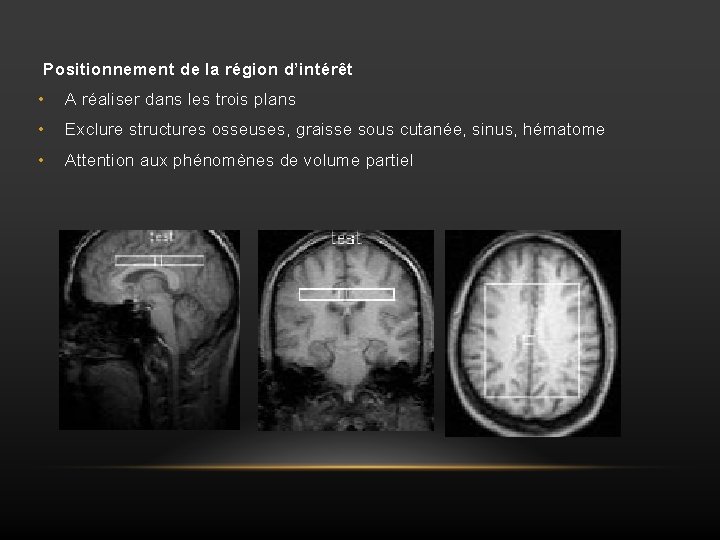
Positionnement de la région d’intérêt • A réaliser dans les trois plans • Exclure structures osseuses, graisse sous cutanée, sinus, hématome • Attention aux phénomènes de volume partiel

B. Etapes de l’analyse spectrale 1 - Apprécier la qualité du spectre 2 - Identifier les métabolites attendus 3 - Identifier les métabolites inattendus 4 - Réaliser une quantification relative des métabolites 5 - Reconnaître les variations physiologiques

C. APPLICATIONS CLINIQUES EN NEUROLOGIE: I. EN PATHOLOGIE TUMORALE: • Diagnostic positif • Grading tumoral • Orienter vers type histologique • Guidage de biposies • Suivi post thérapeutique • Diagnostic différentiel / abcès.

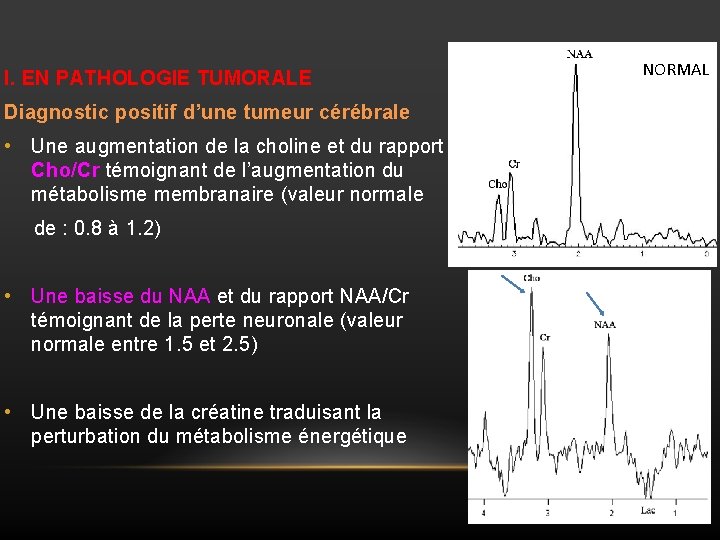
I. EN PATHOLOGIE TUMORALE Diagnostic positif d’une tumeur cérébrale • Une augmentation de la choline et du rapport Cho/Cr témoignant de l’augmentation du métabolisme membranaire (valeur normale de : 0. 8 à 1. 2) • Une baisse du NAA et du rapport NAA/Cr témoignant de la perte neuronale (valeur normale entre 1. 5 et 2. 5) • Une baisse de la créatine traduisant la perturbation du métabolisme énergétique NORMAL

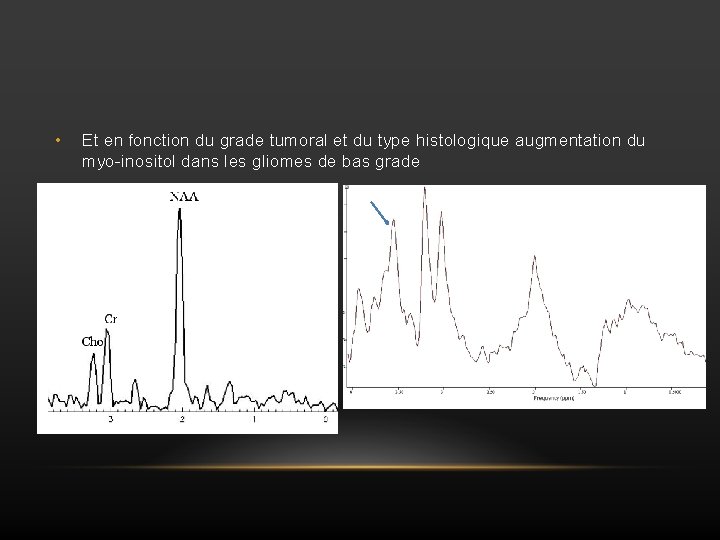
• Et en fonction du grade tumoral et du type histologique augmentation du myo-inositol dans les gliomes de bas grade

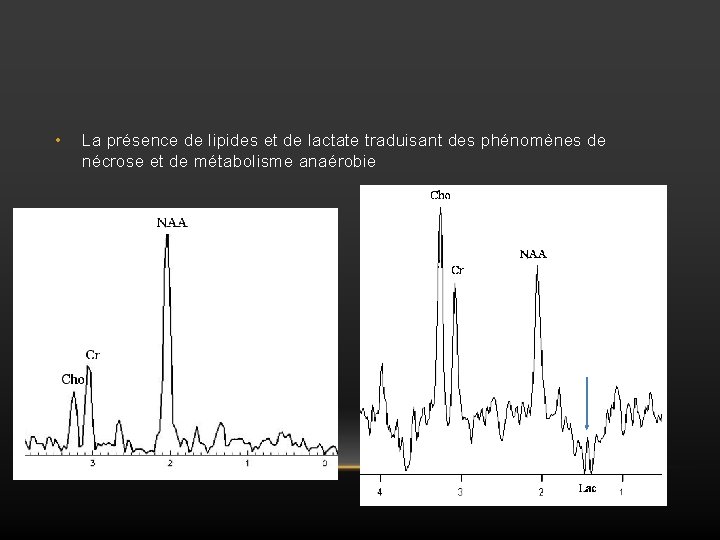
• La présence de lipides et de lactate traduisant des phénomènes de nécrose et de métabolisme anaérobie

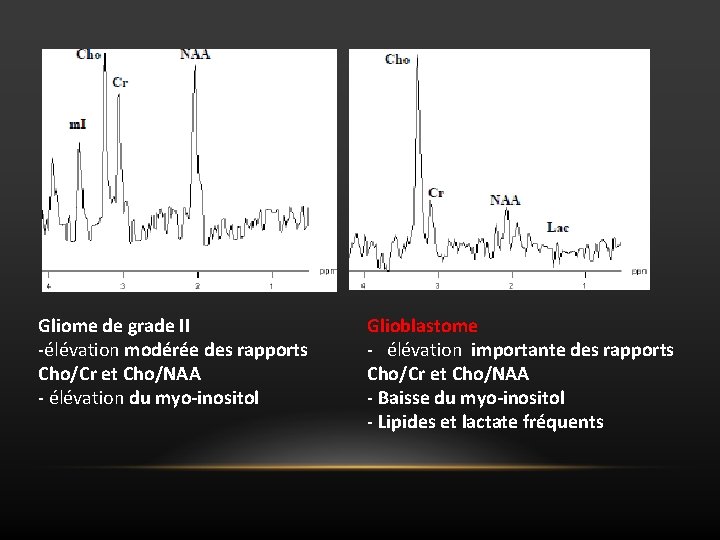
Evaluation du grade tumoral • Il existe différences statistiquement significatives de concentration de plusieurs métabolites en fonction de leur grade OMS. • Profils spectraux évoquant plutôt la malignité ou la bénignité. Ø Rapports Cho/Cr et Cho/NAA augmentent avec le grade tumoral Ø Lipides et lactate plus fréquents dans les grades élevés Ø Myo-inositol augmente dans le grade II, baisse dans les grades III et IV

Gliome de grade II -élévation modérée des rapports Cho/Cr et Cho/NAA - élévation du myo-inositol Glioblastome - élévation importante des rapports Cho/Cr et Cho/NAA - Baisse du myo-inositol - Lipides et lactate fréquents

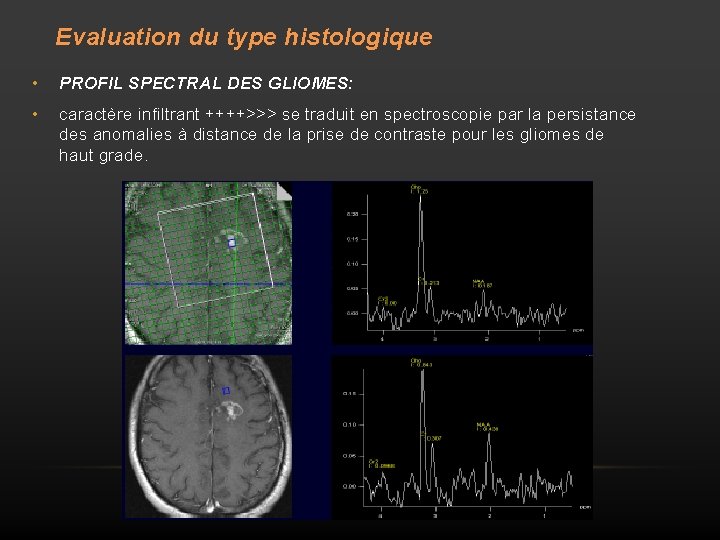
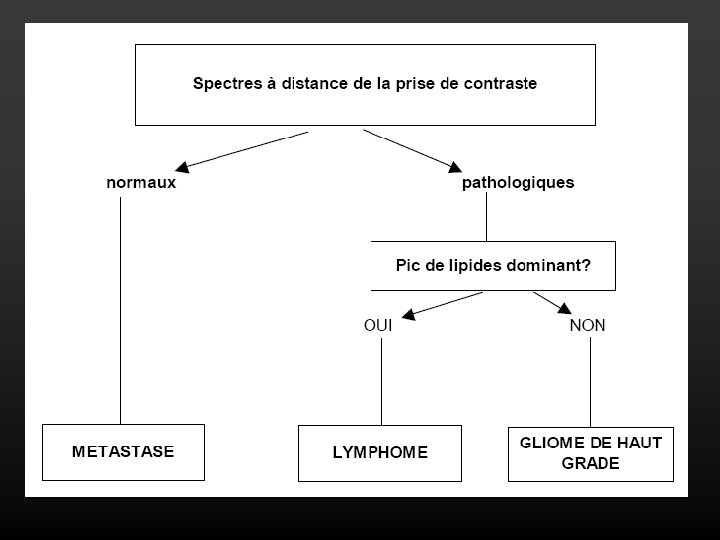
Evaluation du type histologique • PROFIL SPECTRAL DES GLIOMES: • caractère infiltrant ++++>>> se traduit en spectroscopie par la persistance des anomalies à distance de la prise de contraste pour les gliomes de haut grade.

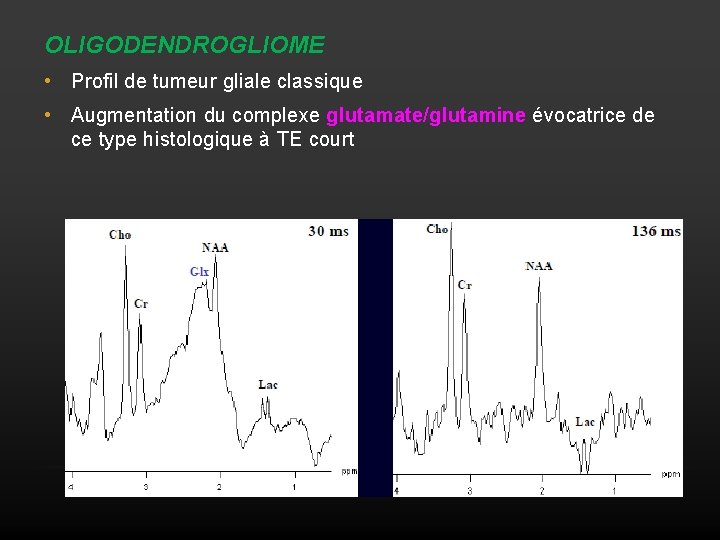
OLIGODENDROGLIOME • Profil de tumeur gliale classique • Augmentation du complexe glutamate/glutamine évocatrice de ce type histologique à TE court

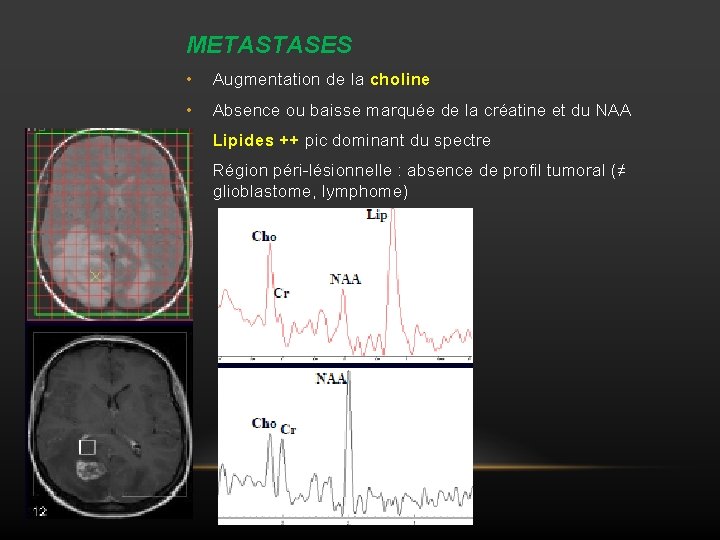
METASTASES • Augmentation de la choline • Absence ou baisse marquée de la créatine et du NAA • Lipides ++ pic dominant du spectre • Région péri-lésionnelle : absence de profil tumoral (≠ glioblastome, lymphome)

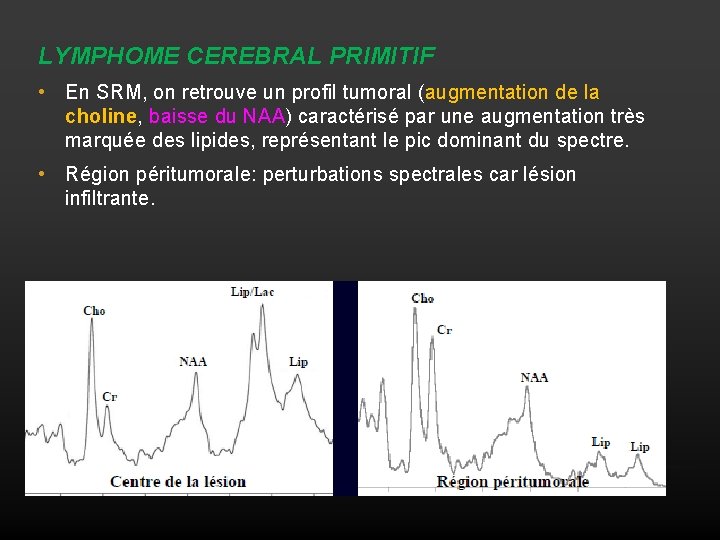
LYMPHOME CEREBRAL PRIMITIF • En SRM, on retrouve un profil tumoral (augmentation de la choline, baisse du NAA) caractérisé par une augmentation très marquée des lipides, représentant le pic dominant du spectre. • Région péritumorale: perturbations spectrales car lésion infiltrante.


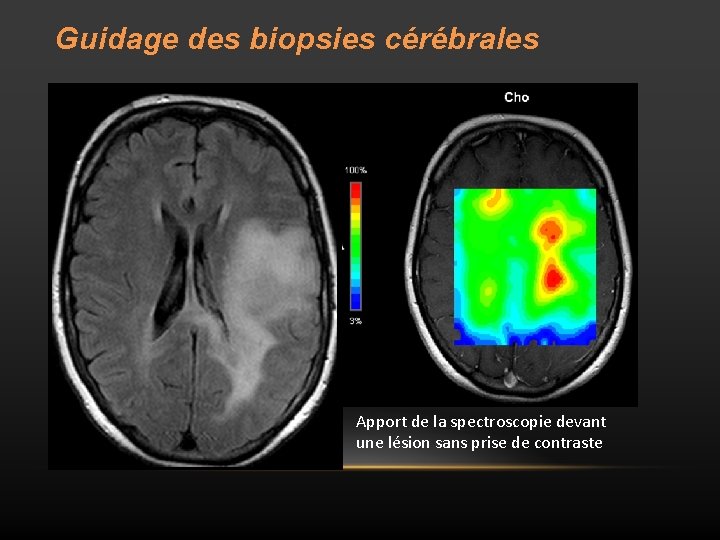
Guidage des biopsies cérébrales Apport de la spectroscopie devant une lésion sans prise de contraste

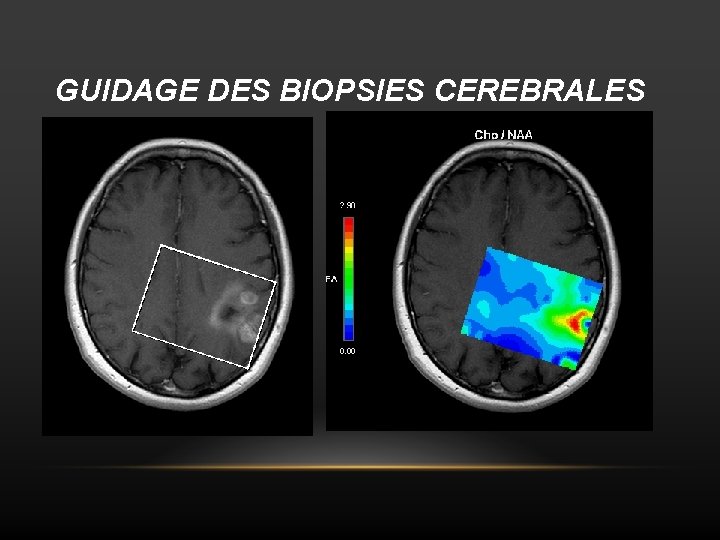
GUIDAGE DES BIOPSIES CEREBRALES

Délimitation du volume tumoral • Objectif: délimiter avec plus de précision les limites de la tumeur avant la chirurgie ou la radiothérapie car l’IRM est mise en défaut dans la délimitation tumorale (hypersignal T 2 : infiltration ou oedème ? ). • l’index Cho/NAA (CNI). • Si CNI est ≥ 2, il y a une sensibilité de 96% et une spécificité de 57% pour la détection de cellules tumorales.

Suivi post-thérapeutique • Repérage des effets secondaires différents traitements RTH: initialement baisse du NAA, augmentation de la choline, et présence de lipides pendant quelques semaines • Evaluation de la réponse thérapeutique Augmentation du NAA, diminution de la choline et du lactate • Détection précoce des différentes complications de cette période: - résidu tumoral post-opératoire - récidive tumorale - Radionécrose • SUIVI

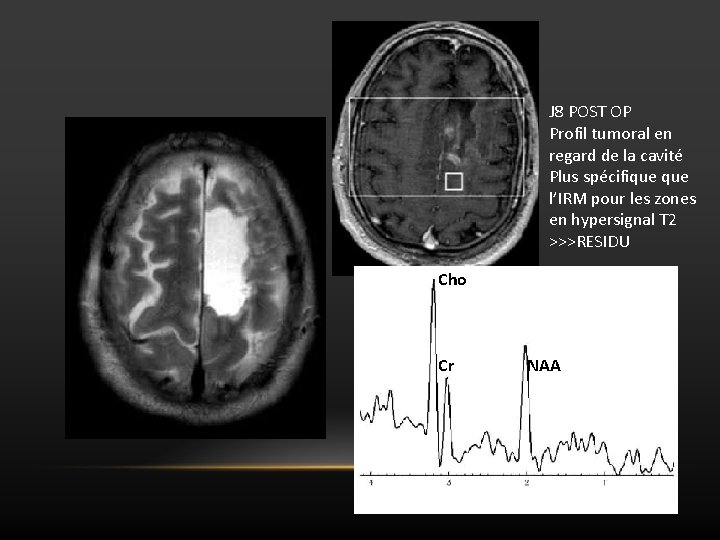
J 8 POST OP Profil tumoral en regard de la cavité Plus spécifique l’IRM pour les zones en hypersignal T 2 >>>RESIDU Cho Cr NAA

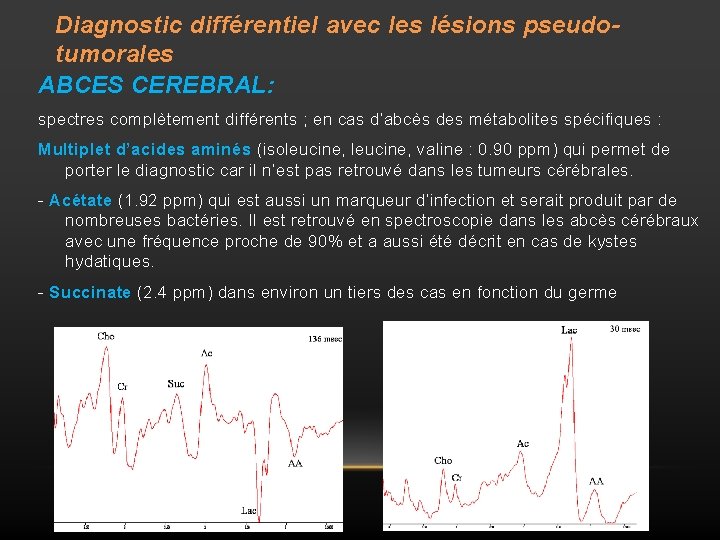
Diagnostic différentiel avec les lésions pseudotumorales ABCES CEREBRAL: spectres complètement différents ; en cas d’abcès des métabolites spécifiques : Multiplet d’acides aminés (isoleucine, valine : 0. 90 ppm) qui permet de porter le diagnostic car il n’est pas retrouvé dans les tumeurs cérébrales. - Acétate (1. 92 ppm) qui est aussi un marqueur d’infection et serait produit par de nombreuses bactéries. Il est retrouvé en spectroscopie dans les abcès cérébraux avec une fréquence proche de 90% et a aussi été décrit en cas de kystes hydatiques. - Succinate (2. 4 ppm) dans environ un tiers des cas en fonction du germe

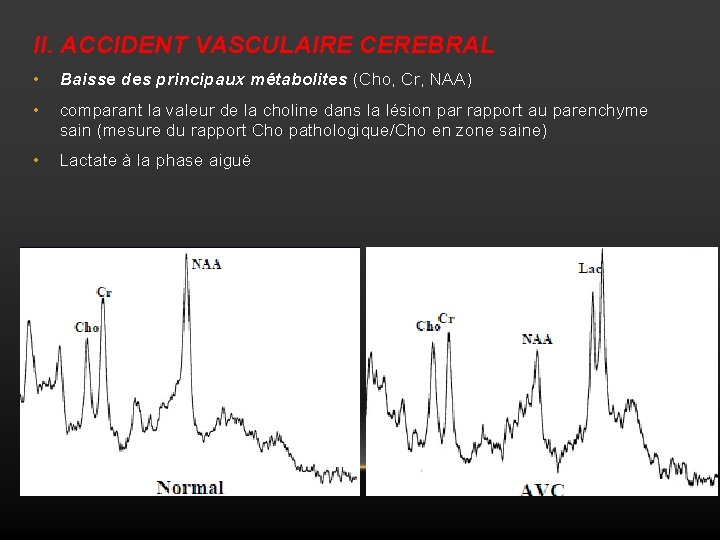
II. ACCIDENT VASCULAIRE CEREBRAL • Baisse des principaux métabolites (Cho, Cr, NAA) • comparant la valeur de la choline dans la lésion par rapport au parenchyme sain (mesure du rapport Cho pathologique/Cho en zone saine) • Lactate à la phase aiguë

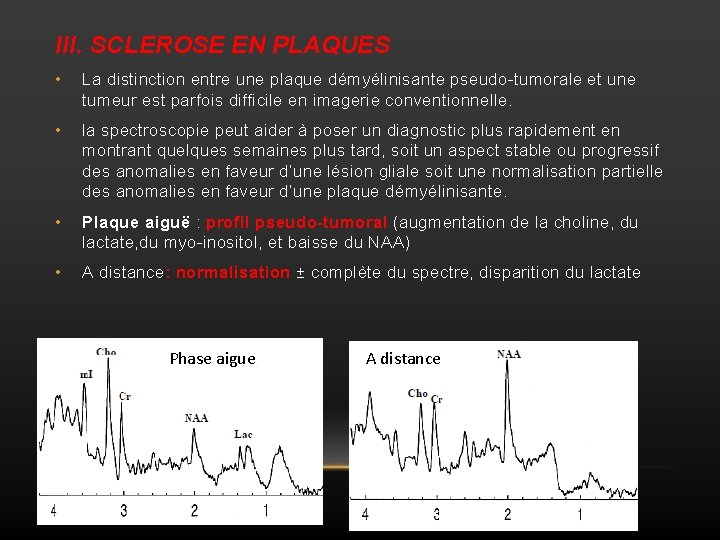
III. SCLEROSE EN PLAQUES • La distinction entre une plaque démyélinisante pseudo-tumorale et une tumeur est parfois difficile en imagerie conventionnelle. • la spectroscopie peut aider à poser un diagnostic plus rapidement en montrant quelques semaines plus tard, soit un aspect stable ou progressif des anomalies en faveur d’une lésion gliale soit une normalisation partielle des anomalies en faveur d’une plaque démyélinisante. • Plaque aiguë : profil pseudo-tumoral (augmentation de la choline, du lactate, du myo-inositol, et baisse du NAA) • A distance: normalisation ± complète du spectre, disparition du lactate Phase aigue A distance

AUTRES APPLICATIONS CLINIQUES Applications essentiellement en pathologie tumorale (choline) - Prostate: étude du pic de citrate + choline. Intérêt: diagnostic du cancer, suivi évolutif sous hormonothérapie/radiothérapie - Sein - ORL - Foie

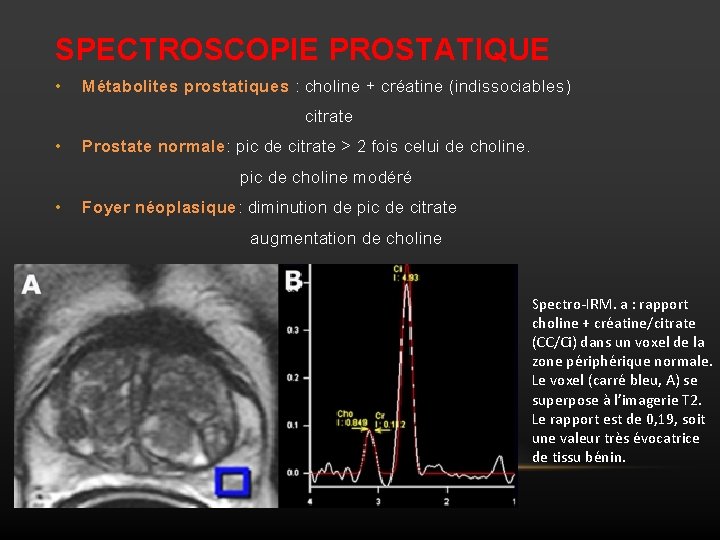
SPECTROSCOPIE PROSTATIQUE • Métabolites prostatiques : choline + créatine (indissociables) citrate • Prostate normale: pic de citrate > 2 fois celui de choline. pic de choline modéré • Foyer néoplasique: diminution de pic de citrate augmentation de choline Spectro-IRM. a : rapport choline + créatine/citrate (CC/Ci) dans un voxel de la zone périphérique normale. Le voxel (carré bleu, A) se superpose à l’imagerie T 2. Le rapport est de 0, 19, soit une valeur très évocatrice de tissu bénin.

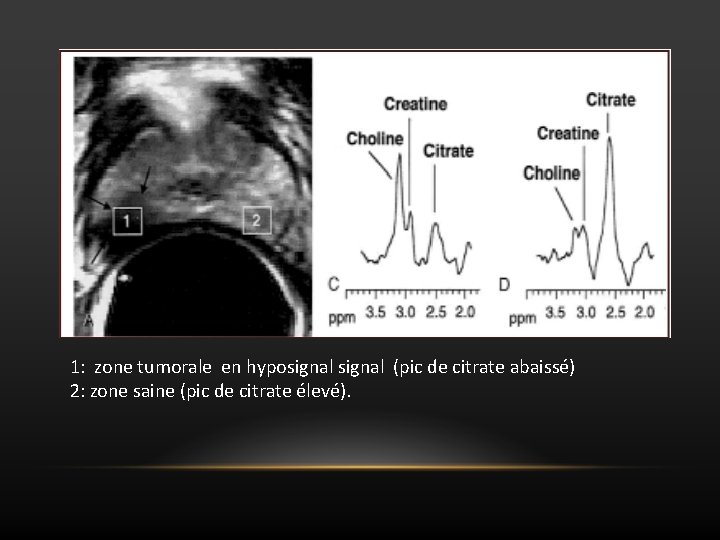
1: zone tumorale en hyposignal (pic de citrate abaissé) 2: zone saine (pic de citrate élevé).

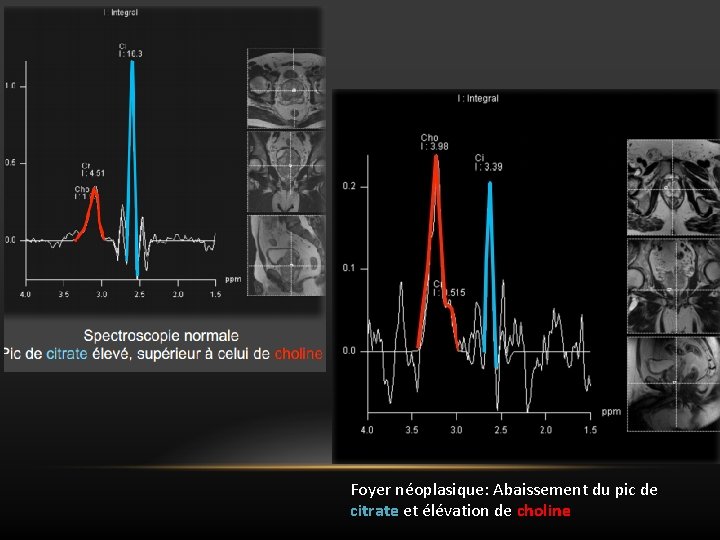
Foyer néoplasique: Abaissement du pic de citrate et élévation de choline

• Limites: • Dans un tiers des cas, les pics des métabolites ne sont pas interprétables en raison d’artéfacts de susceptibilité magnétique , de contamination par l’activité métabolique des graisses périprostatiques • l’activité métabolique de la prostatite chronique et de l’hyperplasie stromale peuvent simuler celle du cancer. • La spectro-IRM a une sensibilité limitée à 44 % dans la détection des cancers de bas grade. >>> coupler la spectro-IRM avec une autre imagerie fonctionnelle

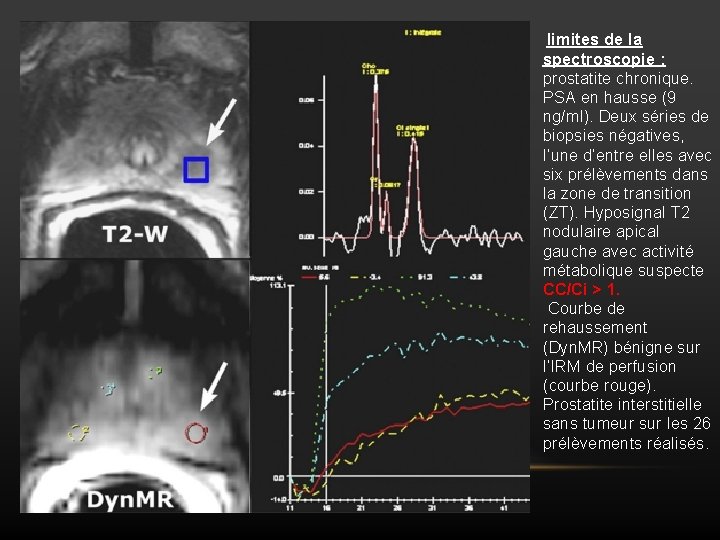
limites de la spectroscopie : prostatite chronique. PSA en hausse (9 ng/ml). Deux séries de biopsies négatives, l’une d’entre elles avec six prélèvements dans la zone de transition (ZT). Hyposignal T 2 nodulaire apical gauche avec activité métabolique suspecte CC/Ci > 1. Courbe de rehaussement (Dyn. MR) bénigne sur l’IRM de perfusion (courbe rouge). Prostatite interstitielle sans tumeur sur les 26 prélèvements réalisés.

CONCLUSION

• Spectroscopie: complément indispensable à l’imagerie standard. • Applications de plus en plus larges: Neurologie+++ Ø Diagnostic positif Ø Grading tumoral Ø Sites de biposies Ø Aide thérapeutique: extension tumorale exacte. Ø Suivi et évaluation post thérapeutique

BIBLIOGRAPHIE