La recherche clinique de la thorie la pratique























































































- Slides: 91

La recherche clinique de la théorie à la pratique Proposition d’une trame complète destinée à la communication vers les CH non CHU – supprimer les diapositives inutiles GIRCI « CH non CHU » 07/2012/ I. Hérafa

Sommaire 1) Généralités – Contexte de la recherche clinique 2) La recherche clinique à promotion extérieure : être centre investigateur 3) La recherche clinique à promotion institutionnelle : le centre hospitalier promoteur 4) La recherche clinique paramédicale 5) Le paysage interrégional de la recherche clinique 6) Constituer une cellule de recherche clinique GIRCI « CH non CHU » 07/2012/ I. Hérafa

1) Généralités – Contexte de la recherche clinique GIRCI « CH non CHU » 07/2012/ I. Hérafa

QU’EST-CE QUE C’EST ? Etape faisant suite à la recherche fondamentale et à l'expérimentation animale Réalisée sur l’homme par des équipes réunies de médecins, de pharmaciens, de techniciens de laboratoire, d'infirmières et d'autres personnels de santé 4 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Types de recherche Recherches épidémiologiques Recherches génétiques Investigations à visée diagnostique Recherches sur les dispositifs médicaux Essais thérapeutiques 5 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Cadre réglementaire, éthique et légal Les lois encadrant la RBM en France dérivent • de la loi Huriet-Serusclat de 1988 • de la directive européenne de 2001 • loi du 09 / 08 / 2004 • décret du 26 / 04 /2006 • Cas particulier de la recherche sur les mineurs ou sur les personnes protégées : article L 1126. 1 du Code de la Santé Publique Ces textes doivent être connus car il faut les citer pour l’écriture du protocole pour la soumission au CPP. 6 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Essai thérapeutique Tester un nouveau médicament (ou existant), un traitement biologique ou un dispositif L'objectif principal = comparer 2 ou plusieurs groupes de sujets, en utilisant 2 ou plusieurs traitements Mené avec précaution et éthique pour protéger les patients et permettre une analyse de l'information sur une maladie Offre l'espoir aux futurs patients d'un traitement 7 efficace GIRCI « CH non CHU » 07/2012/ I. Hérafa

But d’un essai Pharmacologique : voies d’administration, posologie, durée de traitement Efficacité : si oui, est-il plus efficace que les traitements habituellement utilisés ? Toxique : effets secondaires trop importants ? Qui en tirera le plus de bénéfices ? A quel moment sera-t-il le plus bénéfique (traitement préventif et/ou curatif) ? 8 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les différentes phases Phase préclinique : chez l’animal, tolérance, études de pharmacocinétiques et de pharmacodynamiques (absorption, diffusion, élimination. . . et recherche de doses) Phase I : tolérance et métabolisme sur un petit nombre de volontaires sains 9 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les différentes phases Phase II : étude thérapeutique pilote sur des malades, évaluation de l’efficacité, toxicité, effets secondaires Phase III : étude thérapeutique sur un grand nombre de malades, comparaison au médicament de référence ou placebo Phase IV : une fois le médicament commercialisé 10 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les différents acteurs et leurs rôles Promoteur : Personne physique ou morale qui prend l'initiative d'une recherche biomédicale. Entreprise, établissement chargé de la mise en œuvre de la gestion et du financement d’un essai clinique. 11 GIRCI « CH non CHU » 07/2012/ I. Hérafa

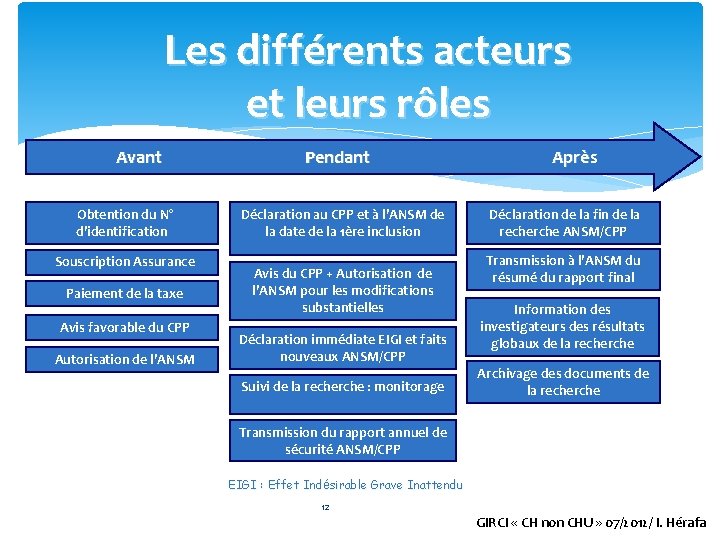
Les différents acteurs et leurs rôles Avant Pendant Après Obtention du N° d’identification Souscription Assurance Paiement de la taxe Avis favorable du CPP Autorisation de l’ANSM Déclaration au CPP et à l’ANSM de la date de la 1ère inclusion Avis du CPP + Autorisation de l’ANSM pour les modifications substantielles Déclaration immédiate EIGI et faits nouveaux ANSM/CPP Suivi de la recherche : monitorage Déclaration de la fin de la recherche ANSM/CPP Transmission à l’ANSM du résumé du rapport final Information des investigateurs des résultats globaux de la recherche Archivage des documents de la recherche Transmission du rapport annuel de sécurité ANSM/CPP EIGI : Effet Indésirable Grave Inattendu 12 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les différents acteurs et leurs rôles Investigateur : Personne qualifiée (Docteur en Médecine) responsable de la réalisation pratique de l’essai clinique sur les lieux de l ’essai. Si l’essai est réalisé par une équipe, on parle alors de Principal Investigateur et de Co-Investigateurs. 13 GIRCI « CH non CHU » 07/2012/ I. Hérafa

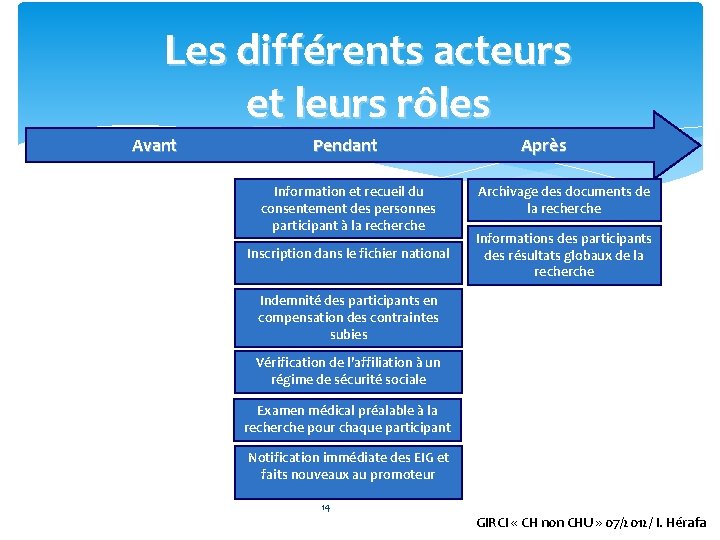
Les différents acteurs et leurs rôles Avant Pendant Après Information et recueil du consentement des personnes participant à la recherche Inscription dans le fichier national Archivage des documents de la recherche Informations des participants des résultats globaux de la recherche Indemnité des participants en compensation des contraintes subies Vérification de l’affiliation à un régime de sécurité sociale Examen médical préalable à la recherche pour chaque participant Notification immédiate des EIG et faits nouveaux au promoteur 14 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les différents acteurs et leurs rôles ARC : Attaché de Recherche Clinique, personne mandatée par le promoteur = fonction de monitoring -Vérifier la conformité du consentement -Vérifier le respects des droits et la sécurité des participants -Vérifier la qualité des données recueillies -Veiller à ce que la recherche soit réalisée conformément au protocole et à la réglementation en vigueur. 15 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les différents acteurs et leurs rôles TEC : Technicien d’Etude Clinique = fonction d’aide auprès de l’investigateur - Aide au screening, à l’inclusion et au suivi des patients - Aide au remplissage des Cahiers d’observation (CRF) - Gestion des prélèvements - Gestion des traitements 16 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les différents acteurs et leurs rôles Pharmacien : Docteur en Pharmacie en charge des Essais Cliniques. Responsable de la gestion des traitements à l’essai : réception, stockage, dispensation, réapprovisionnement, restitution ou destruction. Laboratoire : En relation avec le Promoteur et avec l’équipe Investigateur. Procédures et traçabilité spécifiques mises en place. Personnel dédié, formé aux essais cliniques. 17 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les Bonnes Pratiques Cliniques (BPC) Ensemble des dispositions garantissant : - l’authenticité et la fiabilité des données recueillies - le respect de la loi et de la réglementation en vigueur. Ces dispositions sont établies par le Ministère de la Santé. 18 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Procédures Opératoires Standards (POS) Procédures spécifiques décrivant l’ensemble des démarches à suivre dans le cadre d’un essai. Elles sont destinées aux investigateurs et aux ARC pour qu’ils travaillent de la même façon d’un centre à l’autre. 19 GIRCI « CH non CHU » 07/2012/ I. Hérafa

La Brochure Investigateur Synthèse des données du médicament expérimental Destinée aux investigateurs Mise à jour par le promoteur Soumise à la réglementation 20 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Documents sources Originaux des renseignements écrits ou des objets servant de preuve aux données des cahiers d’observations de l’étude (dossier médical, pancarte, agenda, examens de laboratoire, …) Toute information doit être libellée, datée, signée La confrontation permet de détecter, corriger et prévenir les erreurs, les oublis, les confusions 21 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Pharmacovigilance Évènement indésirable non grave : -attendu : déjà recensé dans la brochure investigateur -inattendu : non recensé dans la brochure, besoin de connaître le type, la gravité, leur incidence Évènement indésirable grave : A déclarer dans les 24 H au promoteur Décès, hospitalisation ou prolongation, séquelle, anomalie congénitale ou manifestation maligne 22 GIRCI « CH non CHU » 07/2012/ I. Hérafa

2) La recherche clinique à promotion extérieure : être centre investigateur GIRCI « CH non CHU » 07/2012/ I. Hérafa

Quelques repères Le CH est ici prestataire de service pour un promoteur extérieur qui peut être : • soit une autre institution : CH, CHU, groupe académique de recherche clinique, Fondation, Université, … • soit un industriel 24 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Convention hospitalière (1/3) Définition : Convention établie entre la personne qui prend l’initiative de la recherche (le promoteur) et le représentant légal de l’établissement de santé où se déroulera l’essai (centre investigateur). Elle vise à déterminer quels sont les coûts dédiés à la recherche ( « surcoûts » ) qui seront à facturer au promoteur par l’établissement, et non pas à la Sécurité sociale Différenciation soin / recherche 25 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Convention hospitalière (2/3) • Deux types de convention -Bipartite : CH / Promoteur convention-type fournie par le Leem pour chaque type de recherche avec tarifs homogènes nationaux (grille surcoûts) -Tripartite : CH / Promoteur / Investigateur (uniquement si les honoraires investigateurs sont versés sur le compte recherche de l’hôpital) 26 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Convention hospitalière (3/3) Préambule -Titre complet de l’essai -Nom du centre, nom de l’investigateur et service -Numéro Eudra. CT -Date et N° d’autorisation de l’ANSM -Date de l’avis du CPP -Durée de l’étude et nombre de patients à réaliser -N° et adresse police d’assurance du promoteur 27 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Convention hospitalière (4/3) Objet de la convention Dispositions financières Confidentialité Audit Date d’effet, durée, dénonciation de la convention Litiges, contestations Signatures des 2 Parties Annexe : grille de surcoûts 28 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Surcoûts (1/4) Définition : Frais supplémentaires liés à d’éventuels fournitures ou examens spécifiques requis par le protocole ou pour la mise en œuvre de celui-ci. 29 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Surcoûts (2/4) Importance de la dissociation Recherche/Soin dans la prise en charge du patient • Soin = facturation Sécurité Sociale • Recherche = pas de facturation SS : nécessité de mise en place d’une procédure spécifique Surcoûts avancés par l’hôpital puis facturés au promoteur : surcoûts ≠ bénéfices • Bonne évaluation du temps passé / actes supplémentaires réalisés • Ne pas oublier les services associés 30 GIRCI « CH non CHU » 07/2012/ I. Hérafa

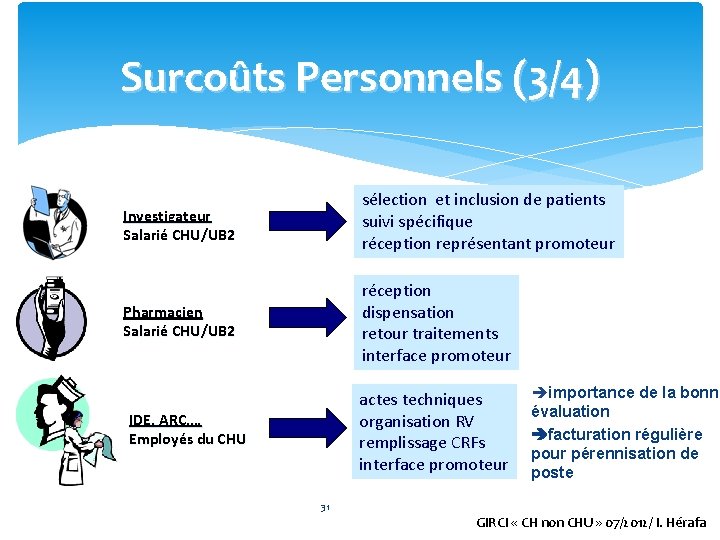
Surcoûts Personnels (3/4) Investigateur Salarié CHU/UB 2 sélection et inclusion de patients suivi spécifique réception représentant promoteur Pharmacien Salarié CHU/UB 2 réception dispensation retour traitements interface promoteur actes techniques organisation RV remplissage CRFs interface promoteur IDE, ARC, … Employés du CHU importance de la bonne évaluation facturation régulière pour pérennisation de poste 31 GIRCI « CH non CHU » 07/2012/ I. Hérafa

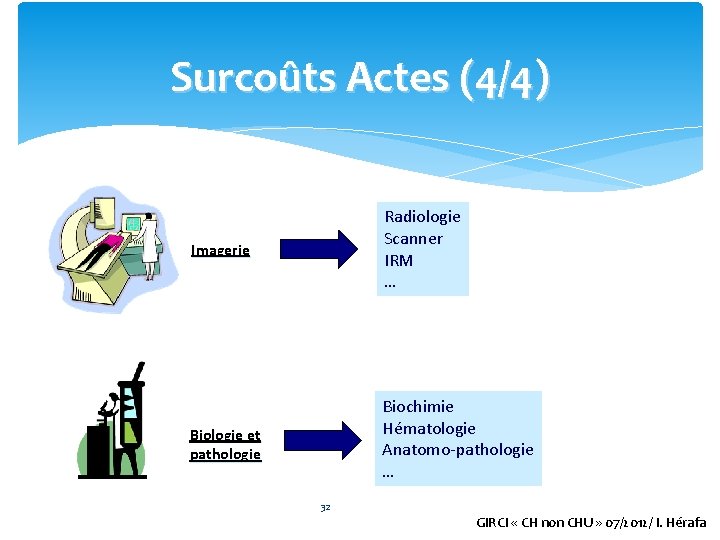
Surcoûts Actes (4/4) Imagerie Radiologie Scanner IRM … Biologie et pathologie Biochimie Hématologie Anatomo-pathologie … 32 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Convention investigateur Définition Accord écrit, daté et signé entre l’investigateur et le promoteur. En général seul les honoraires investigateurs y sont mentionnés. 33 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Convention investigateur On dissocie pour les conventions investigateurs : • Le contrat direct avec l’investigateur (qui doit alors cotiser à l’URSAFF => activité privée) • Le contrat recherche-association loi 1901 (attention, système de moins en moins permis par le Leem) • Rappel : la convention tripartite entre CH / Promoteur / Investigateur (voir plus haut) peut servir également à percevoir les honoraires qui sont versés sur un compte recherche identifié dans l’établissement Ces conventions doivent être communiquées au CNOM (art. L 462 du code la santé publique) 34 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les étapes habituelles de la recherche industrielle Envoi de questionnaire de faisabilité délai de réponse très court : être réactif bien estimer son potentiel patient (ne pas le surestimer) en s’aidant de chiffres tangibles : bases données, PMSI, … de Sélection des centres par le promoteur Visite de sélection (PSV) – centre retenu ou non Visite de mise en place (MEP) – Ouverture du centre inclure rapidement après ouverture (mémoire des démarches, compétitivité) Visites de monitoring Visite de clôture 35 GIRCI « CH non CHU » 07/2012/ I. Hérafa

3) La recherche clinique à promotion institutionnelle : le centre hospitalier promoteur GIRCI « CH non CHU » 07/2012/ I. Hérafa

Comment monter un projet de recherche – Etapes clés Idée de recherche – revue de la littérature – rédaction d’un draft documents types à disposition Montage du budget - Classification du projet – méthodologie : consultation des structures de soutien à la recherche (référent RC établissement ou CHU, Unité de soutien méthodologique) Rédaction du protocole, note d’information et consentement, rédaction du cahier d’observation Recherche de financements 37 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Idée de recherche – revue de la littérature et rédaction draft Identification de la question et de l’hypothèse de recherche À présent, la recherche bibliographique s’effectue sur internet « Pub. Med » Faire un plan avant de se lancer dans la rédaction • Former un couple investigateur / méthodologiste • Distribuer la rédaction entre les responsables • Commencer par les aspects scientifiques • Fixer un agenda et faires des points réguliers 38 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Montage du budget Réussite d’un projet Moyens adaptés pour le réaliser • En amont - Définir les moyens nécessaires (se faire aider de la cellule RC) - Réfléchir à la faisabilité - Recherche de financements • En aval : suivre le budget + dépenses (référent cellule RC) 39 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Classification du projet • Recherches biomédicales interventionnelles : Essais sur l’être humain en vue du développement des connaissances biologiques ou médicales. • Etudes sur « soins courants » : recherches observationnelles évaluant les soins courants lorsque tous les actes sont pratiqués de manière habituelle. • Etudes non interventionnelles : recherches purement observationnelles où tous les actes sont pratiqués de manière habituelle. 40 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Méthodologie consultation des structures spécialisées en soutien méthodologique à la recherche : • dans l’établissement (référent méthodologiste) • dans le CHU de proximité • sous traitance, autres Indiquer le nom et coordonnées des personnes contacts pour votre CHU 41 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Rédaction du protocole Définition Document qui décrit toutes les étapes prévues d’un essai • Les investigateurs doivent suivre ce document à la lettre • Documents-types (trames) disponibles sur le site internet du GIRCI, http: //www. girci-soom. fr (adresse à mettre à jour dès sa création) 42 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Rédaction Notice d’information et consentement L’information doit être claire et compréhensible indiquant: le but de l’étude, la méthodologie, la durée de la recherche, les contraintes etc. …. Le consentement doit préciser clairement qu’il s’agit d’un accord volontaire qui peut être retiré à tout moment sans préjudice pour le patient et indiquer très clairement les limites de ce consentement Documents-types (trames adulte, mineur, représentant, urgence) disponibles sur le site internet du GIRCI groupe « Formation » pour les RBM et recherches en soins courant http: //www. girci-soom. fr (à mettre à jour dès création) 43 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Le consentement Libre, Eclairé Donné par écrit Recueilli par l’investigateur Possibilité pour le patient de refuser Consentement Préalable à la recherche après information Possibilité pour le patient de retirer son consentement Participation, Modalités de délivrance de l’information et de recueil du consentement = à noter dans le dossier médical 44 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Rédaction du cahier d’observation Définition : Le cahier d’observation est l’outil de recueil indispensables pour assurer la qualité des données de l’essai. • Le recueil doit être standardisé c’est-à-dire identique pour tous les sujets inclus dans l’étude. Il faut donc préciser par qui, où, quand et comment sera réalisé le recueil des informations. • Comment? S’aider de la trame standard élaborée par l’interrégion SOOM et disponible sur le site internet 45 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Recherche d’un financement Plusieurs possibilités de financements • Institutionnels / PHRC national , interrégional / Appels d’offres : Le projet doit alors répondre aux spécificités de l’appel d’offres en termes de budget, thématiques, centres associés, … • Les sociétés savantes ou les associations de malades Peuvent financer des projets (portant sur la qualité de vie des patients, l’étude de la douleur …) Les industriels : via des programmes de soutien, des subventions Chaque demande de financement fait l’objet d’un formulaire spécifique et les dates limites de dépôt des dossiers doivent être impérativement respectées. 46 GIRCI « CH non CHU » 07/2012/ I. Hérafa

L’hôpital promoteur - Responsabilités Définition : Personne physique ou morale qui prend l'initiative de la recherche. Entreprise, établissement chargé de la mise en œuvre de la gestion et du financement d’un essai clinique Rôles : • Doit garantir la qualité scientifique • Doit assurer la conformité aux BPC / CSP Structure de soutien spécialisée Appui technico réglementaire 47 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Obtention du N°Eudra. CT Demande d’autorisation à l’autorité compétente Demande d’avis au CPP Déclaration CNIL 48 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Obtention du N° Eudra. CT (1/2) La directive européenne 2001/20/CE sur les essais cliniques portant sur le médicament prévoit la mise en place d’une base de données des essais dénommée : Eudra. CT. Cette base est uniquement accessible par l’Agence Européenne pour l’Evaluation des Médicaments (EMEA) et la Commission. 49 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Obtention du N° Eudra. CT (2/2) 2 étapes : 1) Obtention d’un code sécurité sur le site http: //eudract. emea. europa. eu (valable 24 H) 2) Obtention du numéro Eudra. CT auprès du système Eudra. CT. Format du N° Eudra. CT : YYYY-NNNNNN-CC Année - numéro séquentiel à 6 chiffres – nombre de contrôle 50 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (1/8) La directive européenne 2001/20/CE prévoit que les recherches biomédicales sur médicament à usage humain fasse l’objet d’une demande d’autorisation préalable auprès de l’autorité compétente. Ce dossier sera accompagné d’un courrier de demande d’autorisation d’essai clinique disponible sur le site de l’ANSM : http: //ansm. sante. fr. L’ANSM contrôle la sécurité des patients ainsi que la sécurité et la qualité du produit à l’étude. 51 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (2/8) Composition du dossier / Partie administrative -Courrier de demande d’autorisation -Formulaire de demande d’autorisation (Eudra. CT) -Le reçu de confirmation du N° Eudra. CT -Le cas échéant la liste des autorités compétentes des Etats de l’UE et décisions si disponibles -Si le demandeur n’est pas le promoteur, l’autorisation écrite du promoteur lui permettant d’agir pour son compte (délégation) -Le justificatif des versements des taxes à l’ANSM 52 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (3/8) Partie administrative -Les autorisations s’appliquant à certaines recherches ou produits dotés de caractéristiques spéciales (ex: radiopharmaceutique, préparations hospitalières…) -Tous avis scientifiques, si disponibles, rendu au promoteur sur le médicament expérimental ou la recherche par l’une des Autorités compétentes différents Etats membres -L’autorisation de communiquer les données du médicament expérimental d’un tiers 53 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (4/8) Partie sur la recherche biomédicale -Le protocole de recherche, le résumé français , datés et portant le N° de la recherche -La version actualisée de la brochure investigateur (BI) -Le résumé actualisé des caractéristiques du produit (RCP) pour tout médicament expérimental disposant d’une Autorisation de mise sur le marché (AMM) -La copie de l’attestation d’assurance -L’avis du CPP si disponible 54 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (5/8) Partie sur la recherche biomédicale -L’avis, si disponible, du comité scientifique consulté par le promoteur (comité d’experts) -Le document de référence (BI ou RCP) pour déterminer le caractère attendu ou inattendu des suspicions d’Evènements Indésirables Graves (EIG) 55 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (6/8) Partie technique sur le produit utilisé -Données de qualité dont sécurité virale -Données non cliniques -Données cliniques Il est possible de soumettre un dossier allégé si le médicament expérimental bénéficie : • d’une AEC antérieure en France • d’une AMM en France ou Etats UE ou USA ou Japon 56 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (7/8) Partie technique sur le produit utilisé -Produire également une analyse critique du rapport bénéfice / risque et une attestation que les études cliniques et non cliniques selon les BPC/BPF. Le cas échéant : • dossier du médicament non expérimental si le produit est utilisé selon son AMM ou différemment, sans AMM, sans marquage CE pour les dispositifs médicaux • dossier du placebo : données de qualité si la composition de l’excipient est différente au médicament expérimental 57 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’autorisation à l’autorité compétente (8/8) Partie technique sur le produit utilisé -Produire également une analyse critique du rapport bénéfice / risque et une attestation que les études cliniques et non cliniques selon les BPC/BPF. Le cas échéant : • dossier du médicament non expérimental si le produit est utilisé selon son AMM ou différemment, sans AMM, sans marquage CE pour les dispositifs médicaux • dossier du placebo : données de qualité si la composition de l’excipient est différente au médicament expérimental 58 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (1/12 ) Les Comités de Protection des Personnes ont compétences pour remettre des avis sur les recherches suivantes: • Recherche biomédicale (RBM) • Soins courants • Collections d’échantillons biologiques • Changement de finalité dans la recherche sur des éléments et produits du corps humains Le CPP donne son avis sur : la protection des personnes, la recherche (pertinence, Bénéfices /risques) et les moyens mis en œuvre. 59 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (2/12 ) Demande d’avis favorable pour une RBM Aucune RBM ne peut commencer en France sans l’avis favorable du CPP et l’autorisation de l’autorité compétente : Agence Nationale de Sécurité des Médicaments (ANSM) pour les médicaments et dispositifs médicaux; Direction Générale de la Santé (DGS) pour les autres recherches. La demande est adressée par le promoteur dans le pays où sera effectuée la recherche. 60 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (3/12 ) • Partie administrative du dossier -Courrier de demande d’avis , daté et signé, précisant la nature de la recherche, son titre, le N° Eudra. CT -Formulaire de demande d’avis, daté et signé, disponible sur le site internet de la base de données Eudra. CT ou en version papier auprès de l’ANSM pour les médicaments -Document additionnel à la demande d’avis du CPP sera joint (N° Eudra. CT, titre essai, pertinence de la recherche, évaluation B/R, modalités de recrutement 61 des personnes, …) GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (4/12) • Partie administrative du dossier -Reçu de confirmation du N° Eudra. CT -Justificatif du versement des taxes prévues par la loi -Certains documents administratifs sont spécifiques du type de recherche (ex : pour les diapositifs médicaux : fournir le marquage CE s’il existe) -Liste des RBM menées par le promoteur sur le même médicament -Liste des autorités compétentes des Etats de l’UE auprès desquels la recherche a été ou sera soumise 62 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (5/12 ) • Partie scientifique du dossier -Le protocole -La Brochure investigateur actualisée (BI) -Le résumé des caractéristiques du produit (RCP) si le médicament dispose d’une AMM en France ou Etats membres de la CE -Si des documents particuliers sont destinés au patient (carnet à remplir, questionnaire…) ou les modalités d’utilisation d’un matériel à domicile, un exemplaire 63 doit être joint au dossier GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (6/12 ) • Partie scientifique du dossier -Le résumé du protocole -La liste complète des investigateurs et des centres -Le document additionnel, le résumé, la note d’information et le consentement sont obligatoirement rédigés en français 64 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (7/12 ) Le dépôt donne lieu à un accusé de réception. La demande peut être déposée conjointement avec celle de l’autorité compétente. Le promoteur ne peu demander un avis pour un protocole qu’à un seul comité. A sa demande, le promoteur éventuellement accompagné de l’investigateur peut être entendu par le comité. 65 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (8/12 ) Le délai de réponse du comité est de 35 jours. En cas de demande d’information complémentaire, le délai passe à 60 jours • En cas d’avis défavorable, le promoteur peut sous 15 jours saisir le ministre chargé de la santé pour un 2ème examen du dossier par un autre comité • En cas d’avis favorable, le promoteur dispose d’un an maximum pour débuter sa recherche 66 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (9/12 ) Demande d’avis favorable pour soin courant Cette demande concerne les recherches autres que celles portant sur les médicaments, lorsque tous les actes sont pratiqués et les produits utilisés de manière habituelle mais que des modalités particulières de surveillance sont prévues dans un protocole. L’avis du comité est obligatoire et déclaratif comme pour les RBM. La demande est faite par le promoteur. 67 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (10/12 ) Demande d’avis favorable pour soin courant Il est prévu une taxe à verser à l’ANSM. Les amendements substantiels sont également soumis au comité qui a donné son avis initial. Délai de réponse 35 jours avec possibilité de requalifier la recherche en RBM. En cas d’avis dé » favorable, la même procédure d’appel que pour les RBM peut être utilisée. 68 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (11/12 ) Demande d’avis favorable pour les collections biologiques Lorsque la collection est constituée hors le cadre d’une RBM, il est demandé au comité de donné un avis qui sera consultatif. Le dossier de soumission comporte : • Le projet de recherche • L’information donnée au patient avant le recueil de l’échantillon 69 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Demande d’avis au CPP (12/12 ) Demande d’avis favorable pour les changements substantiels de finalité Le dossier comporte : • Le descriptif du projet • Sa justification scientifique • Le formulaire d’information destiné au patient Le comité vérifie que le promoteur s’est assuré de l’absence d’opposition des personnes 70 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Déclaration à la CNIL (1/3) Commission Nationale Informatique et Liberté Les données personnelles doivent être protégées. Les données transmises au promoteur pourraient présentées des risques majeurs pour l’anonymat des intéressés. • Régime déclaratif : envoi d’un simple engagement de conformité à la méthodologie de référence (MR-001) • Régime d’autorisation : si la méthodologie de référence de traitement des données ne s’appliquent pas, demande d’avis au CCTIRS et autorisation CNIL 71 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Déclaration à la CNIL (1/3) Déclaration à la CNIL http: //www. cnil. fr Formulaire MR-001 : méthodologie de référence - Finalité des traitement - Origine et nature des données - Catégories de données traitées - Analyse des données - Personnes appelées à mettre en œuvre le traitement des données et ayant accès aux données - Personnes ou service auprès desquels s’exercent le 72 droit d’accès GIRCI « CH non CHU » 07/2012/ I. Hérafa

Avant l’essai Déclaration à la CNIL (3/3) Déclaration à la CNIL http: //www. cnil. fr Formulaire MR-001 : méthodologie de référence - Durée de conservation - Sécurité des traitements - Transfert de données à l’étranger Archivage informatique : 15 ans. 73 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Pendant l’essai Rôles du promoteur : • Inscrit l’étude sur SIGREC en début d’essai • Déclare la 1ère inclusion au CPP et autorité compétente • Le cas échéant : met à jour des informations dans clinicaltrials. gov et prolonge l’assurance • Assure les visites de monitoring : contrôle qualité des données dans les centres • Surveille la tolérance : analyse centralisée Unité de PV 74 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Après l’essai / Archivage des documents essentiels de l’étude • Par le promoteur et l’investigateur • Dans un endroit sécurisé, accès restreint • Documents relatifs à l’étude conservés pendant une période de : - 10 ans : produits cosmétiques - 15 ans : médicaments, DM, hors produits de santé - 30 ans : produits sanguins, organes, tissu humain ou animal, préparations de thérapie cellulaire - 40 ans : médicaments dérivés du sang • 30 ans : archivage des consentements signés 75 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Après l’essai / autres démarches technico-réglementaires A la fin d’une étude, le promoteur… • Déclare la fin de l’étude au CPP et à l’autorité compétente • Résilie l’assurance A la fin d’une étude, le promoteur et l’investigateur… • Etablissent le rapport final de l’étude 76 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Après l’essai Rapport final d’étude Document écrit, rédigé par ou sous la responsabilité de l’investigateur, qui comporte : • Une description détaillée de la recherche pour permettre de comprendre le déroulement et d’émettre un jugement objectif sur la qualité des données de la recherche • Les résultats définitifs (comprenant les données de toutes les personnes s’étant prêtées à la recherche) et une évaluation critique statistique et clinique • Un résumé est transmis pour information à l’ANSM (dans un délai d’un an suivant la fin de la recherche) 77 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Après l’essai Diffusion des résultats Elle se fait principalement par le biais de la publication • permet d’accélérer les progrès de la science • contribue à la visibilité et à la notoriété des équipes La publication doit concerner tous les résultats • ne pas publier les résultats « négatifs » favorise des pratiques • cliniques inadéquates, futiles ou nuisibles ou conduit à des répétitions inutiles des recherches La publication s’envisage dès les données analysées et les résultats interprétés 78 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Après l’essai Valorisation des résultats de la recherche Mettre en valeur les innovations au bénéfice des patients, du système de soins et de la population Protéger les résultats de la recherche (droit de la propriété intellectuelle : brevets d’invention, droits d’auteurs, bases de données. . . ) Transférer les technologies et les savoir-faire vers l’industrie et le monde économique 79 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Le CH promoteur : des responsabilités à assumer La recherche clinique aujourd’hui : Un cadre contraignant avec des exigences internationales croissantes Qualité scientifique Protection des personnes Des « BPC » incontournables 80 GIRCI « CH non CHU » 07/2012/ I. Hérafa

4) La recherche clinique paramédicale GIRCI « CH non CHU » 07/2012/ I. Hérafa

Focus sur la recherche infirmière La recherche infirmière et paramédicale en France : le PHRIP et d’autres appels à projets (privés et publics) Qui peut déposer un dossier ? Toute personne d’un établissement de santé, sous réserve d’un engagement du responsable légal de l’établissement de santé via la DRCI de référence La sélection des projets • Evaluation des projets par paires et examen au sein d’un jury indépendant • Les projets retenus seront financés sur 3 ans 82 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Focus sur la recherche infirmière Cet appel à projet s’adresse à tous les paramédicaux et notamment les IDE Il s’agit donc d’un véritable investissement en terme financier mais aussi humain pour contribuer à : • Elaborer des données probantes • Vérifier une pratique, un type de prise en charge • Améliorer les connaissances et la qualité des soins • Produire un savoir infirmier pour répondre aux besoins patients Journée interrégionale prévue le 28 septembre 2012 pascale. beloni@chu-limoges. fr, valerie. berger@chu-bordeaux. fr, 83 peoch. n@chu-toulouse. fr GIRCI « CH non CHU » 07/2012/ I. Hérafa

5) Le paysage interrégional de la recherche clinique GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les groupes de travail de l’inter-région Mission établissements non CHU du GIRCI SOOM Accompagnement de l’innovation et de l’évaluation médico-économique Accompagnement à la structuration des CRB des établissements de l’inter-région Formation au sein du GIRCI Aide à la réponse aux Appels à projets européens De la démarche qualité vers le management par la qualité Conseil juridique du GIRCI SOOM 85 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Les apports de l’inter-région Mission établissements non CHU du GIRCI SOOM Coordonnateurs: Dr Bruno François / Isabelle Herafa (CHU de Limoges) Soutien au développement de la recherche dans les CH non CHU Développement de la recherche infirmière et paramédicale Formations / Information du personnel à la recherche clinique Mission assurance qualité Co-coordonnateurs : Dr Julie Boussuge-Rozé / Leire Olazabal (CHU de Bordeaux) Dr Marie-Elise Llau / Céline Lapalu (CHU de Toulouse) Mise à disposition de documents-type : consentements, CRFs, protocoles, … 86 GIRCI « CH non CHU » 07/2012/ I. Hérafa via le site internet du GIRCI

Les apports de l’inter-région Formation Bordeaux) Mise à disposition de formation aux BPC par e-learning : système d’apprentissage via internet avec validation des acquis en ligne ==> attestation émise Support à l’organisation de journées ou sessions de formation à la recherche clinique et à son environnement Mise à disposition de supports/ kits de formation via le site internet du GIRCI (avec quizz évaluation) Un référent pour les questions portant sur les projets européens Un référent pour les questions juridiques 87 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Référents interrégionaux Mission Etablissement non CHU bruno. françois@chu-limoges. fr - isabelle. herafa@chu-limoges. fr Mission assurance qualité julie. boussuge-roze@chu-bordeaux. fr - llau. me@chu-toulouse. fr leire. olazabal-aulon@chu-bordeaux. fr - lapalu. c@chu-toulouse. fr Formation sylvie. blazejewski@chu-bordeaux. fr - patricia. lepicard@chu-bordeaux. fr Aide à la réponse aux appels à projets européens joffre. c@chu-toulouse. fr Conseils juridiques depoutre. s@chu-toulouse. fr 88 GIRCI « CH non CHU » 07/2012/ I. Hérafa

Contacts CHU de rattachement Nom du CHU de rattachement et référent Nom et coordonnées du relais opérationnel GIRCI à contacter pour toute demande : • Possibilité de e-learning (…. ) • Catalogue des formations de l’inter région disponibles • Trames documents recherche (protocole, note d’information, consentement, …) • Site internet du GIRCI http: //www. girci-soom. fr (en cours de constitution / à mettre à jour) 89 GIRCI « CH non CHU » 07/2012/ I. Hérafa

6) Constituer une cellule de recherche clinique GIRCI « CH non CHU » 07/2012/ I. Hérafa

Mise en place d’ une cellule de recherche clinique Référent médical et administratif Référent pharmacien ARC / TEC Gestionnaire (conventions, surcoûts, budget…) • Cotation des surcoûts TEC • Mutualisation des honoraires • Dépôt de projets institutionnels (réponse AO) Pérennisation poste de TEC 91 GIRCI « CH non CHU » 07/2012/ I. Hérafa
 Epi enseignement
Epi enseignement Pratique examen casper
Pratique examen casper Partie theorique
Partie theorique Analyse du destin
Analyse du destin Enseignement pratique interdisciplinaire
Enseignement pratique interdisciplinaire Epi enseignement pratique interdisciplinaire
Epi enseignement pratique interdisciplinaire Pratique 4 lettres
Pratique 4 lettres Iso dumont
Iso dumont Frais de recherche et de développement syscohada
Frais de recherche et de développement syscohada Recherche par image
Recherche par image Recherche opérationnelle
Recherche opérationnelle Recherche tabou python
Recherche tabou python Trigonoptose
Trigonoptose Cidreq recherche simple
Cidreq recherche simple Recherche d image
Recherche d image V
V Recherche par image google
Recherche par image google Recherche dichotomique
Recherche dichotomique Initiation à la recherche en soins infirmiers
Initiation à la recherche en soins infirmiers Suz uzh
Suz uzh Moteur de recherche exemple
Moteur de recherche exemple Recherche photos
Recherche photos Recherche séquentielle
Recherche séquentielle Recherche inversée par image
Recherche inversée par image Pcp ii 65
Pcp ii 65 Eureka recherche documentaire
Eureka recherche documentaire Recherche par image
Recherche par image Recherche des besoins
Recherche des besoins Tri rapide algorithme
Tri rapide algorithme Définition de la recherche qualitative
Définition de la recherche qualitative Recherche par image
Recherche par image Amf recherche avancée
Amf recherche avancée Prosper lucas domaine de recherche
Prosper lucas domaine de recherche Recherche 4life
Recherche 4life Infosphere uqam
Infosphere uqam Recherche image
Recherche image Coledi
Coledi Chanson tunisienne connu
Chanson tunisienne connu Notation asymptotique
Notation asymptotique Mthodologie
Mthodologie Recherche par image
Recherche par image Cross-docking définition
Cross-docking définition Heuristique intelligence artificielle
Heuristique intelligence artificielle Recherche documentaire
Recherche documentaire Approche clinique définition
Approche clinique définition Clinique tso
Clinique tso Score higham
Score higham Apalesthesie
Apalesthesie Clinique cma
Clinique cma Clinique traitement ibogaïne
Clinique traitement ibogaïne Cas clinique insuffisance cardiaque
Cas clinique insuffisance cardiaque Raisonnement et démarche clinique infirmière exemple
Raisonnement et démarche clinique infirmière exemple Jean pierre hladky
Jean pierre hladky Examen clinique du foie
Examen clinique du foie Dr bouraima
Dr bouraima Hypnose clinique melle
Hypnose clinique melle La clinique du sac
La clinique du sac Je suis au clinique
Je suis au clinique Neurologue clinique bonnefon alès
Neurologue clinique bonnefon alès Cas clinique infirmier chirurgie
Cas clinique infirmier chirurgie Exemple de problème réel et potentiel
Exemple de problème réel et potentiel Clinique du stress brugmann
Clinique du stress brugmann Clinique chaurand
Clinique chaurand Neuropsychologie clinique
Neuropsychologie clinique La psychologie clinique
La psychologie clinique Clinique de la main trappes
Clinique de la main trappes Vignette clinique exemple
Vignette clinique exemple Valle giulia clinic rome
Valle giulia clinic rome Pr
Pr Affict
Affict Katia bunaux
Katia bunaux Clinique bezannes orl
Clinique bezannes orl Cas clinique neurologie
Cas clinique neurologie