La raction chimique Exercice Exercice 3 Le chalumeau









- Slides: 29

La réaction chimique Exercice.

Exercice 3. Le chalumeau oxyacétylénique est alimenté par deux gaz : l’acétylène C 2 H 2 et le Explication du principe de fonctionnement du chalumeau. dioxygène. La combustion de l’acétylène porte le métal chauffé à très haute température. En fermant l’arrivée d’acétylène, le métal brûle ensuite sous le jet de dioxygène pur. Aucune importance pour la suite de l’exercice. 1. La combustion du fer dans le dioxygène donne l’oxyde de fer Fe 3 O 4. Ecrire et équilibrer l’équation bilan de cette réaction. 2. Calculer la masse de fer disparue lorsque 200 g de dioxygène ont brûlé. 3. Calculer le volume de dioxygène nécessaire pour brûler 84 g de fer. Données : MH = 1 g/mol ; MO = 16 g/mol ; MC = 12 g/mol ; MFe = 56 g/mol VM = 24 L/mol.

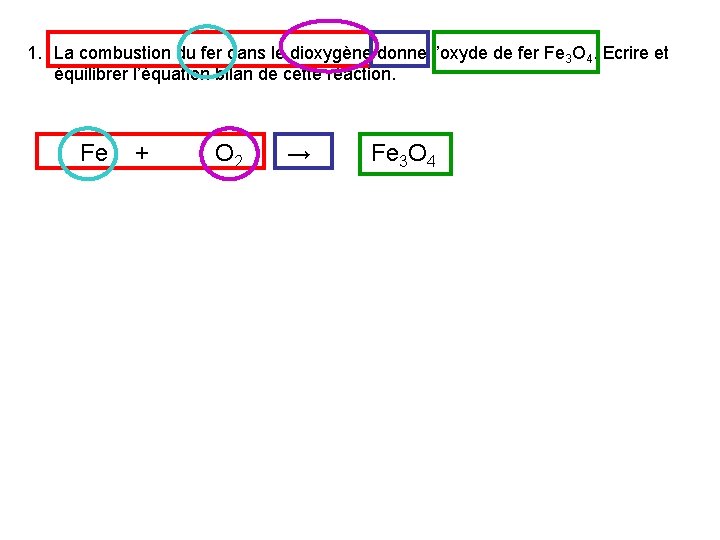
1. La combustion du fer dans le dioxygène donne l’oxyde de fer Fe 3 O 4. Ecrire et équilibrer l’équation bilan de cette réaction. Fe + O 2 → Fe 3 O 4

1. La combustion du fer dans le dioxygène donne l’oxyde de fer Fe 3 O 4. Ecrire et équilibrer l’équation bilan de cette réaction. 3 Fe + O 2 2 → Fe 3 O 4 1 atome de Fe 2 atome de O 3 atome de Fe 4 atome de O

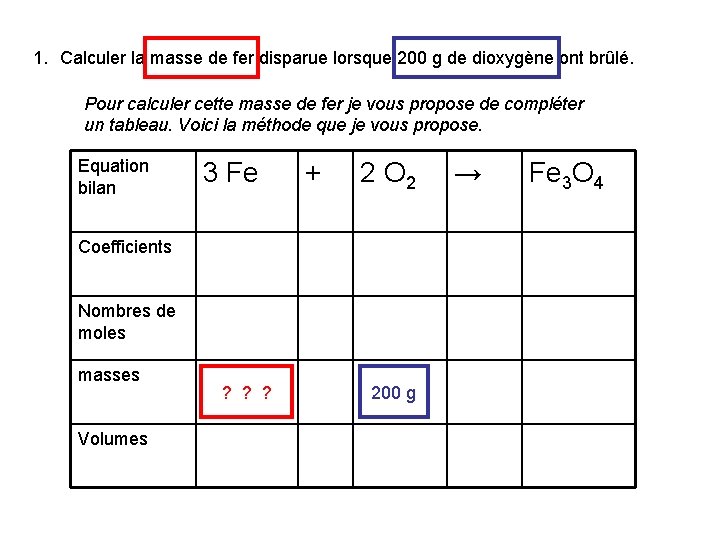
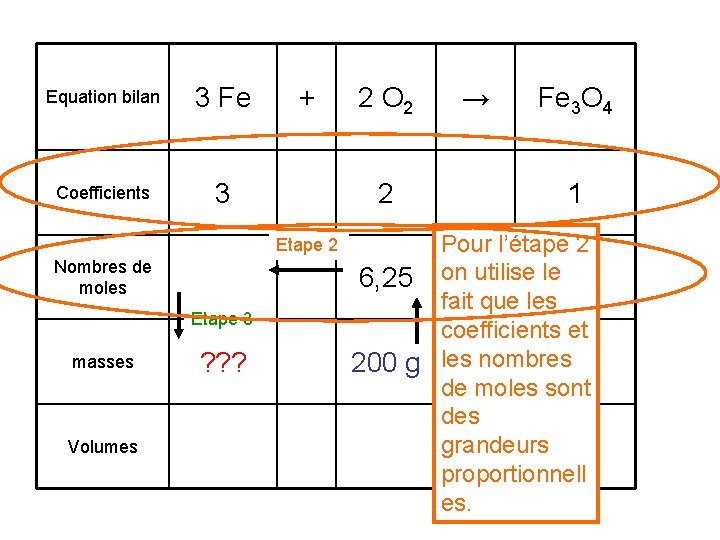
1. Calculer la masse de fer disparue lorsque 200 g de dioxygène ont brûlé. Pour calculer cette masse de fer je vous propose de compléter un tableau. Voici la méthode que je vous propose. Equation bilan 3 Fe + 2 O 2 Coefficients Nombres de moles masses Volumes ? ? ? 200 g → Fe 3 O 4

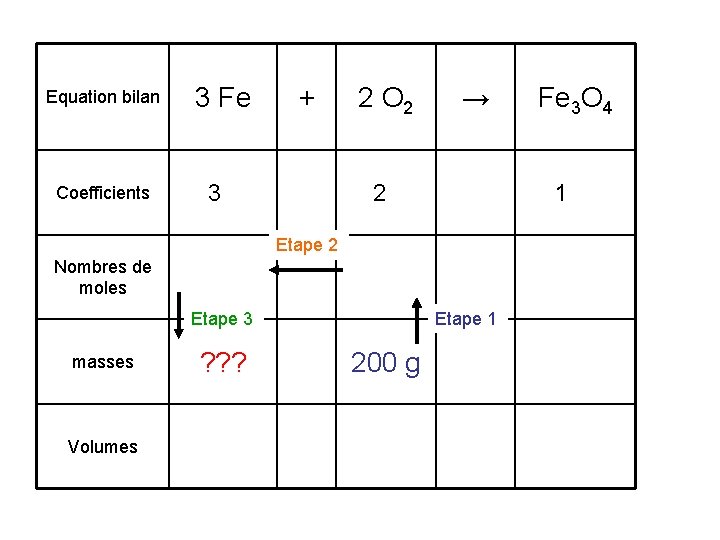
Equation bilan Coefficients 3 Fe + 3 2 O 2 → 2 1 Etape 2 Nombres de moles Etape 3 masses Volumes ? ? ? Etape 1 200 g Fe 3 O 4

Equation bilan 3 Fe + 2 O 2 → Fe 3 O 4 Etape 1 : On cherche à calculer un nombre de moles (n) connaissant une masse (m). Il faut donc utiliser la formule : n = m / M Coefficients 3 2 1 Etape 2 Nombres de moles Etape 3 masses Volumes ? ? ? Etape 1 200 g

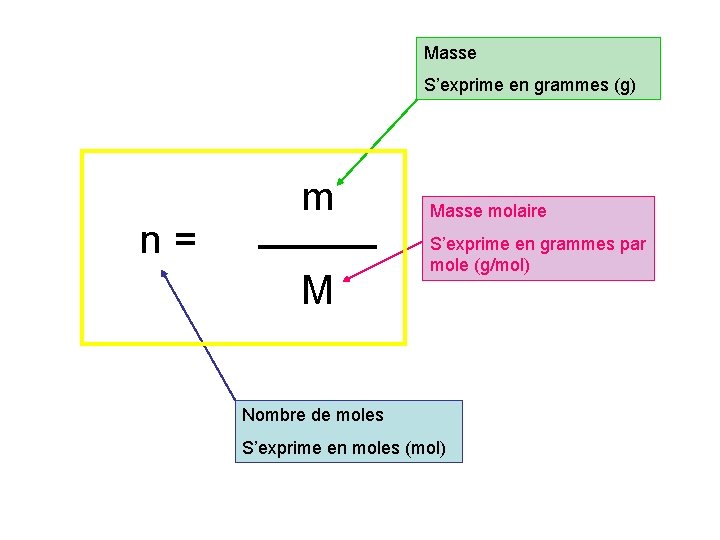
Masse S’exprime en grammes (g) n = m M Masse molaire S’exprime en grammes par mole (g/mol) Nombre de moles S’exprime en moles (mol)

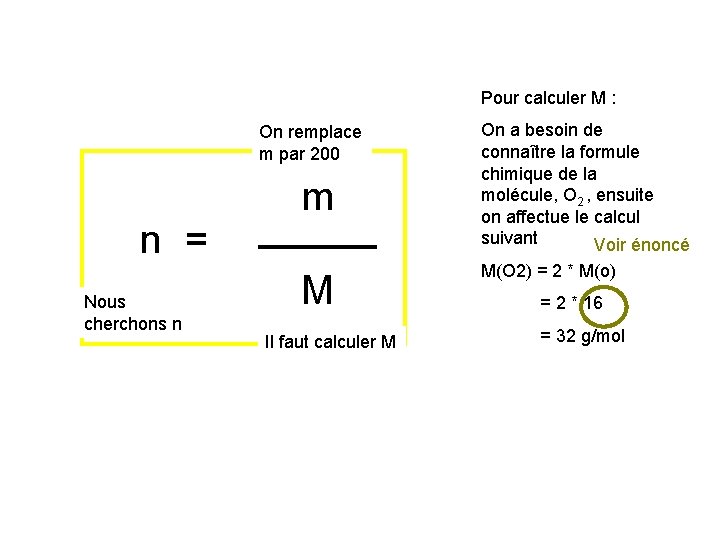
Pour calculer M : On remplace m par 200 n = Nous cherchons n m M Il faut calculer M On a besoin de connaître la formule chimique de la molécule, O 2 , ensuite on affectue le calcul suivant Voir énoncé M(O 2) = 2 * M(o) = 2 * 16 = 32 g/mol

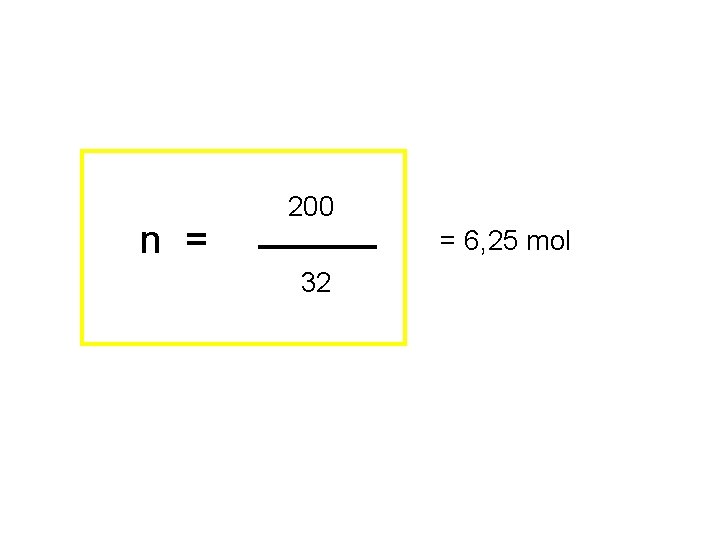
n = m 200 = 6, 25 mol 32

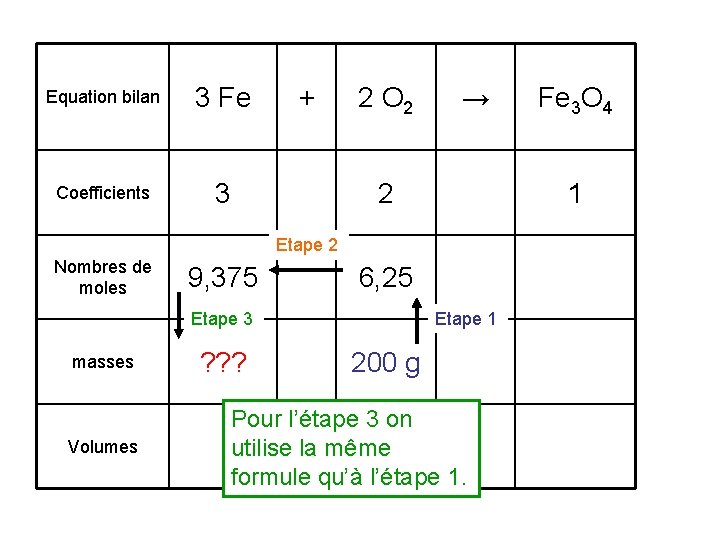
Equation bilan 3 Fe Coefficients 3 + 2 Etape 2 Nombres de moles Etape 3 masses Volumes ? ? ? 2 O 2 → Fe 3 O 4 1 Pour l’étape 2 6, 25 on utilise le fait que les Etape 1 coefficients et 200 g les nombres de moles sont des grandeurs proportionnell es.

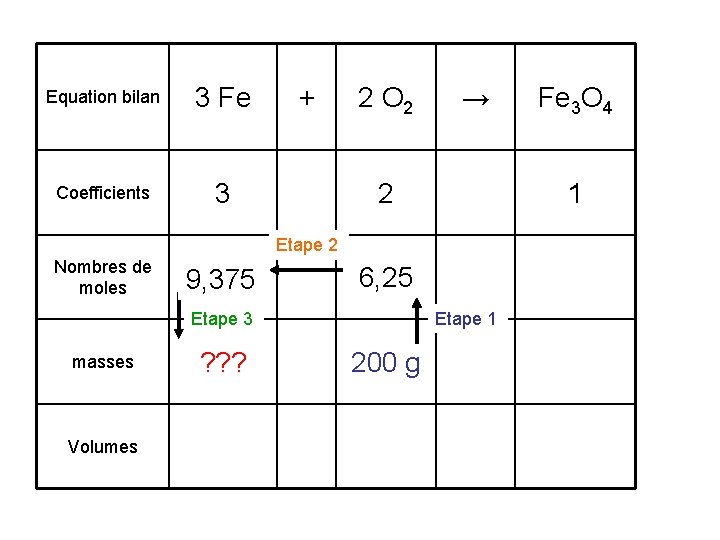
Equation bilan 3 Fe Coefficients 3 + 2 O 2 → 2 1 Etape 2 Nombres de moles 3*6, 25/2 9, 375 6, 25 Etape 3 masses ? ? ? Volumes Etape 1 200 g Fe 3 O 4

Equation bilan 3 Fe Coefficients 3 + 2 O 2 → 2 1 Etape 2 Nombres de moles 9, 375 6, 25 Etape 3 masses Volumes ? ? ? Fe 3 O 4 Etape 1 200 g Pour l’étape 3 on utilise la même formule qu’à l’étape 1.

Masse S’exprime en grammes (g) n = m M Masse molaire S’exprime en grammes par mole (g/mol) Nombre de moles S’exprime en moles (mol)

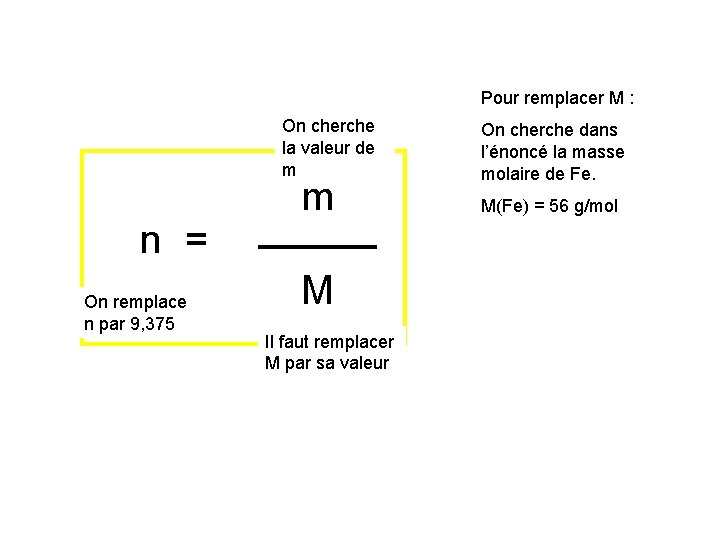
Pour remplacer M : On cherche la valeur de m n = On remplace n par 9, 375 m M Il faut remplacer M par sa valeur On cherche dans l’énoncé la masse molaire de Fe. M(Fe) = 56 g/mol

m m 9, 375 = 56 Donc m = 9, 375 * 56 = 525 g

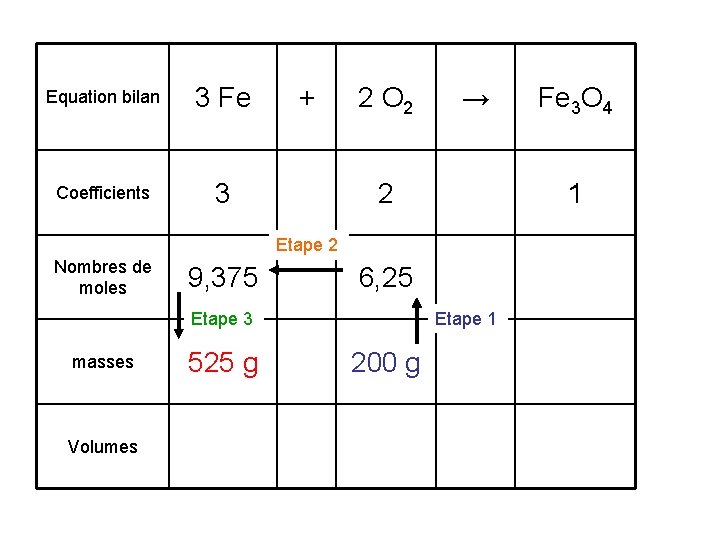
Equation bilan 3 Fe Coefficients 3 + 2 O 2 → 2 1 Etape 2 Nombres de moles 9, 375 6, 25 Etape 3 masses 525 g Volumes Etape 1 200 g Fe 3 O 4

1. Calculer la masse de fer disparue lorsque 200 g de dioxygène ont brûlé. La masse de fer qui a disparue est 525 g

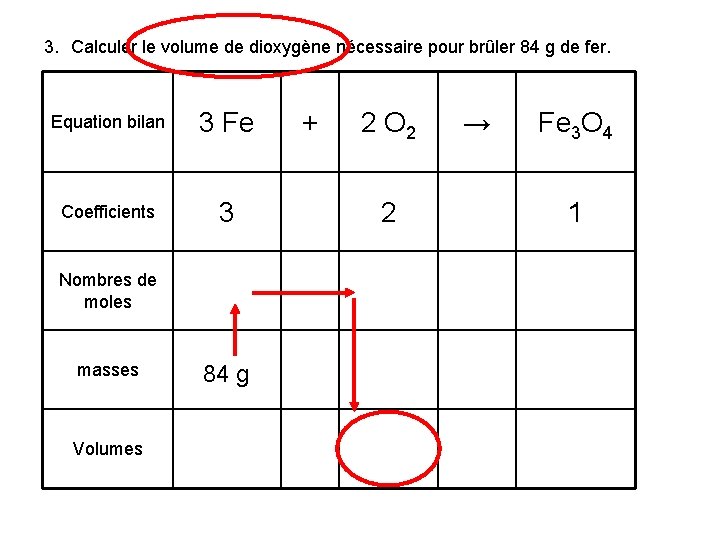
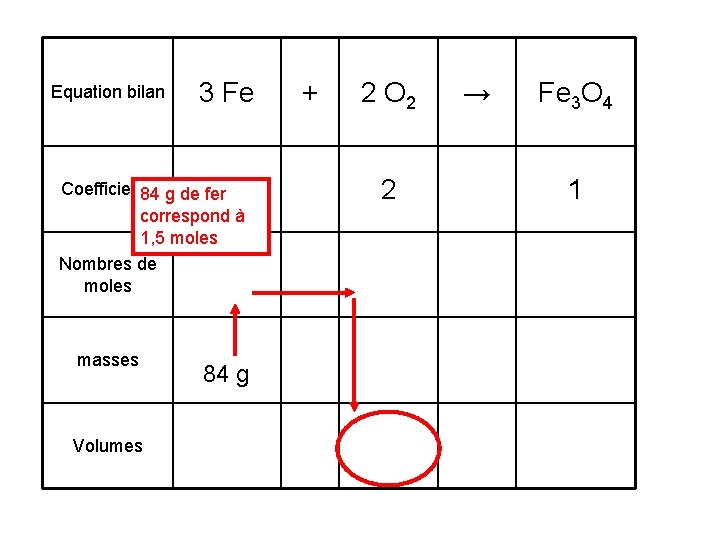
3. Calculer le volume de dioxygène nécessaire pour brûler 84 g de fer. Equation bilan 3 Fe Coefficients 3 Nombres de moles masses 84 g Volumes + 2 O 2 2 → Fe 3 O 4 1

Equation bilan 3 Fe Coefficients 3 84 g de fer correspond à 1, 5 moles Nombres de moles masses Volumes 84 g + 2 O 2 2 → Fe 3 O 4 1

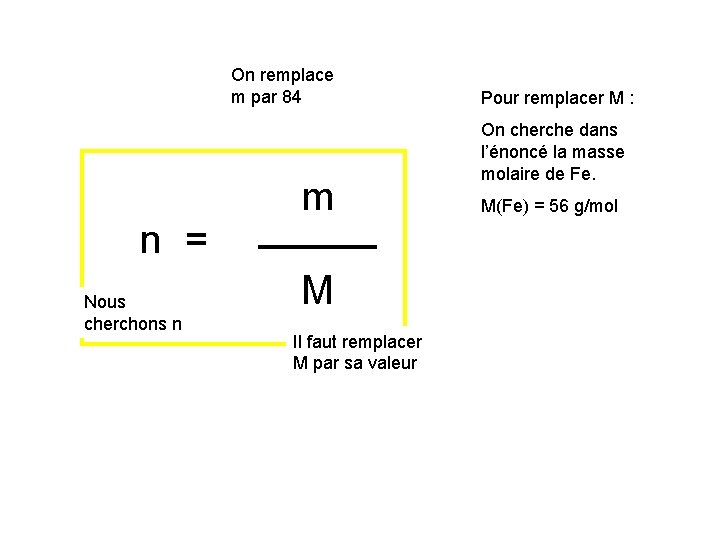
On remplace m par 84 n = Nous cherchons n m M Il faut remplacer M par sa valeur Pour remplacer M : On cherche dans l’énoncé la masse molaire de Fe. M(Fe) = 56 g/mol

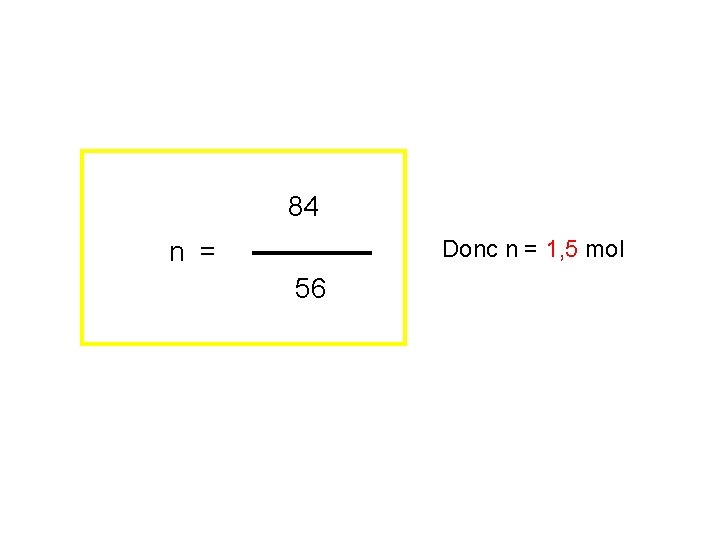
84 m Donc n = 1, 5 mol n = 56

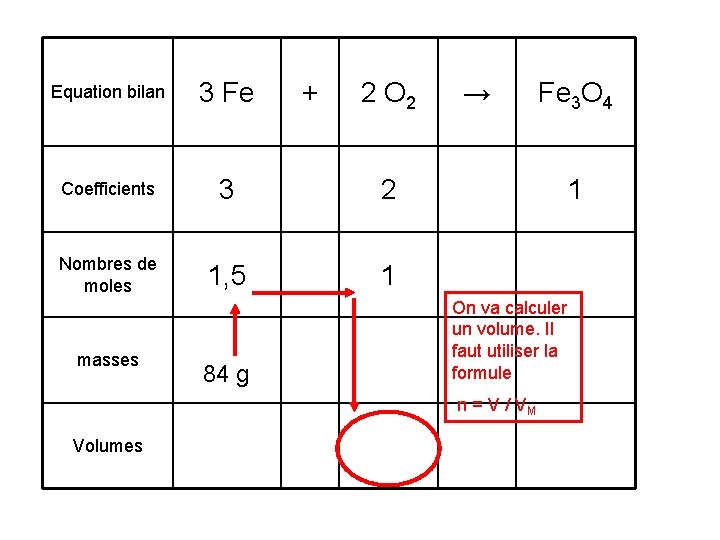
Equation bilan 3 Fe + 2 O 2 → Fe 3 O 4 proportionnalité Coefficients 3 Nombres de moles 1, 5 masses Volumes 84 g 2 1 1

Equation bilan 3 Fe Coefficients 3 2 Nombres de moles 1, 5 1 masses 84 g + 2 O 2 → 1 On va calculer un volume. Il faut utiliser la formule n = V / VM Volumes Fe 3 O 4

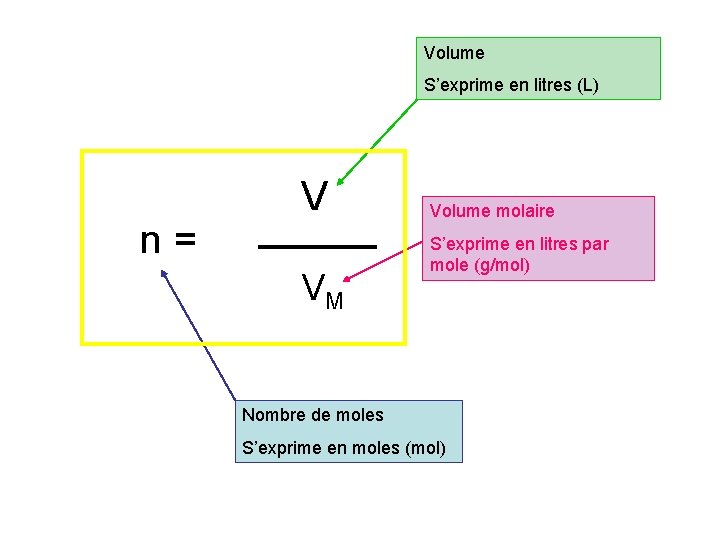
Volume S’exprime en litres (L) n = V VM Volume molaire S’exprime en litres par mole (g/mol) Nombre de moles S’exprime en moles (mol)

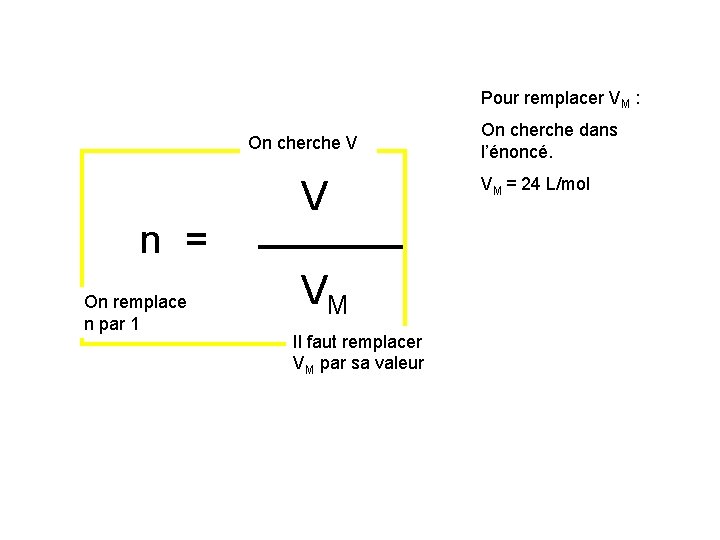
Pour remplacer VM : On cherche V n = On remplace n par 1 V V M Il faut remplacer VM par sa valeur On cherche dans l’énoncé. VM = 24 L/mol

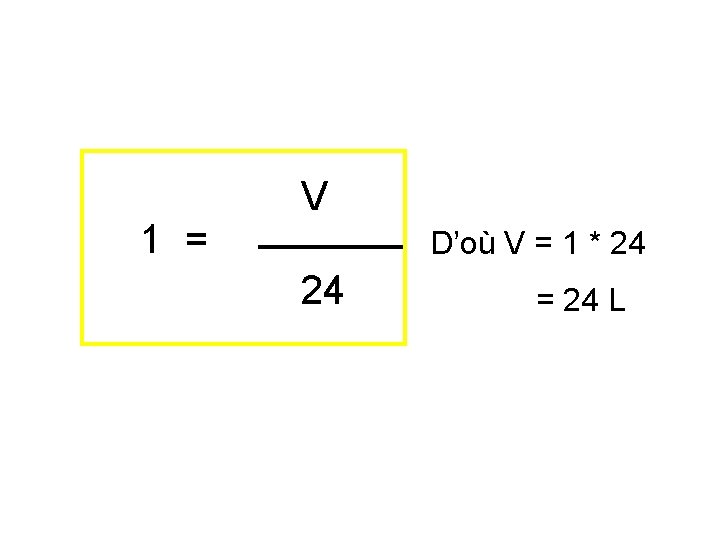
1 = V D’où V = 1 * 24 24 = 24 L

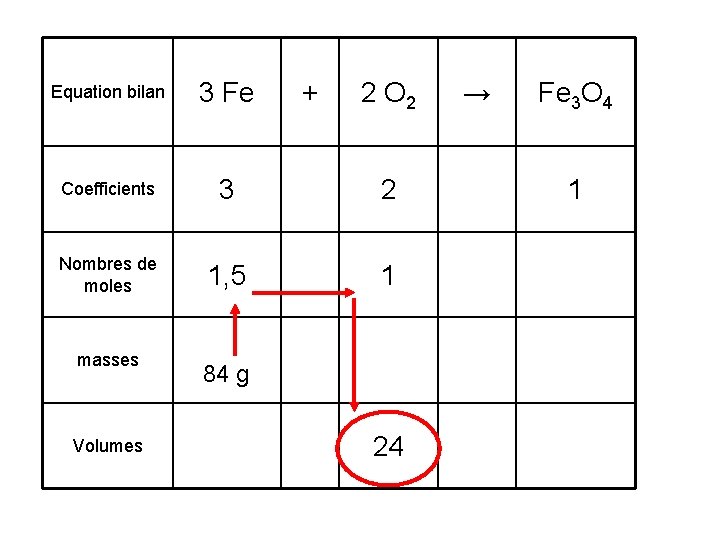
Equation bilan 3 Fe Coefficients 3 2 Nombres de moles 1, 5 1 masses Volumes + 2 O 2 84 g 24 → Fe 3 O 4 1

3. Calculer le volume de dioxygène nécessaire pour brûler 84 g de fer. 1. Le volume de dioxygène nécessaire pour brûler 84 g de fer est 24 L.