La pressione colloidoosmotica o pressione oncotica Si analizzi














- Slides: 21

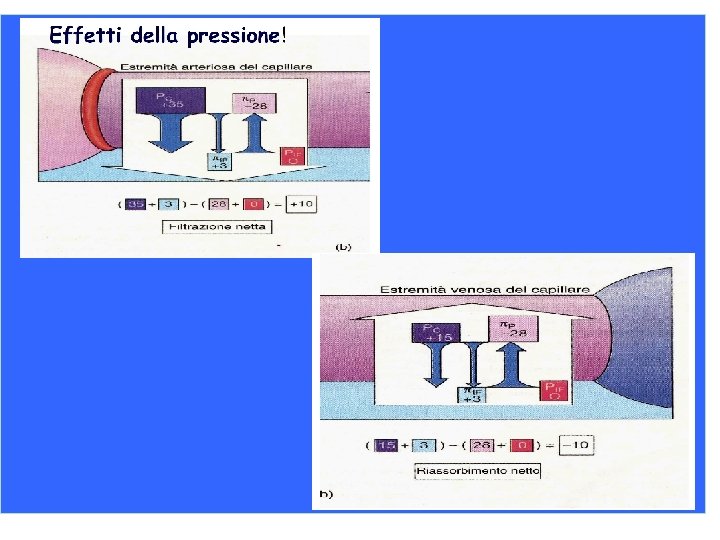
La pressione colloido-osmotica o pressione oncotica Si analizzi il sangue e il liquido interstiziale 1) COLLOIDE: pressione idrostatica del sangue è una particella con un peso molecolare >30. 000 Da 130 -140 mm. Hg in aorta presente in soluzione 35 mm. Hg capillari arteriosi partecipare alla pressione osmotica totale di una 15 Possono mm. Hg nel distretto venoso soluzione? Certamente perché… 2) Pressione idrostatica interstiziale ~0 Tale componente influenza solo in bassa percentuale la pressione osmotica totale, ma è talmente importante da essere denominata in diverso: pressione (meno 300 dell’ 1% del totale). 3) modo Pressione osmotica dei colloido soluti nelosmotica sangue (circa m. Os. M) Piccoli soluti Perché ne parliamo? 154 m. M Na. Cl (0, 9 %) 6, 7 Atm 5100 mm. Hg Proteine plasmatiche 7, 3 g% 4, 5 g albumina (65 k. Da) 2, 5 g globuline (150 k. Da) 0, 3 g fibrinogeno LA k. Da) PRESSIONE COLLOIDO OSMOTICA assicura che l’acqua rimanga (330 all’internooncotica del letto capillare. Pressione = 28 mm. Hg legate alla pressione colloido osmotica: malnutrizione, 4) Patologie Pressione oncotica negli spazi interstiziali malassorbimento, anoressia, cirrosi epatica… proteine pari a 1, 8 % pressione oncotica 3 -4 mm. Hg Viene espressa in osmoralità= osmoli/L

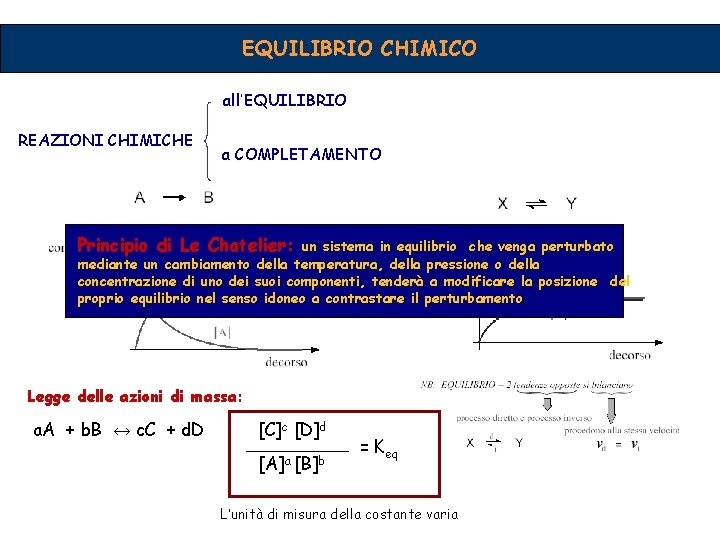
EQUILIBRIO CHIMICO all’EQUILIBRIO REAZIONI CHIMICHE a COMPLETAMENTO Principio di Le Chatelier: un sistema in equilibrio che venga perturbato mediante un cambiamento della temperatura, della pressione o della concentrazione di uno dei suoi componenti, tenderà a modificare la posizione del proprio equilibrio nel senso idoneo a contrastare il perturbamento Legge delle azioni di massa: a. A + b. B ↔ c. C + d. D [C]c [D]d [A]a [B]b = Keq L’unità di misura della costante varia

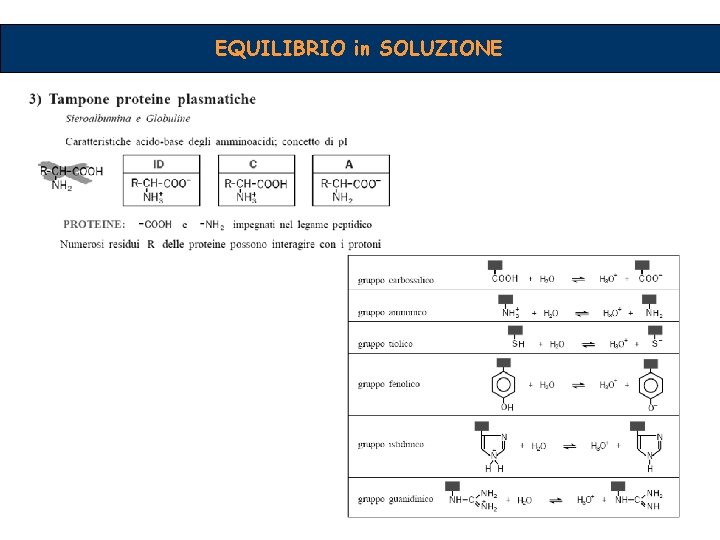
EQUILIBRIO CHIMICO Quale caratteristica possono avere i soluti in soluzione? Essere o non essere Elettrolita Acidi Basi Sali Acidi e Basi Arrhenius: acido: sostanza che in soluzione acquosa libera ioni H + base: sostanza che in soluzione libera ioni OH- Brönsted-Lowry: acido: sostanza capace di cedere protoni base: sostanza capace di assumere protoni Lewis: acido: sostanza che accetta coppie elettroniche base: sostanza che fornisce coppie elettroniche

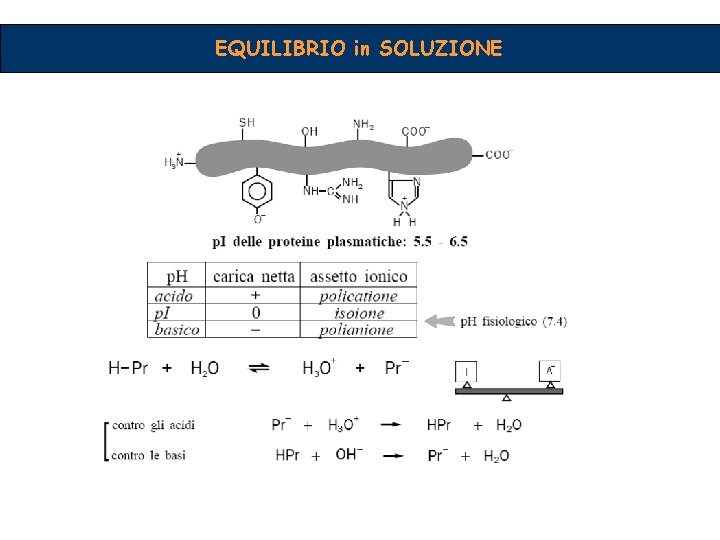
EQUILIBRIO in SOLUZIONE Teoria di Brönsted. Lowry Un acido forte cede facilmente protoni Un acido debole cede protoni con minor facilità Una base forte attrae con forza protoni Una base debole li attira debolmente Non esistono solo acidi o solo basi, ma coppie coniugate Stiamo considerando reazioni all’equilibrio Ogni reazione acido base va considerata come un confronto tra due acidi o come Competizione tra due basi HCl + H 2 O H 3 O+ + Cl-

EQUILIBRIO in SOLUZIONE Equilibrio in soluzione Esempi di coppie coniugate Il concetto di forte e debole può avere un significato Quanto piùdissociazione forte ècompleta una specie, assoluto, e parziale oppure un significato relativo se la forza tantorispettivamente, più debole è quella ad essa viene confrontata con una sostanza di riferimento (per es l’acqua) coniugata HCl + H 2 O ↔ H 3 O+ + Cl- Si riconoscono due coppie coniugate La posizione dell’equilibrio è determinata dalla forza relativa delle due coppie coniugate

EQUILIBRIO in SOLUZIONE Equilibrio in soluzione L’acqua compare due volte manifestando un doppio ruolo Sostanze anfotere Capacità di comportarsi sia da acidi che da basi Ognuna delle coppie coniugate possiede sarà presente in soluzione a concentrazioni dipendenti dalla loro costante di dissociazione Ka o K b

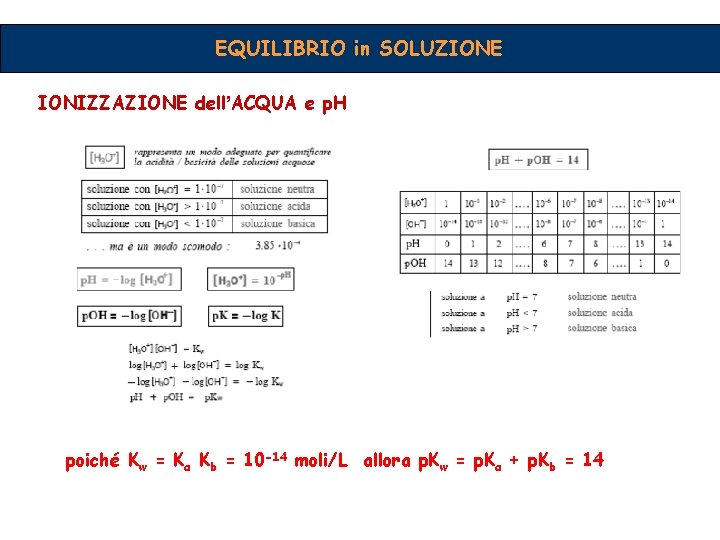
EQUILIBRIO in SOLUZIONE IONIZZAZIONE dell’ACQUA H 2 O H+ + OH- H 2 O + H 2 O H 3 O+ + OH- [H 3 O+] [OH-] In ogni soluzione acquosa [H 3 O+] e = costante [H 2 O] = 55. 55 M = (1000 gr/18) 2 [OH-] non possono assumere[H valori 2 O] qualunque! sono strettamente -14 [H 3 O+] [OH-] = IKwrispettivi = 1 x 10 valori (25°C) correlati tra loro Kw = K a K b

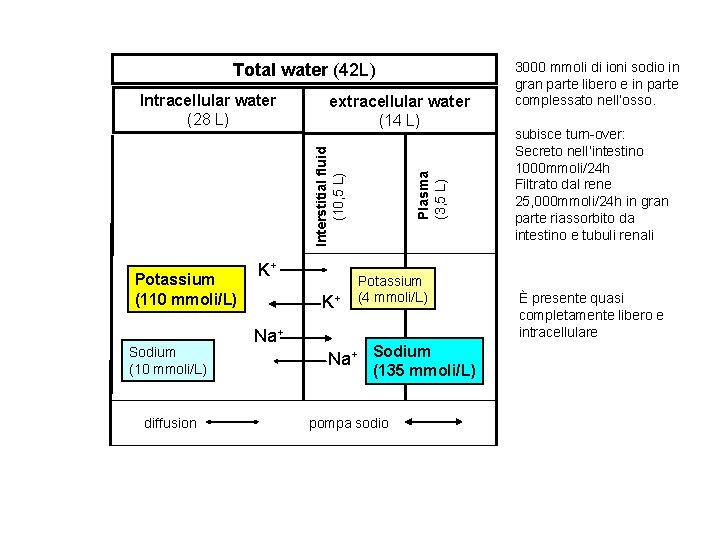
L’acqua rappresenta il 60% del peso corporeo nell’uomo e il 55% nella donna Di questo: 66% ICF fluido intracellulare 33% ECF fluido extracellulare 8% plasma L’acqua non è trasportata attivamente all’interno dell’organismo, ma c’è libera permeabilità tra ICF e ECF determinato dalla pressione osmotica tra i compartimenti. (ad eccezione del rene, la concentrazione osmotica, o osmolarità, di questi compartimenti è uguale, sono isotonici) Ogni modificaazione nel contenuto di soluti, determina una mobilitazione di acqua che ristabilisce l’isotonicità ECF: maggior contributo alla osmolalità (282. 295 mmoli/kg di acqua) è lo ione sodio e i suoi anioni associati , cloro e bicarbonato, + glucosio e urea ICF: maggior contributo alla osmolalità è lo ione potassio Proteine hanno un contributo marginale (0, 5%), ma hanno un ruolo importante nel determinare la ditribuzione dell’acqua tra compartimento dell’endotelio capillare e il liquido interstiziale : il contributo delle proteine alla pressione osmotica del plasma e nota come pressione colloido osmotica o pressione oncotica Acqua prodotta dal metabolismo ossidativo e dalla dieta

Total water (42 L) extracellular water (14 L) Potassium (110 mmoli/L) Sodium (10 mmoli/L) diffusion K+ K+ Na+ Plasma (3, 5 L) Interstitial fluid (10, 5 L) Intracellular water (28 L) Potassium (4 mmoli/L) Na+ Sodium (135 mmoli/L) pompa sodio 3000 mmoli di ioni sodio in gran parte libero e in parte complessato nell’osso. subisce turn-over: Secreto nell’intestino 1000 mmoli/24 h Filtrato dal rene 25, 000 mmoli/24 h in gran parte riassorbito da intestino e tubuli renali È presente quasi completamente libero e intracellulare

PERDITA DI ACQUA: CAUSE: INDICAZIONI CLINICHE: Aumentata perdita Dal rene: disordini tubuli renali diabete insipido incremento del carico osmotico dovuto a diabete mellito diuretici osmotici o alto consumo di proteine Dalla pelle: sudorazione Dal polmone: iperventilazione Dall’intestino: diarrea (in bambini) Sintomi Sete Secchezza delle fauci Difficoltà a deglutire Debolezza Confusione Diminuito apporto Infanzia Disfagia Età avanzata Incoscienza restrizione dell’apporto orale ECCESSO Di ACQUA CAUSE: Aumentato apporto Bere in modo compulsivo Eccessivo apporto parenterale di fluidi Assorbimento di acqua durante l’irrigazione della milza Diminuita escrezione blocco renale (severo) Carenza di cortisolo Inappropriata secrezione di vasopressina Farmaci: diuretici potenzianti azione vasopressoria agonisti come l’ossitocina INDICAZIONI CLINICHE: Disturbi del comportamento Confusione Mal di testa Convulsioni Coma Risposta all’estensore plantare


EQUILIBRIO in SOLUZIONE IONIZZAZIONE dell’ACQUA e p. H poiché Kw = Ka Kb = 10 -14 moli/L allora p. Kw = p. Ka + p. Kb = 14

• p. H di alcune soluzioni: • • • • Succhi Gastrici Succo di Limone Aceto Bibite gassate Vino Pomodori Urina Latte Saliva Umana Sangue Umano Uova Fresche Acqua di Mare Bicarbonato di Sodio (soluzione) Carbonato di calcio (soluzione) Detergenti con Ammoniaca p. H = 1. 0 - 3. 0 p. H = 2. 2 - 2. 4 p. H = 2. 4 - 3. 4 p. H = 2. 5 - 3. 5 p. H = 3. 0 - 3. 8 p. H = 4. 0 - 4. 4 p. H = 4. 8 - 7. 0 p. H = 6. 4 - 7. 0 p. H = 7. 0 - 7. 3 p. H = 7. 3 - 7. 5 p. H = 7. 6 - 8. 0 p. H = 7. 8 - 8. 3 p. H = 8. 4 p. H = 9. 4 p. H = 10. 5 – 11. 9

EQUILIBRIO in SOLUZIONE

EQUILIBRIO in SOLUZIONE

Acidosi e alcalosi metabolica cause dell’acidosi § fatica muscolare (acido lattico) § diabete mellito (acidi dal metabolismo dei lipidi) § insufficienza renale (accumulo di H+ nel plasma) § diuretici inibitori dell’anidrasi carbonica (minor riassorbimento di HCO 3–, [HCO 3 -] plasmatica) cause dell’alcalosi § vomito (perdita di HCl) § aldosterone (aumentata secrezione renale di H+) § assunzione di sali alcalini (Na. HCO 3) Acidosi e alcalosi respiratoria cause § causate da una ridotta o aumentata ventilazione alveolare § sono entrambe compensate dal riequilibrio acido-base a livello renale coinvolgendo tamponi non bicarbonato (fosfati, proteine plasmatiche)

EQUILIBRIO in SOLUZIONE = (αPCO 2)= con α = 0, 031 mmoli/L) H 2 CO 3 può essere modificata dalla ventilazione polmonare H 2 CO 3 - può essere modificata a livello renale; per ogni H+ secreto, viene riassorbito uno ione bicarbonato

EQUILIBRIO in SOLUZIONE

EQUILIBRIO in SOLUZIONE

EQUILIBRIO in SOLUZIONE

EQUILIBRIO in SOLUZIONE
 Pressione oncotica
Pressione oncotica Pressione colloido-osmotica
Pressione colloido-osmotica Pressão oncótica e hidrostática
Pressão oncótica e hidrostática Diferença de exsudato e transudato
Diferença de exsudato e transudato Pressione assoluta e relativa
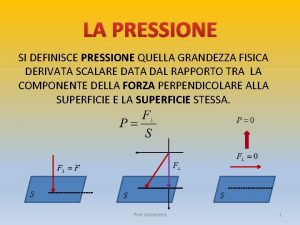
Pressione assoluta e relativa Legge pascal
Legge pascal Pressione atmosferica
Pressione atmosferica Pressione relativa
Pressione relativa Natriuresi
Natriuresi Il diavoletto di cartesio
Il diavoletto di cartesio Tabella pressione arteriosa in base all'età
Tabella pressione arteriosa in base all'età Metodi di purificazione
Metodi di purificazione Pressione osmotica
Pressione osmotica Calorimetro a scansione differenziale ad alta pressione
Calorimetro a scansione differenziale ad alta pressione Esperimento di hertz onde elettromagnetiche zanichelli
Esperimento di hertz onde elettromagnetiche zanichelli Pressione enter
Pressione enter Valori pressione arteriosa media
Valori pressione arteriosa media Pugno precordiale
Pugno precordiale Escursione nictemerale della pressione arteriosa
Escursione nictemerale della pressione arteriosa Pressione nei fluidi
Pressione nei fluidi Kcr canfora
Kcr canfora La pressione dei liquidi
La pressione dei liquidi