La molcule de leau La structure de la










- Slides: 18

La molécule de l’eau

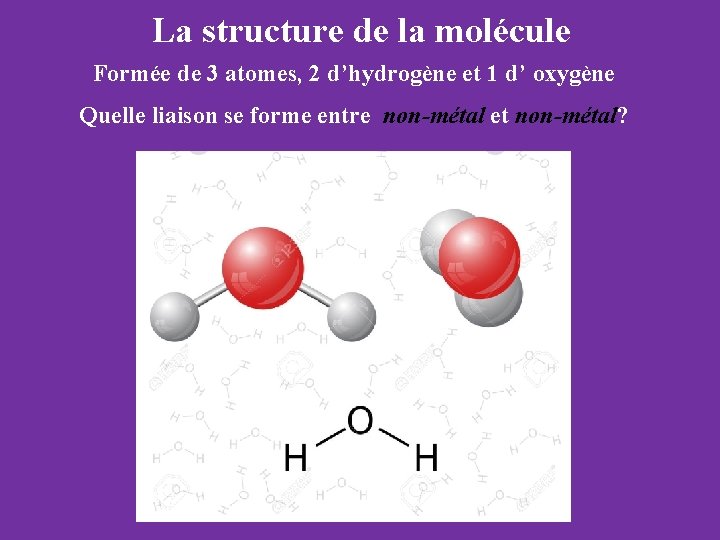
La structure de la molécule Formée de 3 atomes, 2 d’hydrogène et 1 d’ oxygène Quelle liaison se forme entre non-métal et non-métal?

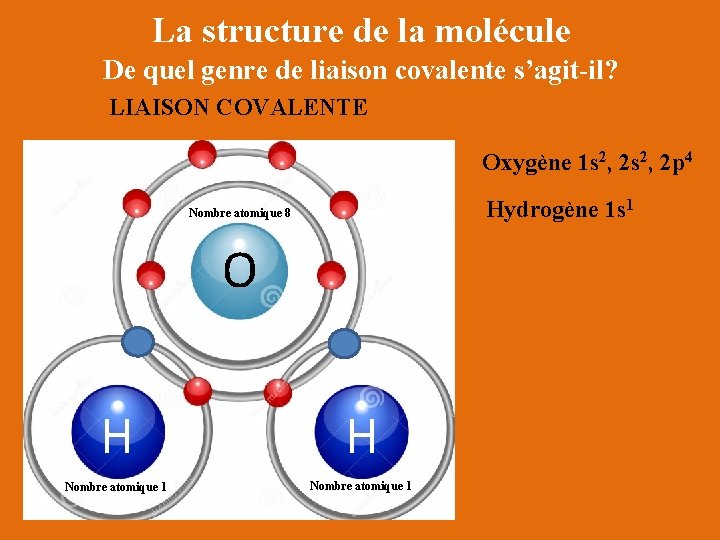
La structure de la molécule De quel genre de liaison covalente s’agit-il? LIAISON COVALENTE Oxygène 1 s 2, 2 p 4 Hydrogène 1 s 1 Nombre atomique 8 O H H Nombre atomique 1

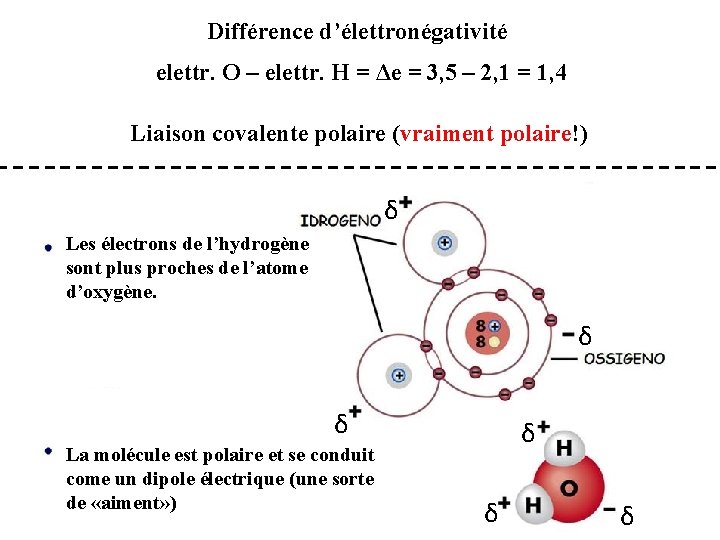
Différence d’élettronégativité elettr. O – elettr. H = Δe = 3, 5 – 2, 1 = 1, 4 Liaison covalente polaire (vraiment polaire!) δ Les électrons de l’hydrogène sont plus proches de l’atome d’oxygène. δ δ La molécule est polaire et se conduit come un dipole électrique (une sorte de «aiment» ) δ δ δ

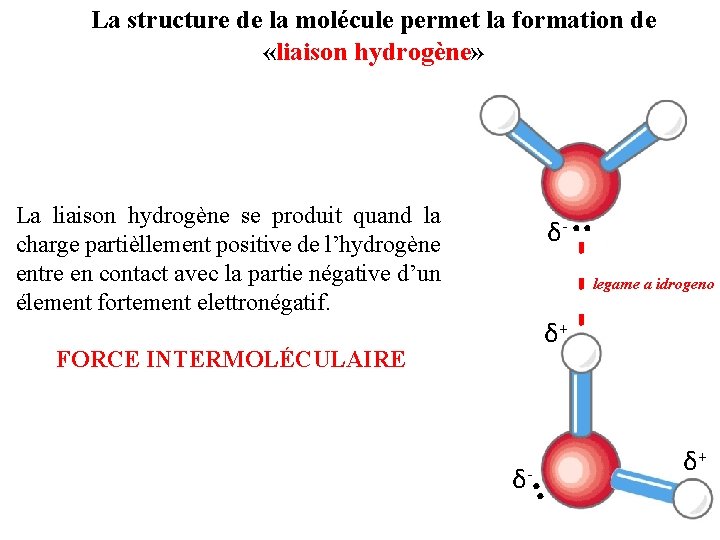
La structure de la molécule permet la formation de «liaison hydrogène» δ-. . - - - La liaison hydrogène se produit quand la charge partièllement positive de l’hydrogène entre en contact avec la partie négative d’un élement fortement elettronégatif. legame a idrogeno δ+ FORCE INTERMOLÉCULAIRE . . δ- δ+


À votre avis, est-ce que cette formation de liaison hygrogène sera la même dans tous les etats de l’eau?

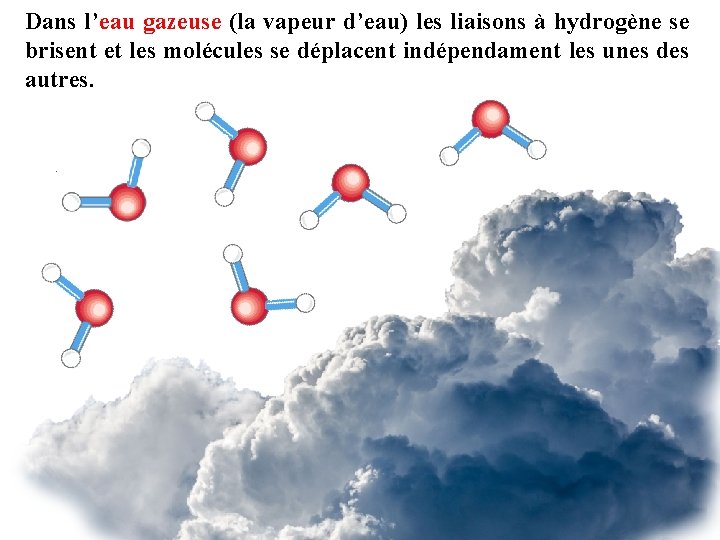
Dans l’eau gazeuse (la vapeur d’eau) les liaisons à hydrogène se brisent et les molécules se déplacent indépendament les unes des autres.

La liaison à hydrogène est une force intermoléculaire «faible» et dans l’eau liquide elle se produit et se brise continuellement entre les molécules.

La liaison à hydrogène est une force intermoléculaire «faible» et dans l’eau liquide elle se produit et se brise continuellement entre les molécules.

Dans l’eau solide (glace) , les liaisons hydrogènes qui se forment sont stables et les molécules sont disposées de façon organisée et régulière donnant ainsi naissance à une structure cristalline bien définie.

Structure cristalline bien définie dans un flocon de neige

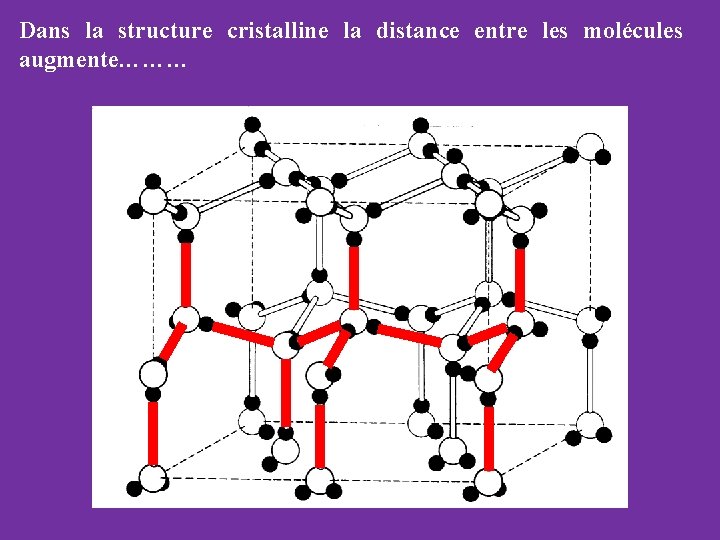
Dans la structure cristalline la distance entre les molécules augmente………

Dans la structure cristalline la distance entre les molécules augmente……….

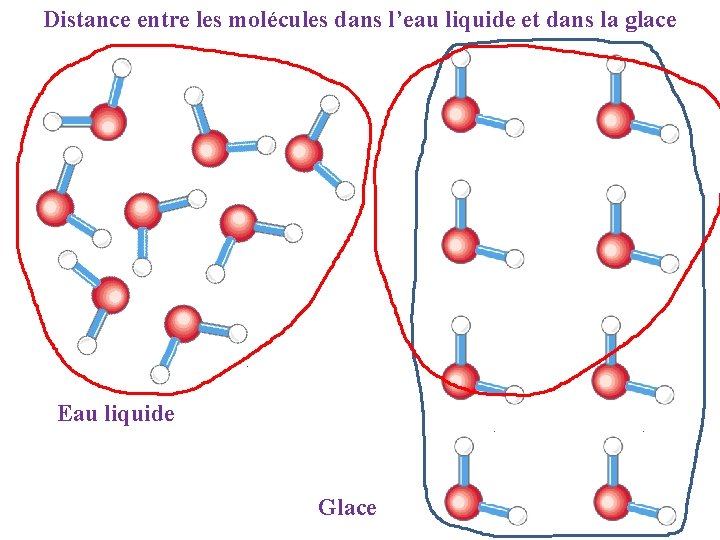
Distance entre les molécules dans l’eau liquide et dans la glace Eau liquide Glace

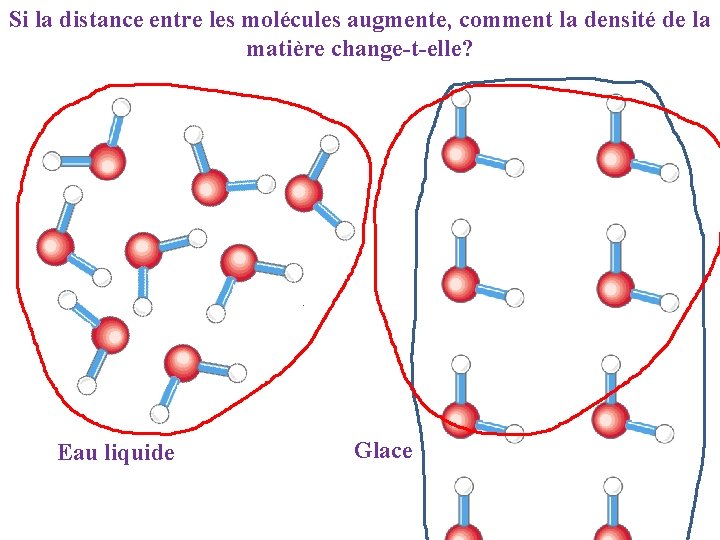
Si la distance entre les molécules augmente, comment la densité de la matière change-t-elle? Eau liquide Glace

Dans la structure cristalline la distance entre les molécules augmente et la densité de l’eau diminue parce-que le volume occupé augmente. En effet la glace flotte sur l’eau car elle est mois dense comme l’eau et l’huile.

au même volume, qu'est-ce qui est plus lourd entre deux? Eau liquide ? Glace