LA MATERIA Y SU ESTRUCTURA 1 Clasificacin de











- Slides: 18

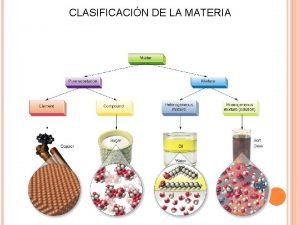
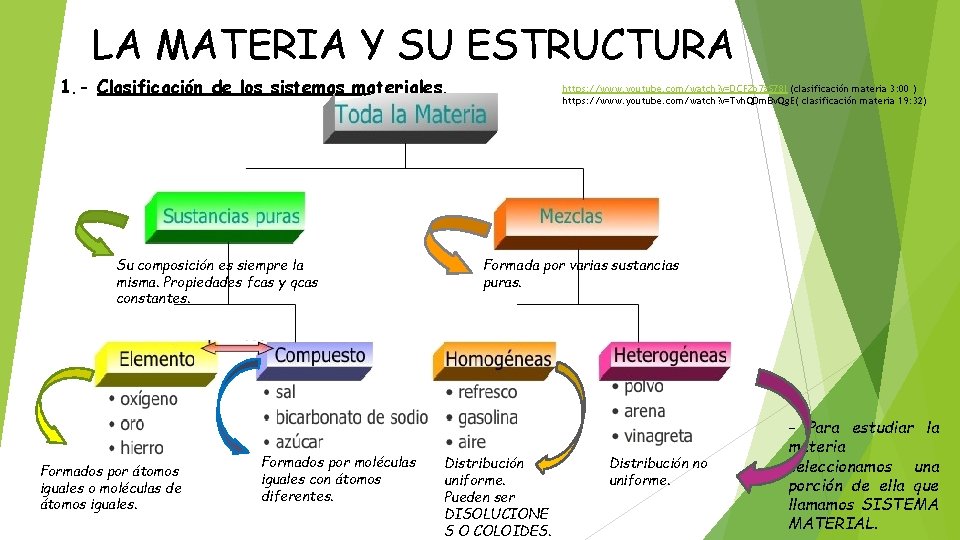
LA MATERIA Y SU ESTRUCTURA 1. - Clasificación de los sistemas materiales. Su composición es siempre la misma. Propiedades fcas y qcas constantes. Formados por átomos iguales o moléculas de átomos iguales. Formados por moléculas iguales con átomos diferentes. https: //www. youtube. com/watch? v=DCFZo 7 z. S 78 I (clasificación materia 3: 00 ) https: //www. youtube. com/watch? v=Tvh. QDm. Bv. Qg. E( clasificación materia 19: 32) Formada por varias sustancias puras. Distribución uniforme. Pueden ser DISOLUCIONE S O COLOIDES. Distribución no uniforme. - Para estudiar la materia seleccionamos una porción de ella que llamamos SISTEMA MATERIAL.

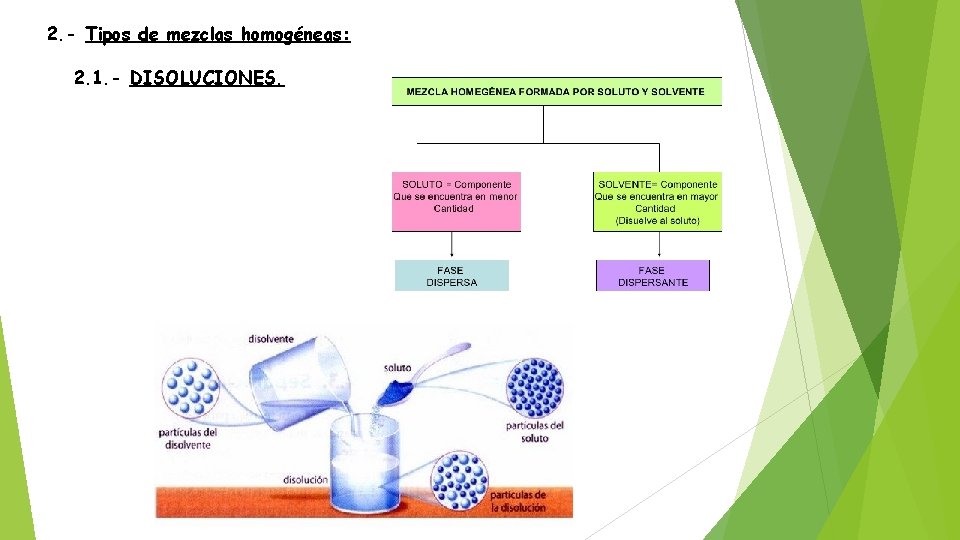
2. - Tipos de mezclas homogéneas: 2. 1. - DISOLUCIONES.

2. 1. 1 - Tipos de disoluciones. a) Según su estado de agregación: DISOLUCIONES LÍQUIDAS: el disolvente es agua Agua + soluto sólido Agua + soluto líquido Agua + soluto gaseoso Agua de mar Alcohol 46º Refresco con gas DISOLUCIONES SÓLIDAS O ALEACIONES: al menos un componente es metal. Acero (Fe + C) Bronce (Cu + Sn) DISOLUCIONES GASEOSAS: el disolvente es gas. Niebla

https: //www. youtube. com/watch? v=83 WT 6 -ef. Qr 0 disoluciones. Tipos. 20: 48 b) Según la proporción entre soluto y disolvente: DISOLUCIONES DILUIDAS: cantidad soluto <<< la que admite el disolvente. DISOLUCIONES SATURADAS: cantidad soluto es la máxima que admite el disolvente a una determinada Tª. DISOLUCIONES CONCENTRADAS: cantidad soluto elevada, pero no llega al máximo que admite el disolvente. DISOLUCIONES SOBRESATURADAS: cantidad soluto es mayor de la que admite el disolvente a una determinada Tª.

2. 1. 2. - Concentración de una disolución.

2. 2. - COLOIDES: Mezcla homogénea formada por partículas microscópicas en estado sólido (fase dispersa) que están dispersas en una sustancia (fase fluida o dispersor). Ø Humo → fase fluida: aire, fase dispersa: partículas sólidas producto de la combustión Ø Espuma de cerveza → fase fluida: líquido de la cerveza, fase dispersa: burbujas de aire microscópicas Ø Espuma de afeitado → fase fluida: líquido de afeitado, fase dispersa: burbujas de aire microscópicas Ø Nata → fase fluida: leche cuajada, fase dispersa: burbujas de aire microscópicas Ø Gelatina → fase fluida: colágeno, fase dispersa: partículas de agua y minerales

Un criterio para determinar si una mezcla es disolución, coloide o mezcla heterogénea es el tamaño de las partículas dispersas.

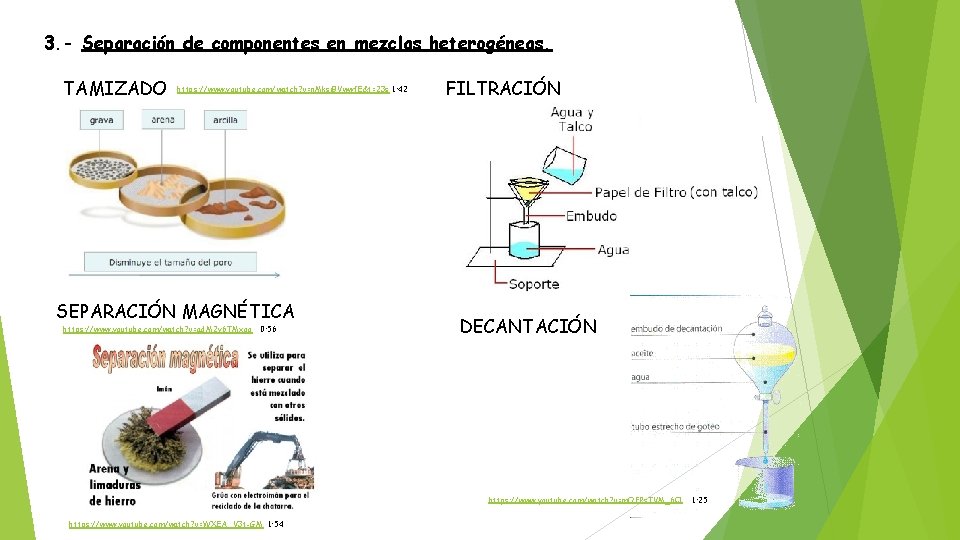
3. - Separación de componentes en mezclas heterogéneas. TAMIZADO https: //www. youtube. com/watch? v=n. Mksi. BVwwf. E&t=23 s 1: 42 SEPARACIÓN MAGNÉTICA https: //www. youtube. com/watch? v=ad. M 2 y 6 TMxgo 0: 56 FILTRACIÓN DECANTACIÓN https: //www. youtube. com/watch? v=m. OFPs. TVM_6 Q https: //www. youtube. com/watch? v=WXEA_V 3 t-GM 1: 54 1: 25

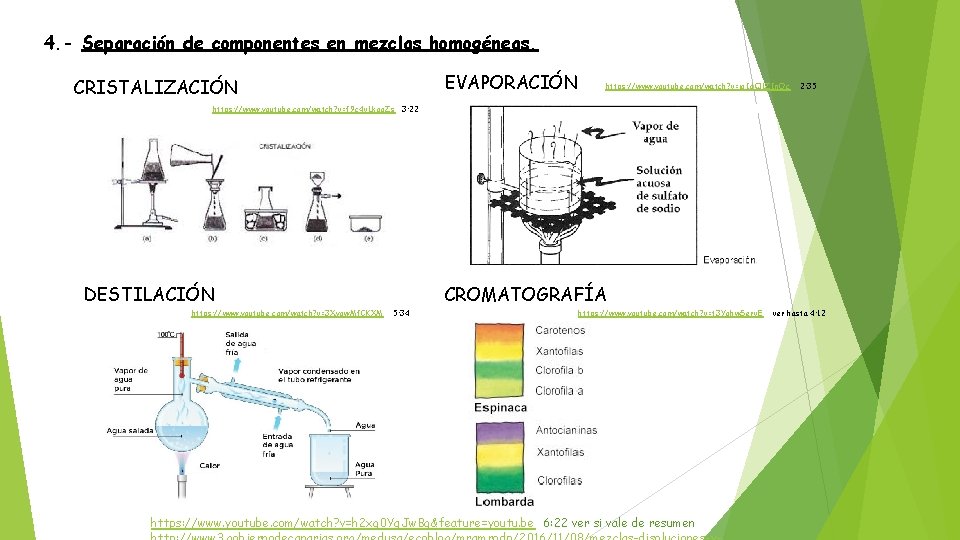
4. - Separación de componentes en mezclas homogéneas. EVAPORACIÓN CRISTALIZACIÓN https: //www. youtube. com/watch? v=iq. Id. Q 1 ZIn. Oc 2: 35 https: //www. youtube. com/watch? v=f 9 c 4 v. Lkgo. Zs 3: 22 DESTILACIÓN https: //www. youtube. com/watch? v=3 Xyqw. Mf. CKXM CROMATOGRAFÍA 5: 34 https: //www. youtube. com/watch? v=t 3 Yohw. Serv. E https: //www. youtube. com/watch? v=h 2 xg 0 Yq. Jw. Bg&feature=youtu. be 6: 22 ver si vale de resumen ver hasta 4: 12

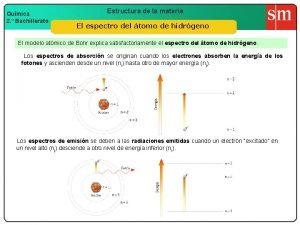
5. - Estructura de una sustancia pura. Formadas por átomos: partícula más pequeña en que un elemento puede ser dividido sin perder sus propiedades químicas. El origen de la palabra átomo proviene del griego, que significa indivisible. En el momento que se bautizaron estas partículas se creía que efectivamente no se podían dividir. Hoy en día sabemos que existen partículas subatómicas. La estructura interna: - Una zona central o NÚCLEO donde se encuentra la carga total positiva (la de los protones) y la mayor parte de la masa del átomo, aportada por los protones y los neutrones. - Una zona externa o CORTEZA donde se hallan los electrones, que giran alrededor del núcleo. ATOMO HIDRÓGENO ATOMO HELIO ATOMO LITIO

5. 1. - Modelos atómicos a lo largo de la historia. https: //www. youtube. com/watch? v=Kh. NHKg 60 p 7 g 6: 36

El concepto de átomo sigue evolucionando…

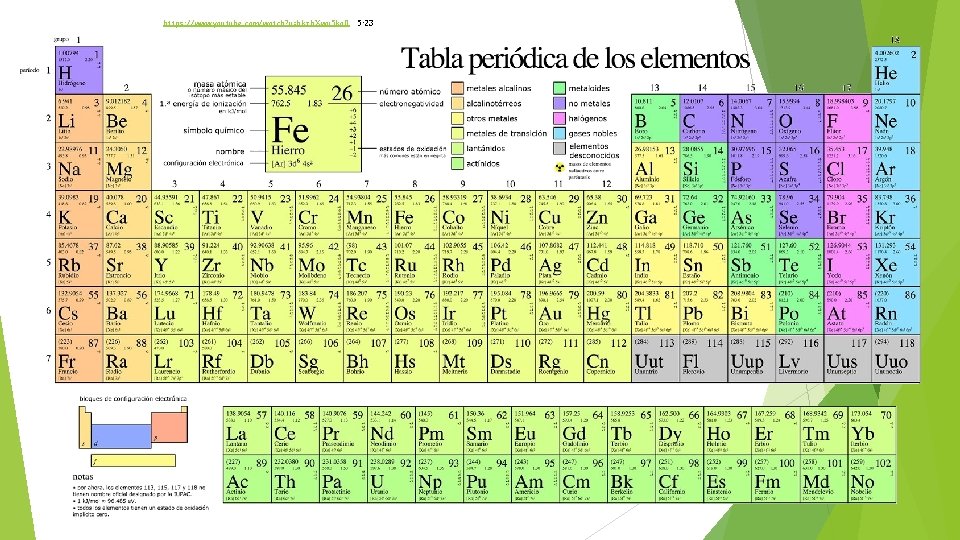
5. 2. - Sistema periódico de los elementos. - Los elementos químicos se representan mediante símbolos designados por la IUPAC (UNIÓN INTERNACIONAL DE QUÍMICA PURA Y APLICADA) (International Union of Pure and Applied Chemistry). - El padre de la tabla periódica es Dimitri Ivanovich Mendeléiev (Tobolsk, actual Rusia, 1834 San Petersburgo, 1907) químico ruso. - Desde el año 2012, la tabla periódica de los elementos cuenta con 118 elementos confirmados, de estos elementos 114 han sido oficialmente reconocidos y nombrados (IUPAC). - El símbolo de un elemento es algo internacional, es el mismo en todos los idiomas, y esto hace que todos los científicos, independientemente de su idioma que hablen, puedan compartir información.

- El nombre de cada elemento proviene: • del latín He (helio: helios), • del griego Cl (cloro: chloros), • del país donde se ha descubierto Po (polonio, en honor a Madamme Curie nacida en Polonia), • del árabe B (boro: bawraq), • del alemán Co (cobalto: Kobold: duende), • del nombre de cuerpos celestes U (uranio), • de la mitología Ta (tántalo hijo de Zeus), • del color que tienen Cs (cesio: caesius: azul celeste), • de nombres de químicos relevantes instenio (Es: Einstein).

- Para nombrar los nuevos elementos con número atómico superior a 100, en 1978, la IUPAC, estableció unas normas sistemáticas para su nomenclatura y simbología: 1. - El nombre del elemento deriva directamente de su número atómico. Que se separará en dígitos nombrando cada dígito con el nombre-raíz, mezcla de griego y latín: 0 = nil; 1 = un; 2 = bi; 3 = tri; 4 = quad; 5 = pent; 6 = hex; 7 = sept; 8 = oct; 9 = enn 2. - Las raíces latinas se unirán entre sí en el mismo orden que se presentan los dígitos en el número y se completarán con la terminación -ium (-io en español). 3. - El símbolo del elemento se formará con las iniciales de las tres raíces, poniendo la primera en mayúscula. Con estas normas los nombres y símbolos de estos elementos químicos son los siguientes: 101 Unnilunio Unu 102 Unnilbio Unb 103 Unniltrio Unt 104 Unnilquadio Unq 105 Unnilpentio Unp 106 Unnilhexio Unh 107 Unnilseptio Uns 108 Unniloctio Uno

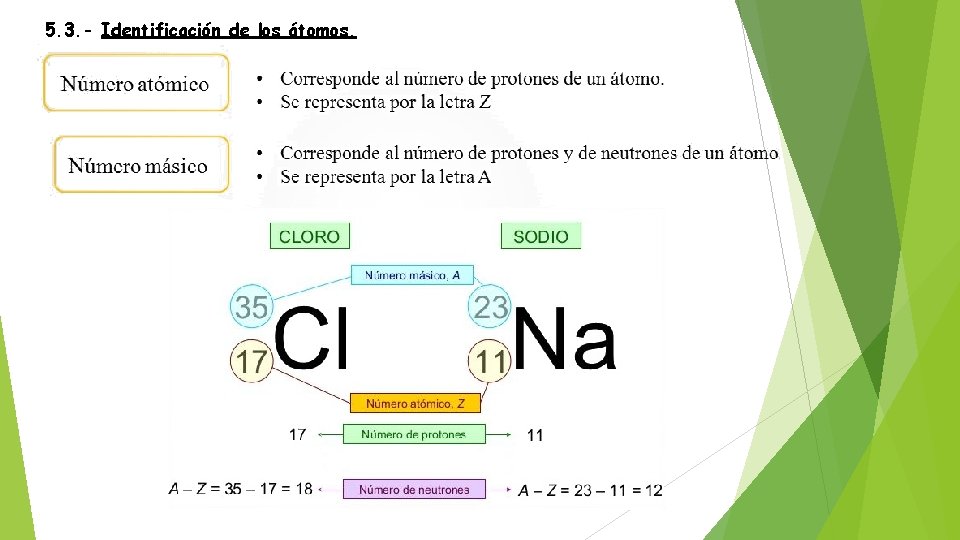
5. 3. - Identificación de los átomos.

https: //www. youtube. com/watch? v=bkzb. Xwu 5 ko 0 5: 23

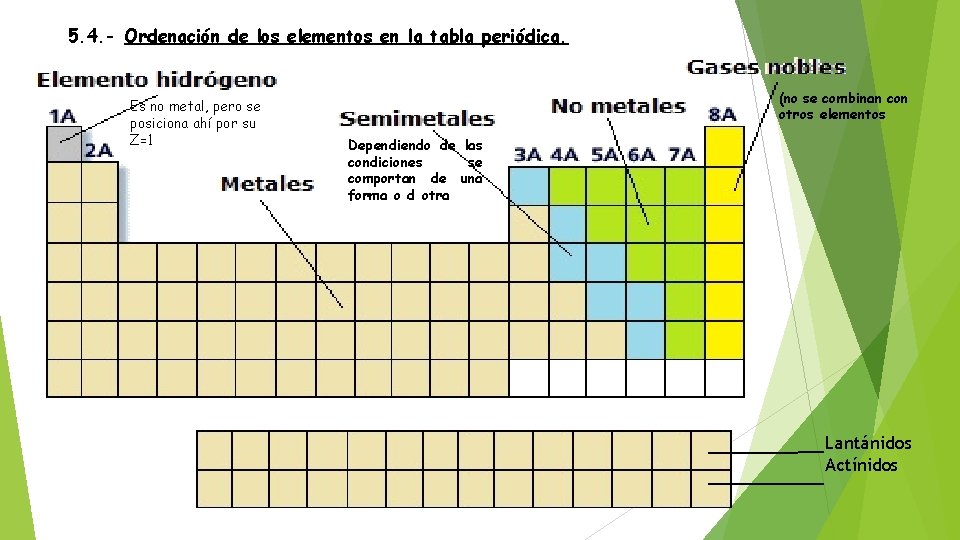
5. 4. - Ordenación de los elementos en la tabla periódica. Es no metal, pero se posiciona ahí por su Z=1 (no se combinan con otros elementos Dependiendo de las condiciones se comportan de una forma o d otra Lantánidos Actínidos
 Robert montal
Robert montal Clasificacin de las empresas
Clasificacin de las empresas Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Clasificacin
Clasificacin Clasificacin de los animales
Clasificacin de los animales Clasificacion de deuda publica
Clasificacion de deuda publica Mark ahumada
Mark ahumada Clasificacin
Clasificacin Propiedad del capital
Propiedad del capital Redes bravais
Redes bravais Estructura de la materia
Estructura de la materia Dibuja los recursos naturales
Dibuja los recursos naturales Vision macroscopica
Vision macroscopica Los seres vivos como sistemas
Los seres vivos como sistemas Complemento di materia
Complemento di materia Dibujos de los cambios de estado de la materia
Dibujos de los cambios de estado de la materia Que estudia la química
Que estudia la química Corn cob structure in plaque
Corn cob structure in plaque