LA DISTROFINA SUS INTERACCIONES CON OTRAS PROTENAS Y












- Slides: 20

LA DISTROFINA, SUS INTERACCIONES CON OTRAS PROTEÍNAS, Y SUS IMPLICACIONES EN LA DISTROFIA MUSCULAR Mohamed, Mariel Schiavo, Florencia Tissot, Mariana

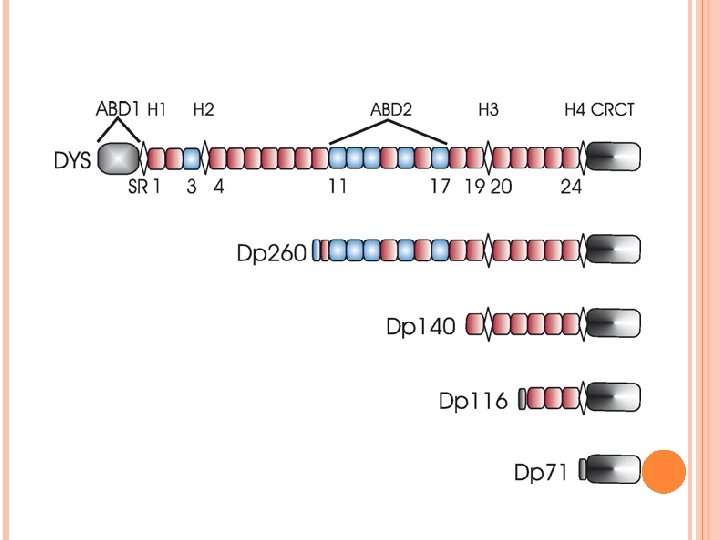
1 - LA DISTROFINA Proteína 427 k. Da producto del gen defectuoso en la Distrofia Muscular de Duchenne (DMD). 4 dominios principales. 3 promotores regulan su expresión completa en músculo y 4 promotores internos que codifican proteínas truncadas en tejidos no musculares.


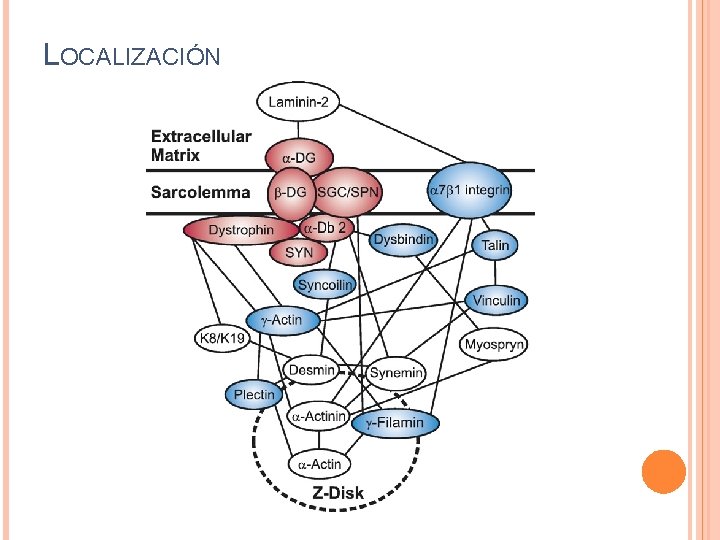
LOCALIZACIÓN

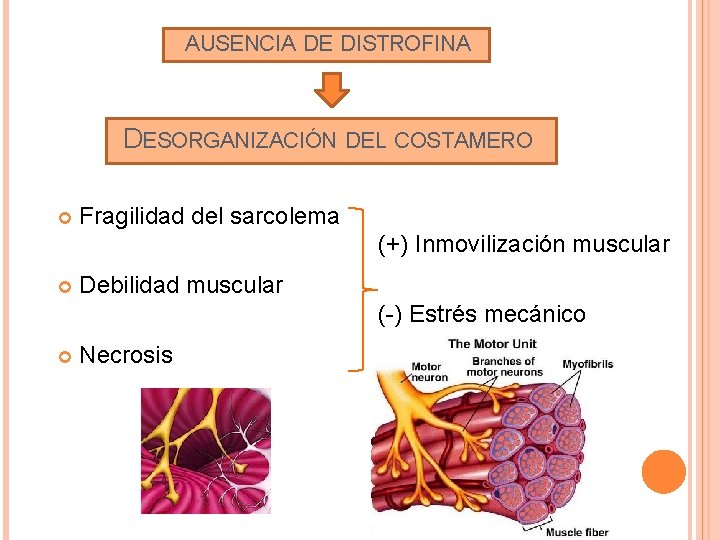
AUSENCIA DE DISTROFINA DESORGANIZACIÓN DEL COSTAMERO Fragilidad del sarcolema (+) Inmovilización muscular Debilidad muscular (-) Estrés mecánico Necrosis

FENOTIPOS Grave: ausencia del dominio rico en cisteína y expresión de DP 71. Leve: ausencia de los dominios amino-terminal (CH tándem) o carboxi-terminal.

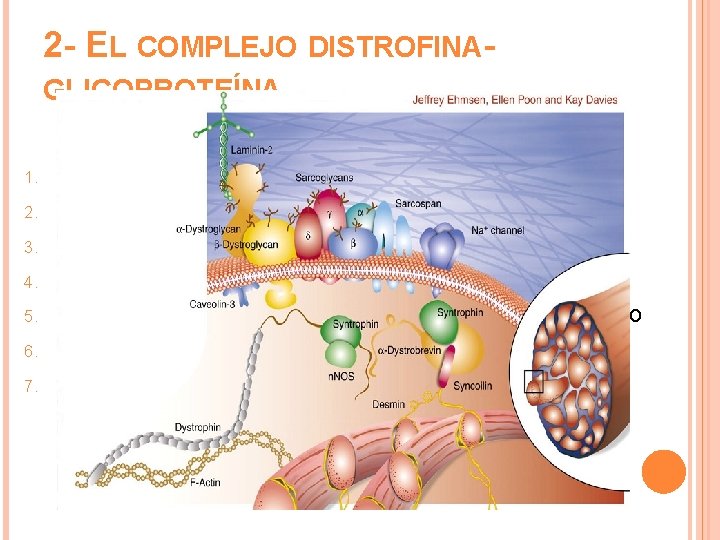
2 - EL COMPLEJO DISTROFINAGLICOPROTEÍNA 1. 2. 3. 4. 5. 6. 7. 156 k. Da α-distrogligano 88 k. Da Distrobrevina Triplete de 59 k. Da Sintrofina 50 k. Da α -Sarcoglicano Doblete de 43 k. Da β-distrogligano y β -sarcoglicano 35 k. Da γ y δ-sarcoglicano 25 k. Da Sarcopan

Distrobrevina y sintrofina: son proteínas citoplasmáticas que se unen entre sí y con el dominio carboxi-terminal de la distrofina. - Sintrofina: moduladora de canales iónicos y molécula de señalización. - α-Distrobrevina: establece un vínculo entre la distrofina y el complejo sarcoglicano. Su ausencia produce miopatía progresiva.

Sarcoglicanos: son proteínas transmembrana que se co-ensamblan formando un tetrámero que fortalece la interacción de β-distroglicano con α-distroglicano y distrofina. Mutaciones Distrofia muscular de cintura y extremidades en humanos. Sarcospan: Mutaciones No miopatías. β-distroglicano: ausencia en ratones produjo DM.

3 - SOCIOS MOLECULARES DEL COMPLEJO DISTROFINAGLICOPROTEÍNA Laminina: primer ligando extracelular para distroglicano. Agrinas, neurexinas y perlecan: contienen módulos homólogos al dominio de laminina de unión a α-distroglicano. Todas se unen a α-distroglicano de manera dependiente de modificaciones de sus oligosacáridos. α-

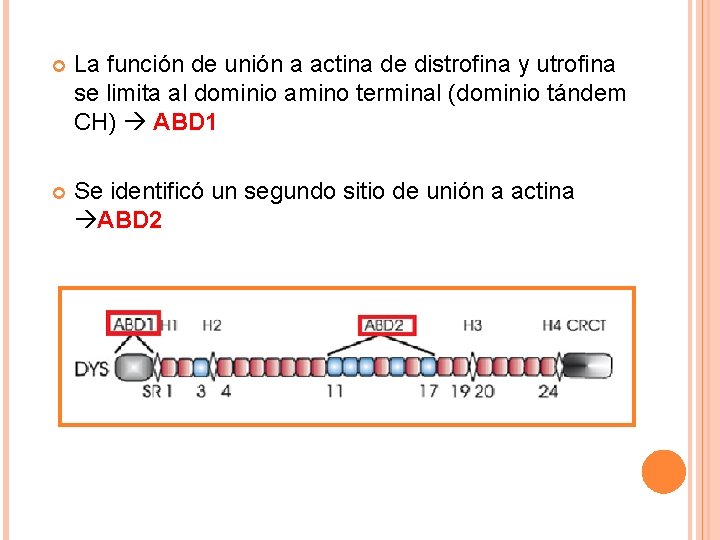
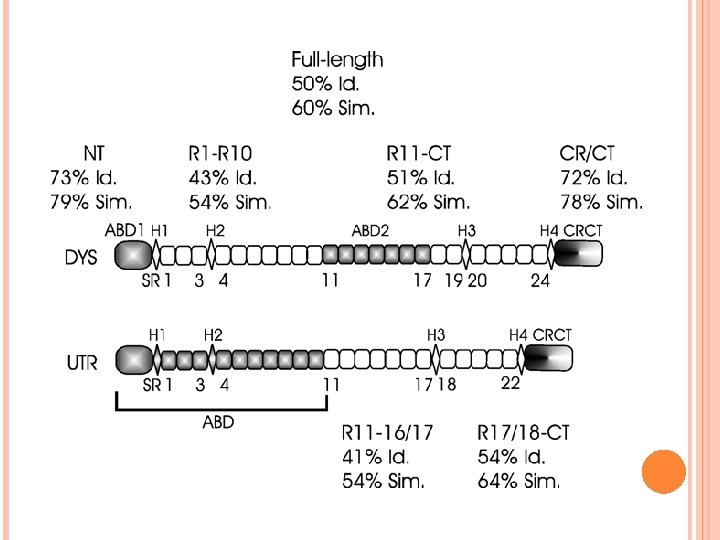
La función de unión a actina de distrofina y utrofina se limita al dominio amino terminal (dominio tándem CH) ABD 1 Se identificó un segundo sitio de unión a actina ABD 2

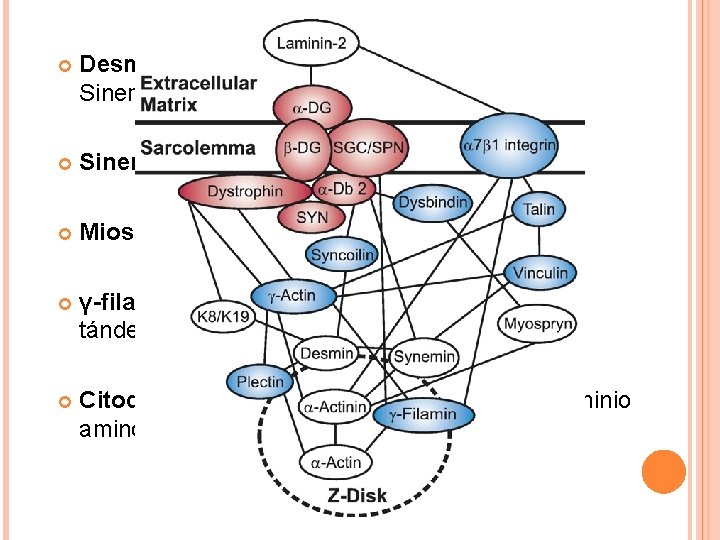
Distrofina esta fuertemente unida al sarcolema y se co-localiza con los filamentos de γ-actina citoplasmática. Su función es anclar los filamentos de γ-actina del citoesqueleto al sarcolema. En su ausencia, utrofina puede compensar dicha función.

Desmina es una proteína intermediaria entre Sinemina y sincoilina. Sinemina se une a α-actinina y vinculina. Miosprina se une directamente a α-actinina. γ-filamina contiene un dominio amino-terminal tándem CH de unión a actina. Citoqueratinas 8 y 19 interaccionan con el dominio amino terminal de distrofina.

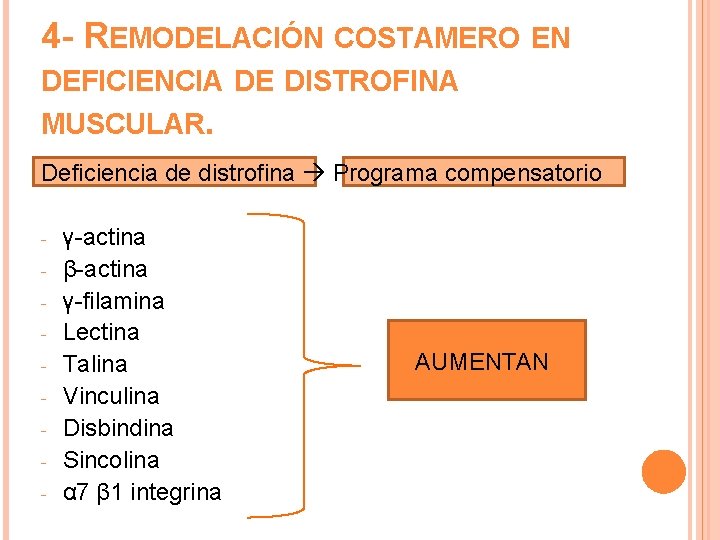
4 - REMODELACIÓN COSTAMERO EN DEFICIENCIA DE DISTROFINA MUSCULAR. Deficiencia de distrofina Programa compensatorio - γ-actina β-actina γ-filamina Lectina Talina Vinculina Disbindina Sincolina α 7 β 1 integrina AUMENTAN

5 - DISTROFINA VERSUS UTROFINA • • Producto de un gen autosómico. Homólogo a distrofina. Distribuida por todo el sarcolema en músculo fetal y regenerativo. En adulto se limita a las uniones miotendinosas y neuromusculares.


DIFERENCIAS Utrofina difiere de la distrofina en su modo de unión a los filamentos de actina y β-distroglicano. Utrofina carece del segundo sitio de unión a actina ABD 2. No compiten por los sitios de unión a filamentos de actina. Las repeticiones 1 -10 tipo espectrina de utrofina son importantes en la unión a los filamentos de actina, pero éstas no son importantes en distrofina.

6 - MISTERIOS SIN RESOLVER - Participación en la señalización celular α-sintrofina. MAP quinasa. Utrofina puede compensar funcionalmente la deficiente de distrofina in vivo. Distintos mecanismos moleculares de unión a actina Distintas funciones in vivo (? ).

Repeticiones tipo espectrina pueden actuar como amortiguadoras en la contracción y relajación muscular. Su unión no competitiva permitiría la unión simultánea de utrofina y distrofina, estabilizando los filamentos costaméricos durante downregulation de utrofina y upregulation de distrofina luego del nacimiento. El gran tamaño y multi-dominio de estas proteínas sugieren la presencia de otras proteínas de interacción que no han sido identificadas.
