La Concentration des solutions La concentration dune solution



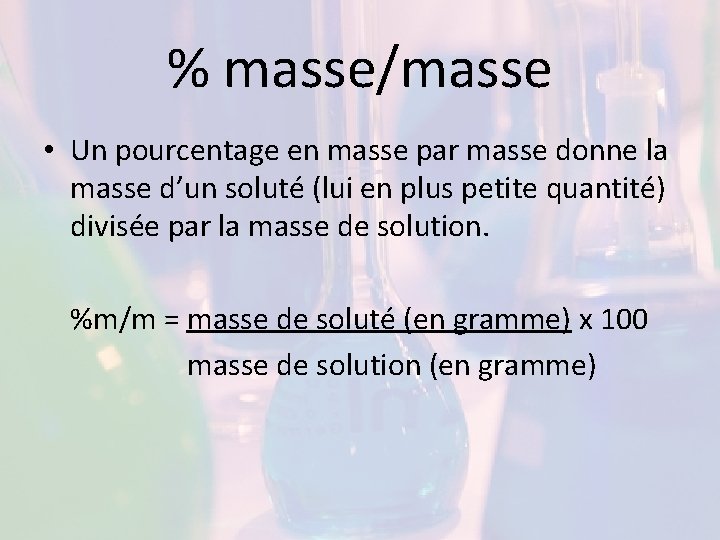

















- Slides: 21

La Concentration des solutions

La concentration d’une solution nous renseigne Sur la quantité de soluté dissoute dans une quantité donnée de solution.

La concentration d’une solution • Calcul du pourcentages massique, volumique et masse/volume % massique = masse de soluté (g) x 100 masse de solution (g) Exprimé en g de soluté par 100 g de solution % volumique = volume de soluté (m. L) x 100 volume de solution (m. L) Exprimé en ml de soluté par 100 m. L de solution % masse/volume = masse soluté (g) x 100 volume de solution (m. L) Exprimé en g de soluté par 100 m. L de solution
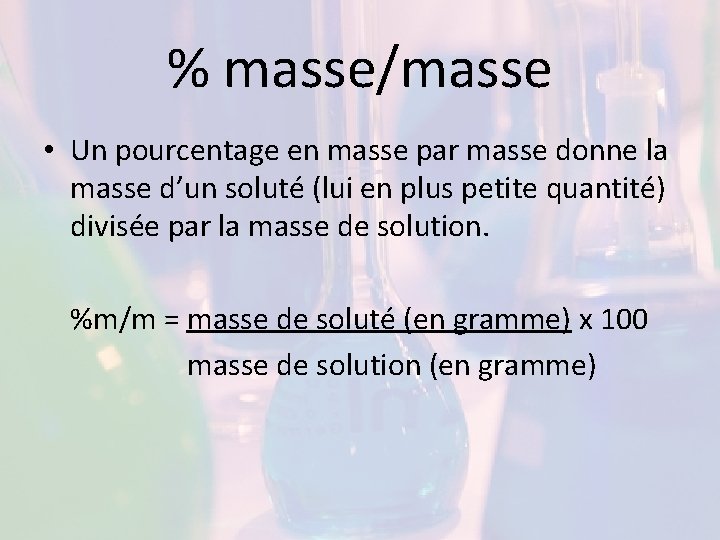
% masse/masse • Un pourcentage en masse par masse donne la masse d’un soluté (lui en plus petite quantité) divisée par la masse de solution. %m/m = masse de soluté (en gramme) x 100 masse de solution (en gramme)

Lorsque l’on trouve un pourcentage massique (m/m) de 73%, cela veut tout simplement dire qu’il y a 73 g de soluté dans 100 g de solution

Exemple % m/m Masse du soluté • Si 55 g d’hydroxyde de potassium sont dissous dans 100 g d’eau, quelle est la concentration de la solution exprimée en pourcentage en masse par masse? %m/m = masse de soluté (en gramme) x 100 masse de solution (en gramme) La solution est la combinaison du soluté et du solvant. Donc, la masse de la solution est 55 g de KOH + 100 g d’H 2 O %m/m = 55 g x 100 = 35. 4%m/m 155 g Donc, cela veut dire qu’il y a 35, 4 g de soluté par 100 g de solution

PRATIQUONS-NOUS • Exemple 1: On dissout 6. 44 g de naphtalène (C 10 H 8) dans 80. 1 g de benzène (C 6 H 6). Calculez le pourcentage massique du naphtalène dans cette solution.

PRATIQUONS-NOUS • Exemple 2: Si le pourcentage massique d’une solution est de 3, 69%, quelle masse d’urée [(NH 2)2 CO] retrouverons-nous dans 210. 78 g d’une solution d’eau et d’uréé?

Voir page 308 # 5, 7, 8, 9

% masse/volume • Un pourcentage en masse par volume donne la masse de soluté dissous dans un volume de solution. %m/V = masse de soluté (en gramme) x 100 volume de solution (en millilitres)

Le sérum qu’on administre aux patients est une solution de 0, 9 % (m/v) de chlorure de sodium. Ceci signifie qu’il y a 0, 9 g de Na. Cl dans 100 ml de solution.

Exemple % m/V Volume de solution en m. L % m/V • À 25 OC, une solution saturée de bioxyde de carbone gazeux dans l’eau a une concentration de 0, 145% (m/V). Quelle masse de bioxyde de carbone est présente dans 250 m. L de solution? Masse de soluté? ? ? %m/V = masse de soluté (en gramme) x 100 volume de solution (en millilitres) 0, 145% = x g x 100, 250 m. L 250 x 0. 145 = x g 100 x g = 0. 36 g

PRATIQUONS-NOUS • Exemple 1: Quelle masse de soluté est présent dans 756. 1 m. L d’une solution a 14, 7% (m/V) de solution d’acide chlorhydrique?

PRATIQUONS-NOUS • Exemple 2: Nous avons 50 m. L d’une solution de Na. Cl contenant 14 g de Na. Cl. Quel est le % m/v?

Voir page 305 # 1, 2, 4

% volume/volume • Un pourcentage en volume par volume donne le volume de soluté divisé par le volume de solution. %V/V = volume de soluté (en millilitres) x 100 volume de solution (en millilitres)

Une solution de vinaigre 5 % (v / v), ceci signifie qu’il y a 5 ml soluté(acide acétique) dans 100 ml de solution (vinaigre).

Volume de soluté Exemple % V/V Volume de solution • On dilue 60 m. L d’éthanol avec de l’eau jusqu’à un volume final de 400 m. L. Quel est le pourcentage en volume de l’éthanol dans la solution? %V/V = volume de soluté (en millilitres) x 100 volume de solution (en millilitres) %V/V = 60 m. L x 100 = 15%V/V 400 m. L

PRATIQUONS-NOUS • Exemple 1: On mélange 30 ml d’alcool et 100 ml d’eau. Quel est le % v/v ? La solution est la combinaison du soluté et du solvant. Donc, la masse de la solution est 30 m. L d’alcool + 100 ml d’H 2 O

PRATIQUONS-NOUS • Exemple 2: Pour faire du bouillon de poulet concentré à 0, 8% (V/V). Combien dois-tu utiliser de cuillérées à thé (5 ml par cuillérées à thé) de concentré pour faire 250 ml de bouillon.

Voir page 310 # 11 à 14