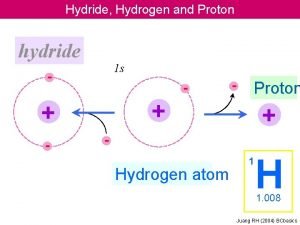
kwas 1 zasada 1 proton zasada 2 proton













- Slides: 23


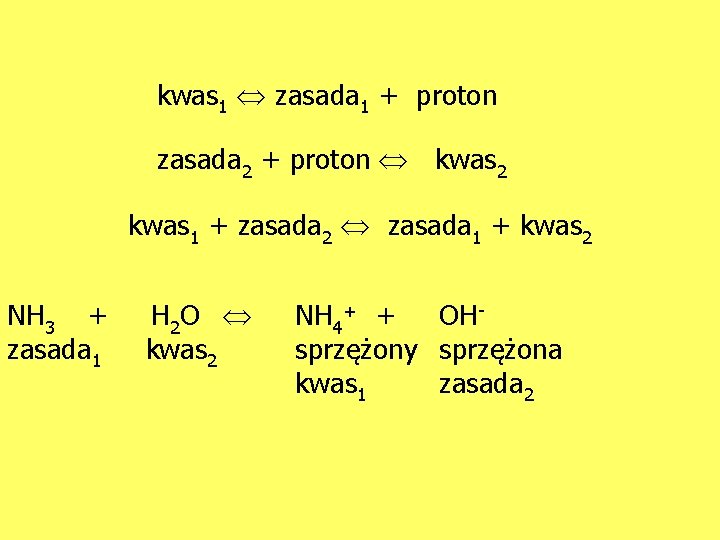
kwas 1 zasada 1 + proton zasada 2 + proton kwas 2 kwas 1 + zasada 2 zasada 1 + kwas 2 NH 3 + zasada 1 H 2 O kwas 2 NH 4+ + OHsprzężony sprzężona kwas 1 zasada 2

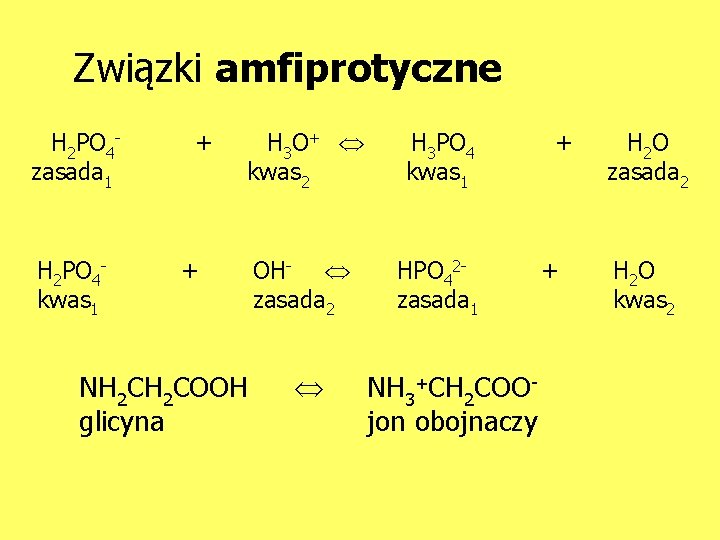
Związki amfiprotyczne H 2 PO 4 zasada 1 H 2 PO 4 kwas 1 + H 3 O + kwas 2 H 3 PO 4 kwas 1 OH- zasada 2 HPO 42 zasada 1 + NH 2 COOH glicyna NH 3+CH 2 COOjon obojnaczy + + H 2 O zasada 2 H 2 O kwas 2

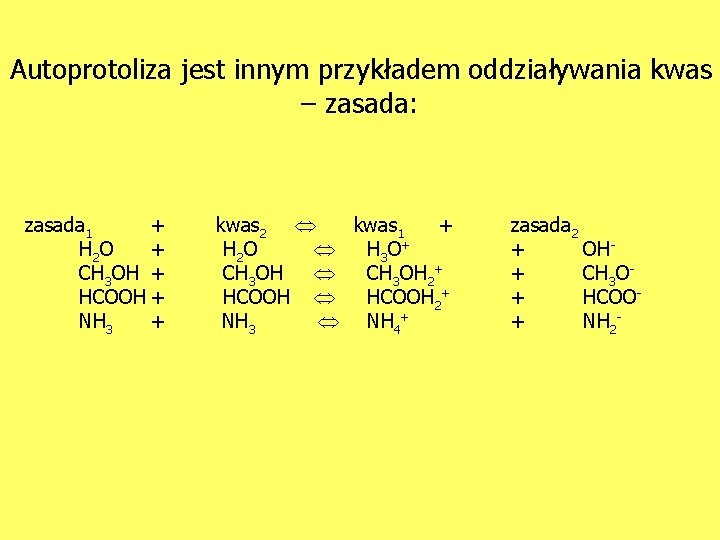
Autoprotoliza jest innym przykładem oddziaływania kwas – zasada: zasada 1 + H 2 O + CH 3 OH + HCOOH + NH 3 + kwas 2 kwas 1 + H 2 O H 3 O + CH 3 OH 2+ HCOOH 2+ NH 3 NH 4+ zasada 2 + OH+ CH 3 O+ HCOO+ NH 2 -

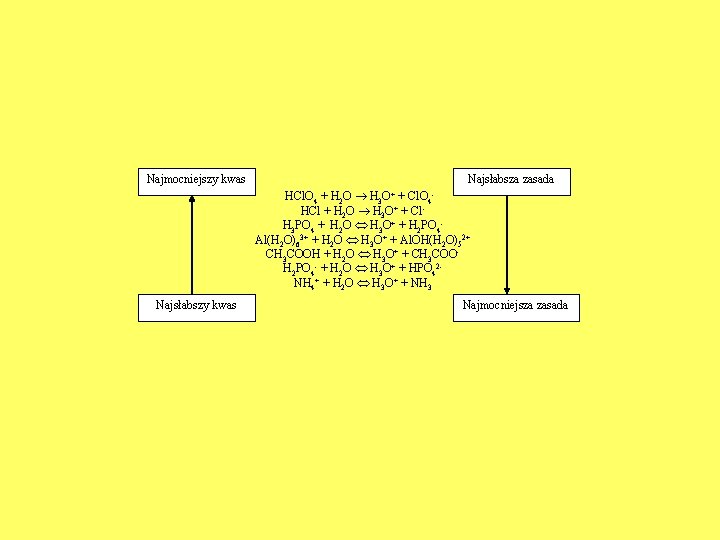
Najmocniejszy kwas Najsłabsza zasada HCl. O 4 + H 2 O H 3 O+ + Cl. O 4 HCl + H 2 O H 3 O+ + Cl H 3 PO 4 + H 2 O H 3 O+ + H 2 PO 4 Al(H 2 O)63+ + H 2 O H 3 O+ + Al. OH(H 2 O)52+ CH 3 COOH + H 2 O H 3 O+ + CH 3 COO H 2 PO 4 + H 2 O H 3 O+ + HPO 42 NH 4+ + H 2 O H 3 O+ + NH 3 Najmocniejsza zasada

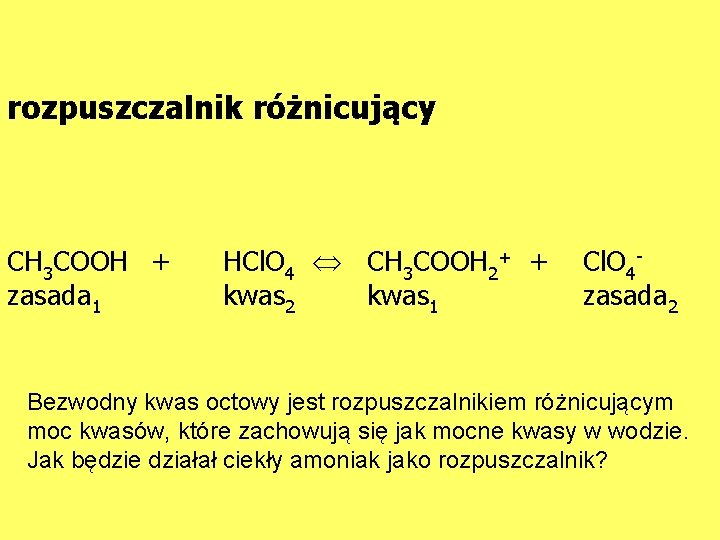
rozpuszczalnik różnicujący CH 3 COOH + zasada 1 HCl. O 4 CH 3 COOH 2+ + kwas 2 kwas 1 Cl. O 4 zasada 2 Bezwodny kwas octowy jest rozpuszczalnikiem różnicującym moc kwasów, które zachowują się jak mocne kwasy w wodzie. Jak będzie działał ciekły amoniak jako rozpuszczalnik?

Stopień dysocjacji Prawo rozcieńczeń Ostwalda Mocne elektrolity =1 %=100% Stopień dysocjacji =nzdys/ncałk=czdys/ccałk Słabe elektrolity <1 %<100% Im większe stężenie c. HA tym mniejszy stopień dysocjacji

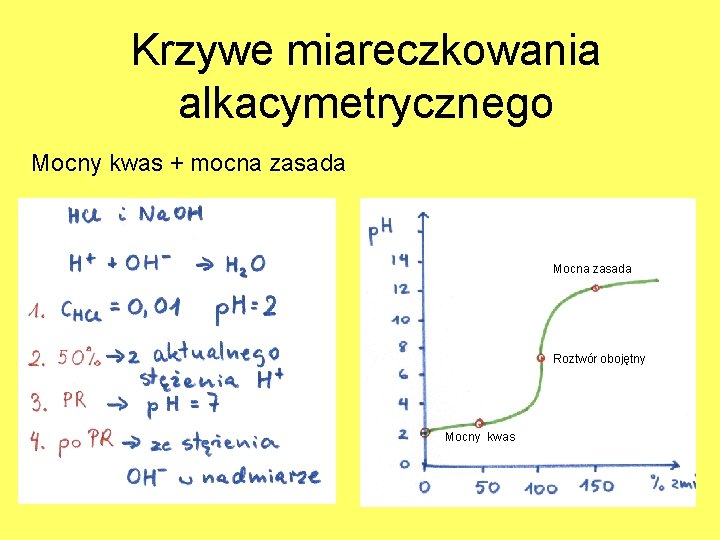
Krzywe miareczkowania alkacymetrycznego Mocny kwas + mocna zasada Mocna zasada Roztwór obojętny Mocny kwas

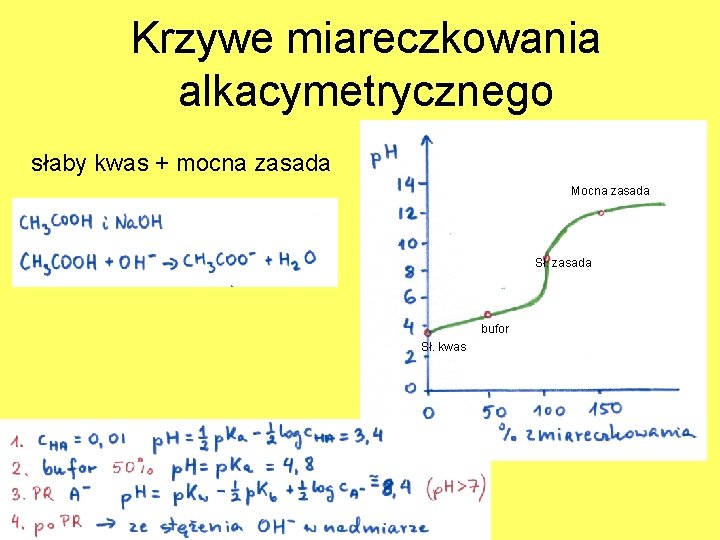
Krzywe miareczkowania alkacymetrycznego słaby kwas + mocna zasada Mocna zasada Sł. zasada bufor Sł. kwas

Krzywe miareczkowania alkacymetrycznego słaba zasada + mocny kwas Sł. zasada bufor amfiprotyczna bufor Sł. kwas Mocny kwas

Miareczkowanie sody kwasem solnym Mol/l (g, mol, litr)

Wskaźniki alkacymetryczne Słabe kwasy i zasady o różnym zabarwieniu formy kwasowej i zasadowej żółty czerwony

Wskaźniki alkacymetryczne Jednobarwne (fenoloftaleina)

fenoloftaleina

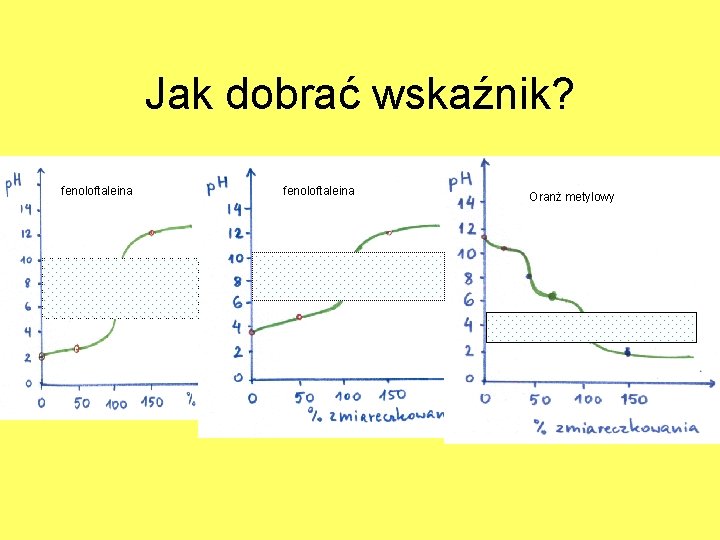
Jak dobrać wskaźnik? fenoloftaleina Oranż metylowy

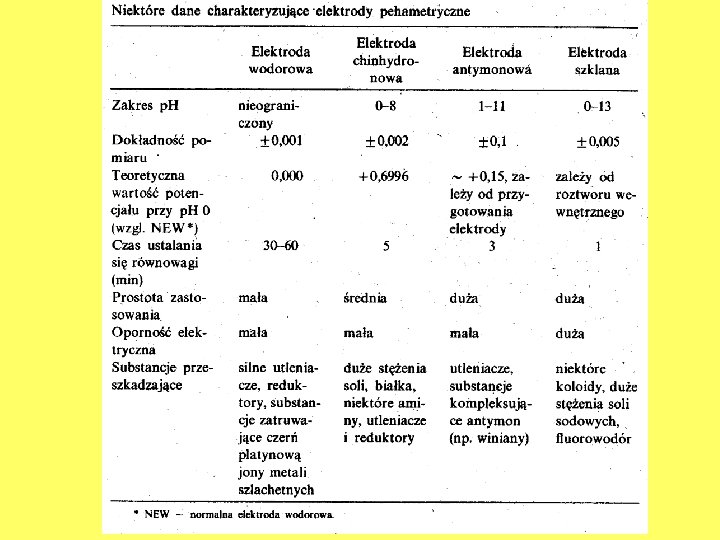
Charakterystyka wskaźników

hortensja p. H gleby 4 – 4, 5 p. H gleby 5, 5 - 6

Ten sam barwnik jest odpowiedzialny za barwę maków i chabrów Maki Chabry p. H soków w makach < p. H soków w chabrach

Automatyczny titrator


Wyrażenia opisujące stałą równowagi w W + x X y. Y + z Z K= [Y]y [Z]z [W]w [X]x Wyrażenia algebraiczne przedstawiające zależności istniejące pomiędzy stężeniami (stałe stężeniowe) (lub aktywnościami – stałe termodynamiczne) substratów i produktów. [Y] – stężenie molowe, jeśli reagent jest gazem – ciśnienie cząstkowe zamiast stężenia np. py, jeśli Y jest czystą cieczą, rozpuszczalnikiem w dużym nadmiarze, jego symbol nie pojawia się w wyrażeniu opisującym stałą równowagi. Wartość stałej zależy od temperatury, ciśnienia, siły (mocy) jonowej roztworu dla stałej stężeniowej. Położenie stanu równowagi chemicznej jest niezależne od drogi, na której ten stan został osiągnięty.

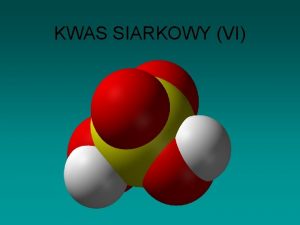
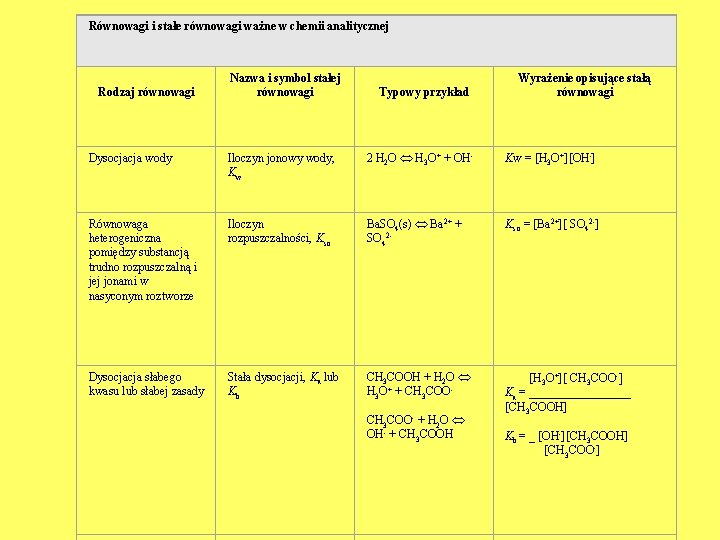
Równowagi i stałe równowagi ważne w chemii analitycznej Rodzaj równowagi Nazwa i symbol stałej równowagi Typowy przykład Wyrażenie opisujące stałą równowagi Dysocjacja wody Iloczyn jonowy wody, Kw 2 H 2 O H 3 O+ + OH Kw = [H 3 O+][OH ] Równowaga heterogeniczna pomiędzy substancją trudno rozpuszczalną i jej jonami w nasyconym roztworze Iloczyn rozpuszczalności, Kso Ba. SO 4(s) Ba 2+ + SO 42 Kso = [Ba 2+][ SO 42 ] Dysocjacja słabego kwasu lub słabej zasady Stała dysocjacji, Ka lub Kb CH 3 COOH + H 2 O H 3 O+ + CH 3 COO + H 2 O OH + CH 3 COOH [H 3 O+][ CH 3 COO ] Ka = _________ [CH 3 COOH] Kb = _ [OH ][CH 3 COOH] [CH 3 COO ]

Tworzenie kompleksu Stała kompleksowania, n Ni 2+ + 4 CN Ni(CN)42 4 = [Ni(CN)42 ] [Ni 2+][CN ]4 Równowaga reakcji utlenienia/redukcji Kredox Mn. O 4 + 5 Fe 2+ + 8 H+ Mn 2+ + 5 Fe 3+ + 4 H 2 O Kredox = [Mn 2+][Fe 3+]5 [Mn. O 4 ][Fe 2+]5[H+]8 Równowaga podziału substancji rozpuszczonej pomiędzy nie mieszające się rozpuszczalniki KD I 2(aq) I 2(org) [I 2]org KD = [I 2]aq
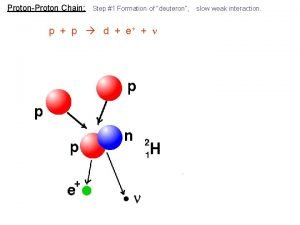
 Proton proton chain
Proton proton chain Proton proton chain
Proton proton chain Fission reaction
Fission reaction Alkohole metan etan
Alkohole metan etan Insulina lipogeneza
Insulina lipogeneza Chiralność osiowa
Chiralność osiowa Lipidy proste i złożone
Lipidy proste i złożone Kwas fosfatydowy wzór
Kwas fosfatydowy wzór Szałwia wieszcza legalność
Szałwia wieszcza legalność Punkty izoelektryczne aminokwasów
Punkty izoelektryczne aminokwasów Sfingolipidy
Sfingolipidy Alkohol benzylowy
Alkohol benzylowy Zmydlanie tluszczow
Zmydlanie tluszczow Kwas heptanodiowy
Kwas heptanodiowy Kwas inozynowy
Kwas inozynowy Typy reakcji organicznych
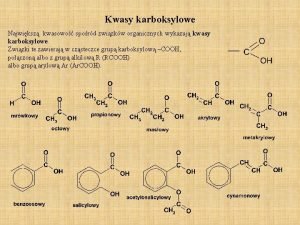
Typy reakcji organicznych Kwas karboksylowy nienasycony
Kwas karboksylowy nienasycony Kwas węglowy jest nietrwały ponieważ
Kwas węglowy jest nietrwały ponieważ Wzor na prace
Wzor na prace Zasada zachowania ładunku
Zasada zachowania ładunku Zasada legitymizmu i restauracji
Zasada legitymizmu i restauracji Struktura sztabowo liniowa
Struktura sztabowo liniowa Didaktické zásady
Didaktické zásady Cykl braytona
Cykl braytona