KW Alkene Nomenklatur Darstellung Reaktionen Elektrophile Additionen Prof











- Slides: 27

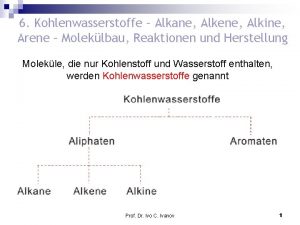
KW – Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1

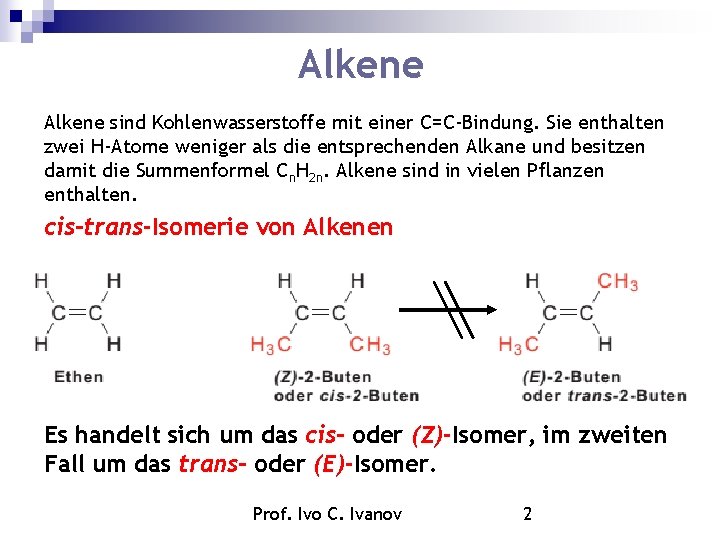
Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei H-Atome weniger als die entsprechenden Alkane und besitzen damit die Summenformel Cn. H 2 n. Alkene sind in vielen Pflanzen enthalten. cis-trans-Isomerie von Alkenen Es handelt sich um das cis- oder (Z)-Isomer, im zweiten Fall um das trans- oder (E)-Isomer. Prof. Ivo C. Ivanov 2

Damit eine E/Z-Isomerisierung eintreten kann, muss die π-Bindung gelöst werden. Dazu sind 260 k. J erforderlich. Nomenklatur von Alkenen Man ersetzt die Endung -an im Namen des entsprechenden gesättigten. Kohlenwasserstoffsdurch die Endung -en und gibt die Lage der Doppelbindung durch eine vorangestellte Zahl an. Prof. Ivo C. Ivanov 3

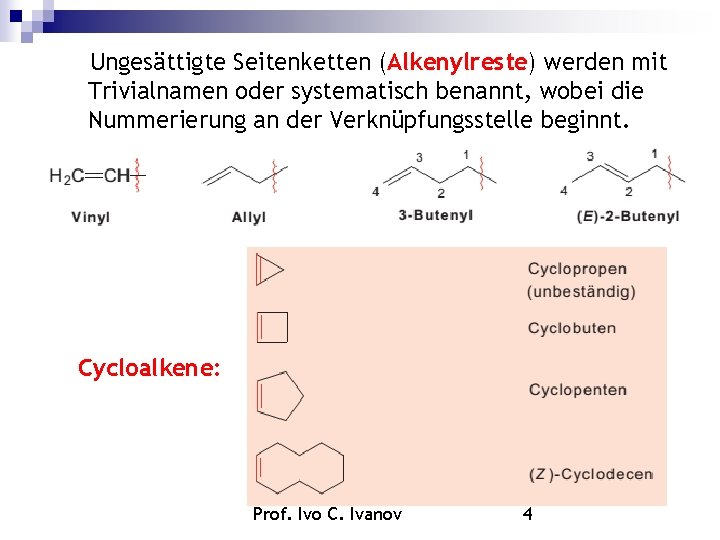
Ungesättigte Seitenketten (Alkenylreste) werden mit Trivialnamen oder systematisch benannt, wobei die Nummerierung an der Verknüpfungsstelle beginnt. Cycloalkene: Prof. Ivo C. Ivanov 4

Darstellung von Alkenen 1. Aus Alkanen durch Dehydrierung oder aus Alkinen durch Hydrierung: 1. 1, 2 -Eliminierung von H−X (X z. B. Halogen) mit Hilfe von Basen: Prof. Ivo C. Ivanov 5

3. Aus Alkoholen durch Wasserabspaltung mit Säuren: 4. Aus Alkanen durch Pyrolyse (steam-cracking): Unter Pyrolyse versteht man die Zersetzung einer Verbindung durch Erhitzen (griech. pyr, Feuer; lysis, Trennung). Prof. Ivo C. Ivanov 6

–Eliminierung (1, 2 -Eliminierung) Bildung von Alkenen durch Abspaltung kleiner Moleküle aus substituierten Alkanen Base : B- + H-X Die Substrate für Eliminierungen sind die gleichen wie die Substrate für nucleophile Substitutionen Eliminierung (E) und Substitution (S) sind Konkurrenzreaktionen Prof. Ivo C. Ivanov 7

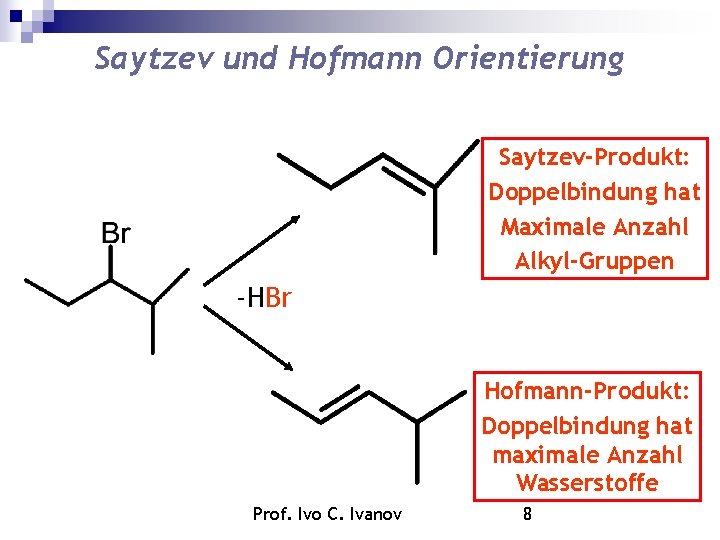
Saytzev und Hofmann Orientierung Saytzev-Produkt: Doppelbindung hat Maximale Anzahl Alkyl-Gruppen -HBr Hofmann-Produkt: Doppelbindung hat maximale Anzahl Wasserstoffe Prof. Ivo C. Ivanov 8

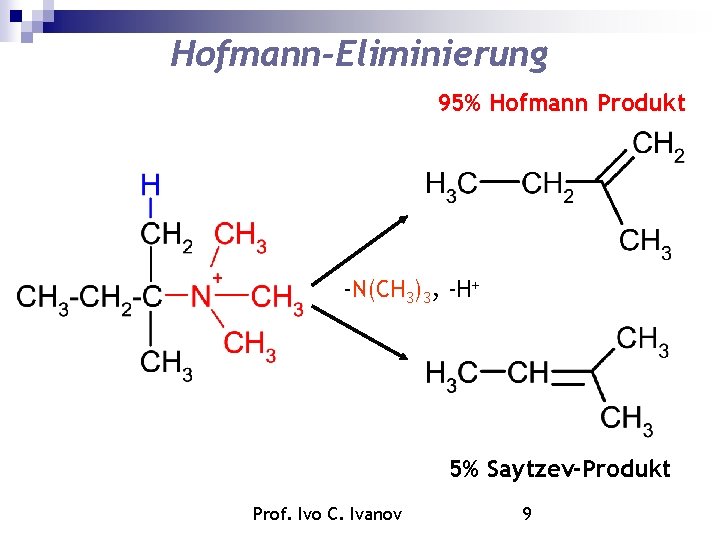
Hofmann-Eliminierung 95% Hofmann Produkt -N(CH 3)3, -H+ 5% Saytzev-Produkt Prof. Ivo C. Ivanov 9

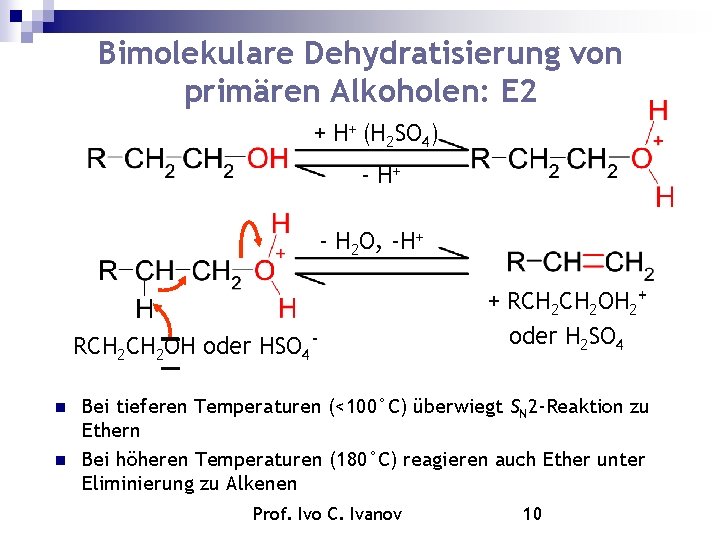
Bimolekulare Dehydratisierung von primären Alkoholen: E 2 + H+ (H 2 SO 4) - H+ - H 2 O, -H+ RCH 2 OH oder HSO 4 + RCH 2 OH 2+ oder H 2 SO 4 Bei tieferen Temperaturen (<100°C) überwiegt SN 2 -Reaktion zu Ethern Bei höheren Temperaturen (180°C) reagieren auch Ether unter Eliminierung zu Alkenen Prof. Ivo C. Ivanov 10

Elektrophile Addition an die C-C-Doppelbindung Alkene H-X Halogenalkane H-OH Alkohole X-X Dihalogenalkane Exotherme Reaktionen Prof. Ivo C. Ivanov 11

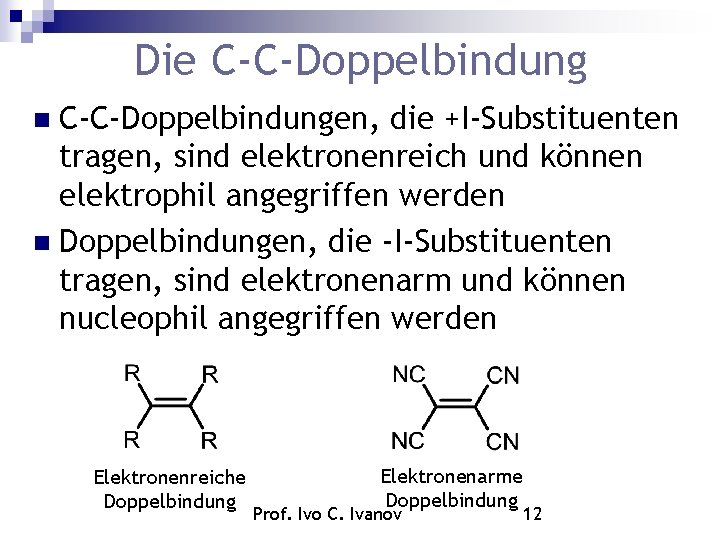
Die C-C-Doppelbindungen, die +I-Substituenten tragen, sind elektronenreich und können elektrophil angegriffen werden Doppelbindungen, die -I-Substituenten tragen, sind elektronenarm und können nucleophil angegriffen werden Elektronenreiche Doppelbindung Elektronenarme Doppelbindung Prof. Ivo C. Ivanov 12

Regioselektiver Angriff an der Doppelbindung + Br- H+ sekundäres Carbenium-Ion + Br- primäres Carbenium-Ion Der elektrophile Angriff eines Protons führt zum stabileren Carbenium-Ion Es werden deshalb keine primären Alkylderivate erhalten Prof. Ivo C. Ivanov 13

Regel von Markovnikov (1870) Wird HX an ein Alken addiert, lagert sich das Wasserstoffatom an die Stelle der Doppelbindung an, die bereits die meisten Wasserstoffatome hat Es bildet sich bevorzugt der Übergangszustand, der zum stabileren Carbenium-Ion führt CH 2=CHCH 3 höhere Anzahl H H-Br Prof. Ivo C. Ivanov CH 3 CHBr. CH 3 Markovnikov. Additionsprodukt 14

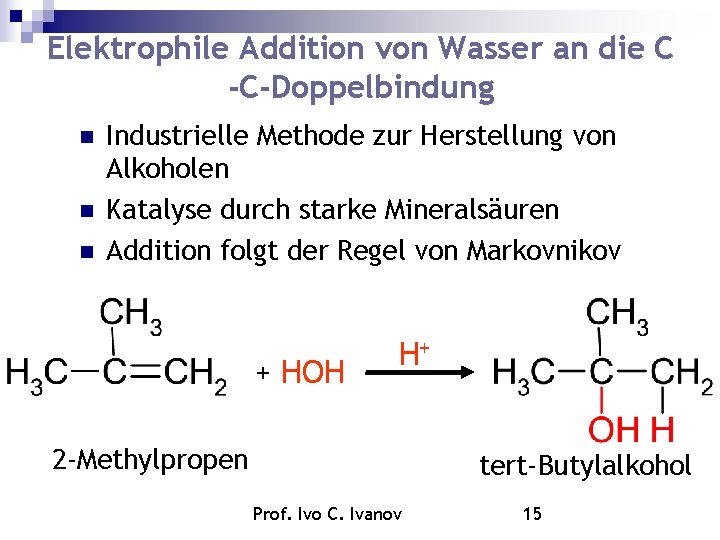
Elektrophile Addition von Wasser an die C -C-Doppelbindung Industrielle Methode zur Herstellung von Alkoholen Katalyse durch starke Mineralsäuren Addition folgt der Regel von Markovnikov + HOH H+ 2 -Methylpropen tert-Butylalkohol Prof. Ivo C. Ivanov 15

Mechanismus der AE von Wasser an Alkene Schritt 1: Addition eines Protons langsam +H 2 O Geschwindigkeitsbestimmender Schritt: Bildung des stabilsten Carbenium-Ions Prof. Ivo C. Ivanov 16

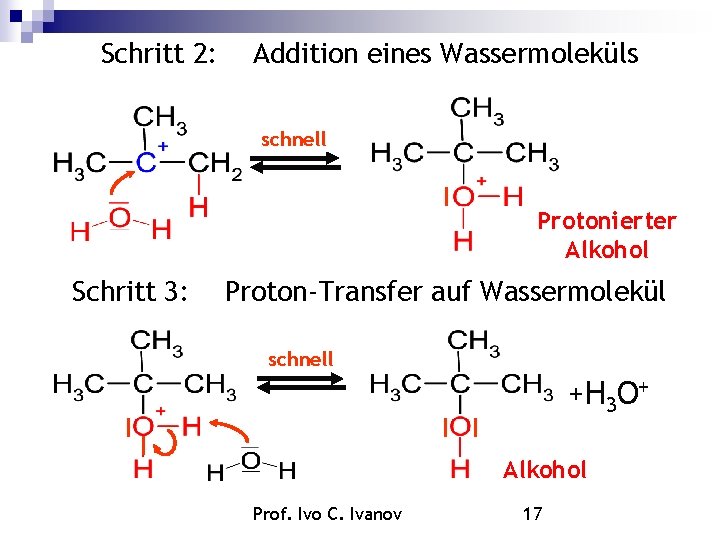
Schritt 2: Addition eines Wassermoleküls schnell Protonierter Alkohol Schritt 3: Proton-Transfer auf Wassermolekül schnell +H 3 O+ Alkohol Prof. Ivo C. Ivanov 17

Elektrophile Addition von Halogenen an die Doppelbindung Halogene reagieren mit Alkenen und Alkinen bereits bei Raumtemperatur – auch im Dunkeln! Entfärbung von Brom dient als Nachweis der Mehrfachbindung + Br 2 Raumtemperatur im Dunkeln, CCl 4 Dibromid Prof. Ivo C. Ivanov 18

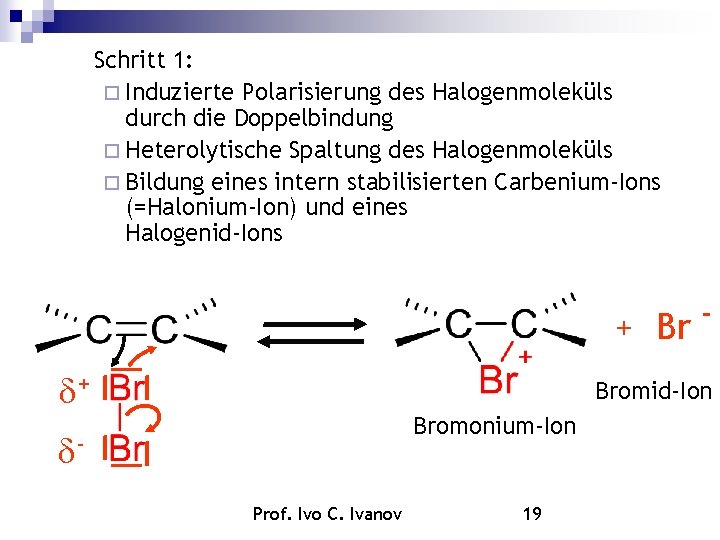
Schritt 1: Induzierte Polarisierung des Halogenmoleküls durch die Doppelbindung Heterolytische Spaltung des Halogenmoleküls Bildung eines intern stabilisierten Carbenium-Ions (=Halonium-Ion) und eines Halogenid-Ions + Bromid-Ion Bromonium-Ion Prof. Ivo C. Ivanov 19

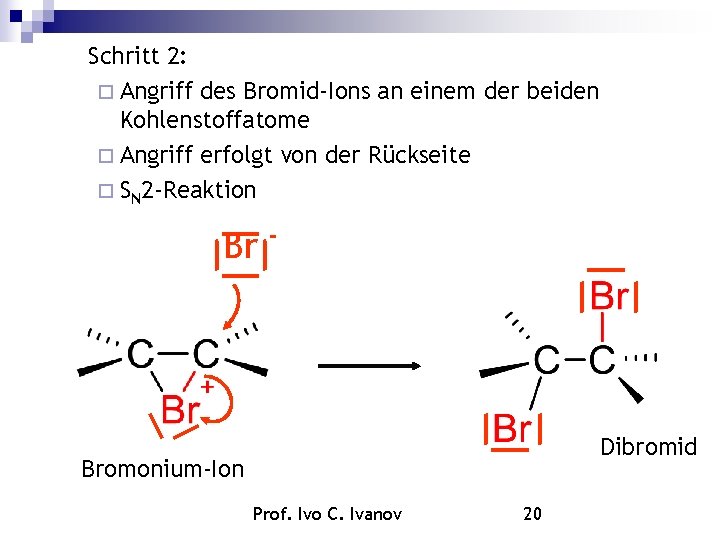
Schritt 2: Angriff des Bromid-Ions an einem der beiden Kohlenstoffatome Angriff erfolgt von der Rückseite SN 2 -Reaktion Br - Dibromid Bromonium-Ion Prof. Ivo C. Ivanov 20

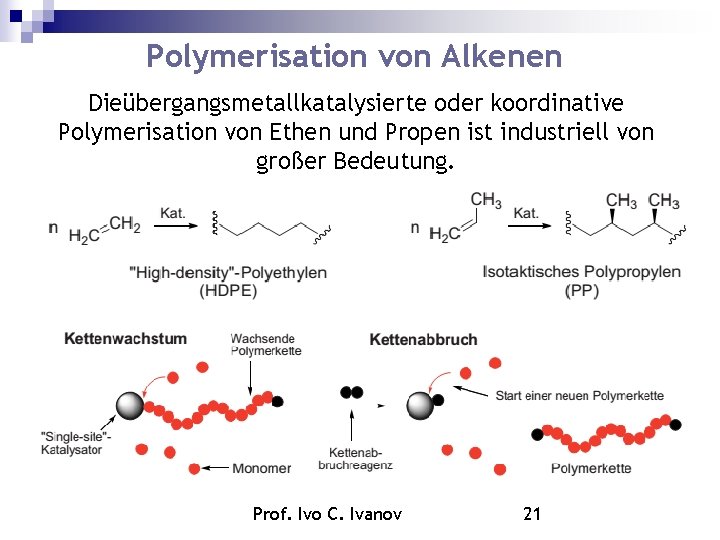
Polymerisation von Alkenen Dieübergangsmetallkatalysierte oder koordinative Polymerisation von Ethen und Propen ist industriell von großer Bedeutung. Prof. Ivo C. Ivanov 21

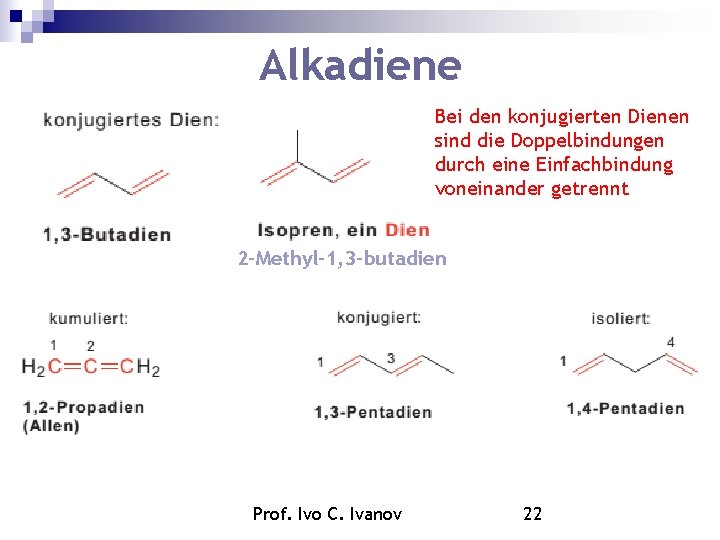
Alkadiene Bei den konjugierten Dienen sind die Doppelbindungen durch eine Einfachbindung voneinander getrennt 2 -Methyl-1, 3 -butadien Prof. Ivo C. Ivanov 22

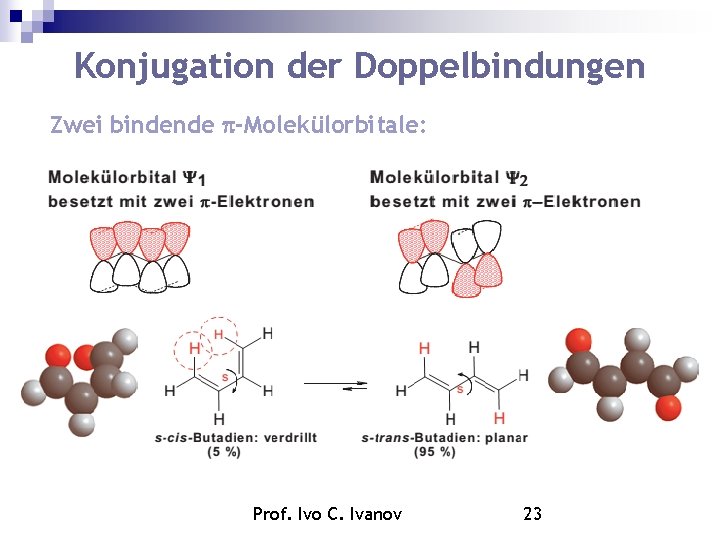
Konjugation der Doppelbindungen Zwei bindende -Molekülorbitale: Prof. Ivo C. Ivanov 23

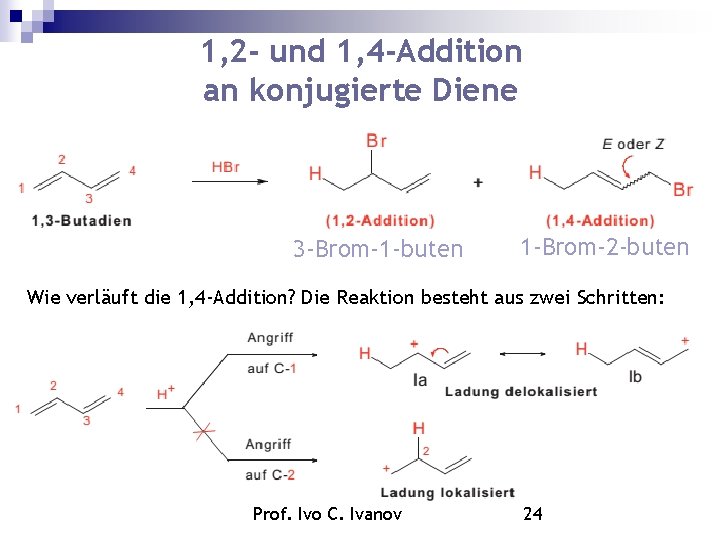
1, 2 - und 1, 4 -Addition an konjugierte Diene 3 -Brom-1 -buten 1 -Brom-2 -buten Wie verläuft die 1, 4 -Addition? Die Reaktion besteht aus zwei Schritten: Prof. Ivo C. Ivanov 24

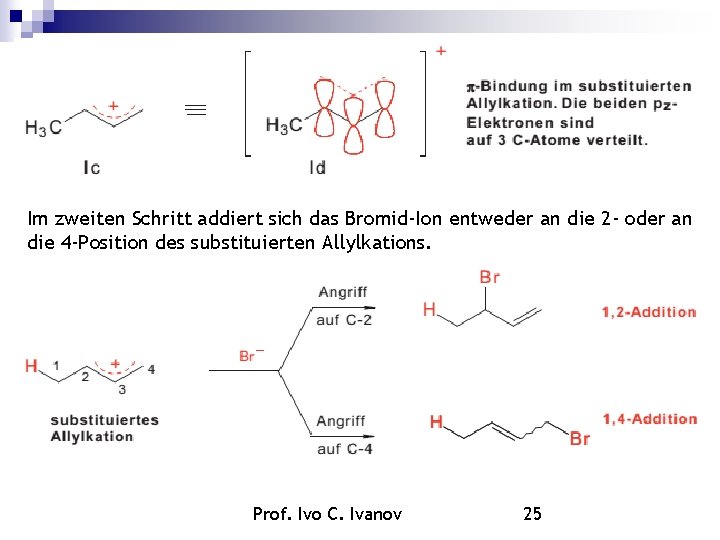
Im zweiten Schritt addiert sich das Bromid-Ion entweder an die 2 - oder an die 4 -Position des substituierten Allylkations. Prof. Ivo C. Ivanov 25

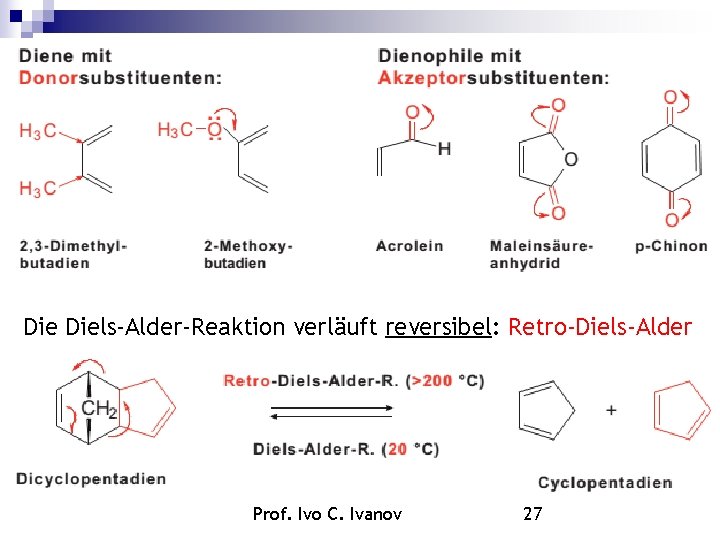
Diels-Alder-Reaktion Die reversible Vereinigung eines 1, 3 -Diens mit einem Alken oder einem Alkin zu einem ungesättigten Sechsring. Nobelpreis: 1950. Beispiele: Dienophil Prof. Ivo C. Ivanov Addukt 26

Die Diels-Alder-Reaktion verläuft reversibel: Retro-Diels-Alder Prof. Ivo C. Ivanov 27
 Hydrogen halide example
Hydrogen halide example Symmetrical alkene and unsymmetrical alkene
Symmetrical alkene and unsymmetrical alkene Regulation von enzymen
Regulation von enzymen Benzolsulfonsäure mechanismus
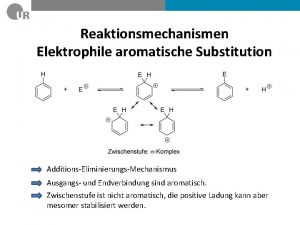
Benzolsulfonsäure mechanismus Elektrophile aromatische substitution mechanismus
Elektrophile aromatische substitution mechanismus Elektrophile addition von wasser
Elektrophile addition von wasser Nomenklatur halogenalkane
Nomenklatur halogenalkane E z nomenklatur
E z nomenklatur Nomenklatur roda gigi
Nomenklatur roda gigi Permendagri tentang klasifikasi kodefikasi dan nomenklatur
Permendagri tentang klasifikasi kodefikasi dan nomenklatur Butansäureethylester strukturformel
Butansäureethylester strukturformel Elementare regelungstechnik
Elementare regelungstechnik Nomenklatur adalah
Nomenklatur adalah Keton nomenklatur
Keton nomenklatur Iupac nomenklatur
Iupac nomenklatur Black box darstellung getriebe
Black box darstellung getriebe Vertriebsprozess darstellung
Vertriebsprozess darstellung Kalendrierung
Kalendrierung Rekursive darstellung logistisches wachstum
Rekursive darstellung logistisches wachstum Matrixorganisation linienorganisation
Matrixorganisation linienorganisation Eis prinzip nach bruner
Eis prinzip nach bruner Stetige merkmale
Stetige merkmale Außenlooping
Außenlooping Zentrierbohrung bemaßung
Zentrierbohrung bemaßung Koeffizientenvergleich potenzreihe
Koeffizientenvergleich potenzreihe Cyclic alkene
Cyclic alkene Alkenes reactions and synthesis
Alkenes reactions and synthesis Cahn ingold prelog rules
Cahn ingold prelog rules