KVANTNI BROJEVI ELEKTRONSKE KONFUGURACIJE I PERIODINOST Kako su

KVANTNI BROJEVI ELEKTRONSKE KONFUGURACIJE I PERIODIČNOST

Kako su elektroni raspoređeni u atomima? A) Šta je elektronska konfiguracija

B) TRI PRAVILA ODREĐUJU RASPORED ELEKTRONA U ATOMIMA 1) Paulijev princip isključivosti – ne mogu postojati dva elektrona u jednom atomu sa sva četiri ista kvantna broja. 2) Princip popunjavanja: prvo se popunjavaju atomske orbite najniže, tj. niže energije. 3) Hund‘ovo pravilo – najstabilniji aranžman elektrona u podljsci je onaj sa najvećim brojem uparenih spinova

Najniža energija je određena sa n+l pravilom, to znači da suma ova dva kvantna broja određuje najnižu energiju, što je manja ova suma, manja je energija. Ukoliko su neke dvije sume iste, onda niža vrijednost n određuje nižu energiju. n+l 1+0=1 1 s 2+0=2 2 s 2+1=3 2 p 3+0=3 3 s 3+1=4 3+2=5 4+0=4 4+1=5 3 p 3 d 4 s 4 p
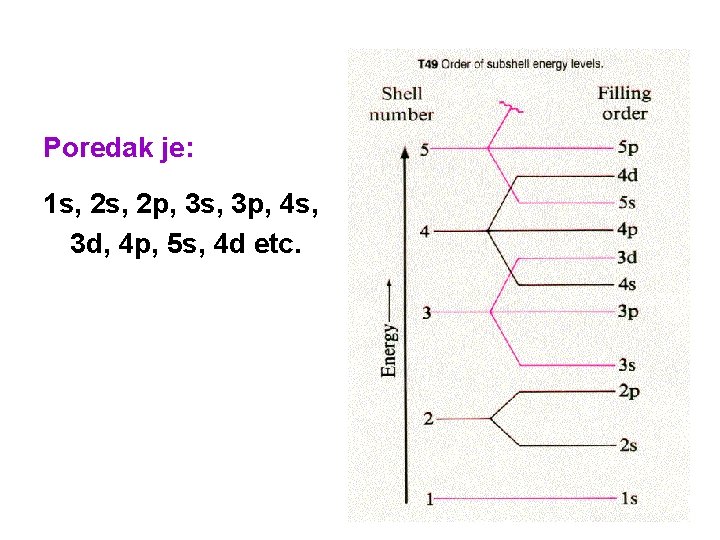
Poredak je: 1 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d etc.
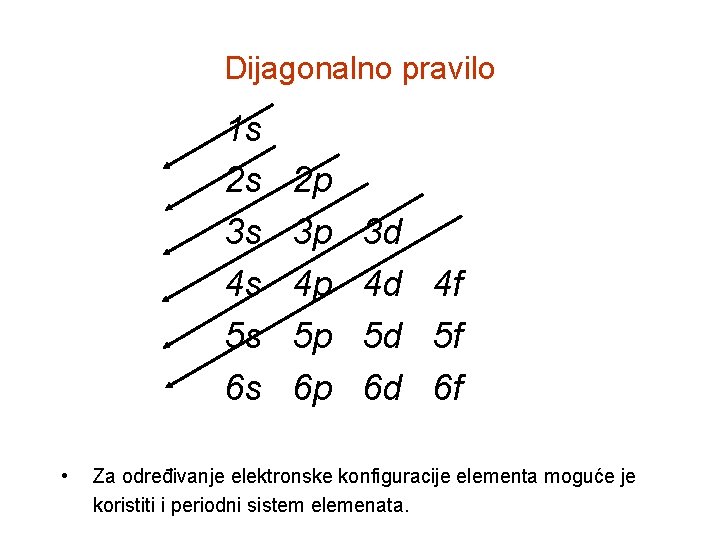
Dijagonalno pravilo 1 s 2 s 3 s 4 s 5 s 6 s • 2 p 3 p 4 p 5 p 6 p 3 d 4 d 4 f 5 d 5 f 6 d 6 f Za određivanje elektronske konfiguracije elementa moguće je koristiti i periodni sistem elemenata.

II. ELEKTRONSKE KONFIGURACIJE – OSNOVNO STANJE Element 1 H 2 He 3 Li 4 Be 5 B 6 C 7 N Elektronska konfiguracija 1 s 1 1 s 22 s 22 p 1 1 s 22 p 2 1 s 22 p 3

8 O 9 F 1 s 22 p 4 1 s 22 p 5 10 Ne 11 Na 12 Mg 13 Al 14 Si 1 s 22 s 22 p 63 s 1 1 s 22 s 22 p 63 s 23 p 1 1 s 22 p 63 s 23 p 2 15 P 16 S 17 Cl 18 Ar 1 s 22 p 63 s 23 p 3 1 s 22 p 63 s 23 p 4 1 s 22 p 63 s 23 p 5 1 s 22 p 63 s 23 p 6

19 K 20 Ca 1 s 22 p 63 s 23 p 64 s 1 1 s 22 p 63 s 23 p 64 s 2 21 Sc 1 s 22 p 63 s 23 p 64 s 23 d 1 22 Ti 23 V 1 s 22 p 63 s 23 p 64 s 23 d 2 1 s 22 p 63 s 23 p 64 s 23 d 3 24 Cr 1 s 22 p 63 s 23 p 64 s 13 d 5
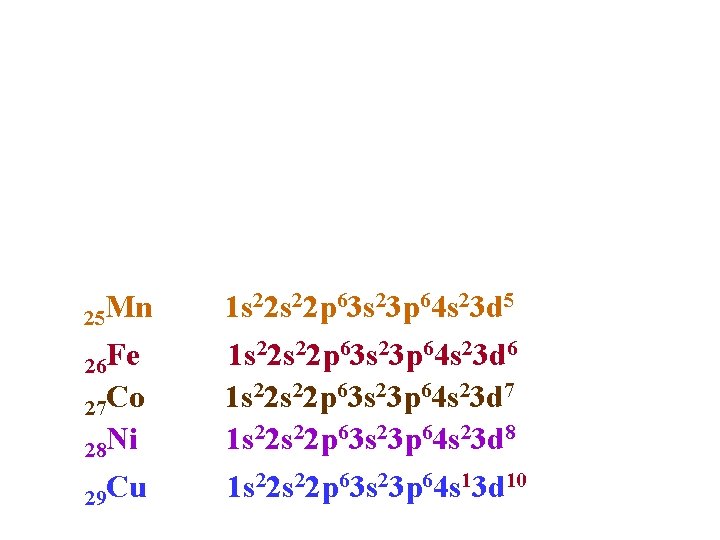
25 Mn 26 Fe 27 Co 28 Ni 29 Cu 1 s 22 p 63 s 23 p 64 s 23 d 5 1 s 22 p 63 s 23 p 64 s 23 d 6 1 s 22 p 63 s 23 p 64 s 23 d 7 1 s 22 p 63 s 23 p 64 s 23 d 8 1 s 22 p 63 s 23 p 64 s 13 d 10

Dodatni izuzeci su Mo 5 s 14 d 5; Au 6 s 15 d 10 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr Ag 5 s 14 d 10; 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 1 1 s 2 2 s 22 p 63 s 23 p 64 s 23 d 104 p 2 1 s 2 2 s 22 p 63 s 23 p 64 s 23 d 104 p 3 1 s 22 p 63 s 23 p 64 s 23 d 104 p 4 1 s 22 p 63 s 23 p 64 s 23 d 104 p 5 1 s 22 p 63 s 23 p 64 s 23 d 104 p 6

Elektronska konfiguracija višeelektronskih atoma (Princip izgradnje) • Elektroni nastoje da budu u najnižim energetskim stanjima (orbitalama). • Princip izgradnje nas vodi kod popunjavanja orbita: – Popuni prvo najnižu energiju. – U svakoj orbitali mogu biti maksimalno dva elektrona suprotnih spinova. – Degenerisane orbitale (one sa istom energijom) slijede Hundovo pravilo • Hundovo pravilo: Ako dvije ili više orbitala imaju istu energiju, popuni svaku orbitalu sa po jednim elektronom prije nego upariš elektrone. To jest 1: Odredi elektronsku konfiguraciju vodonika i helijuma: – H 1 s 1; – He 1 s 2; To jest 2 ; Odredi elektronsku konfiguraciju elemenata drugog reda. To jest 3: Odredi elektronsku konfiguraciju elemenata iz četvrtog reda. • Ukratko: elektronska konfiguracija arsena je [Ar]4 s 23 d 104 p 3.

Orbitalni Dijagrami

1 s 2 s 2 p



Periodni sistem i elektronska konfiguracija • Elementi u istoj koloni će imati istu elektronsku konfiguraciju zadnje ljuske.

Anomalne elektronske konfiguracije • Postoji nekoliko izuzetaka u odnosu na princip izgradnje. Stabilna konfiguracija: – Polu-popunjena d podljuska: • Cr has [Ar]4 s 13 d 5; • Mo has [Kr] 5 s 14 d 5 – Popunjena d podljuska: • Cu has [Ar]4 s 13 d 10 • Ag has [Kr]5 s 14 d 10. • Au has [Xe]6 s 14 f 145 d 10 • Izuzeci se dešavaju kod većih elemenata gdje su orbitalne energije slične.

Razvoj periodnog sistema • Mendeljejev je razvio periodni sistem tako što je redao elemente po njihovim hemijskim osobinama. • Alkalni metali imaju valenciju +1, alkalni metali zemlje + 2 • Nemetali obično imaju negativnu valenciju ( 1 za halide, 2 za grupu 6 A, itd. ) • Uočena su prazna mjesta gdje treba da se nalaze neki elementi • Otkrivanje elemenata sa tačnim osobinama.

Periodične osobine • Zakon periodičnosti = elementi koji su poredani po atomskom broju imaju fizičke i hemijske osobine koje se mijenjaju periodično. • Posmatrajmo slijedeće trendove periodičnosti: – Poluprečnici atoma – Energuja jonizacije – Elektronski afinitet

Orbitale i višeelektronski atomi • Elektrone privlači nukleus, ali ih odbijaju ostali elektroni u omotaču. • Ovo odbijanje od strane drugih elektrona smanjuje privlačenje od nukleusa za mali iznos pa zato govorimo o “efektivnom naboju nukleusa” • Efektivni naboj nukleusa: Čisti naboj nukleusa koji osjeća elektron nakon zaklanjanja drugim elektronima u atomu. • Zeff = Zact Zshield.

Atomic Radius • Atomski radijusi u stvari opadaju duž reda u periodnom sistemu usljed rasta efektivnog naboja nukleusa. • Unutar svake grupe (vertikalna kolona) atomski radijusi rastu sa brojem periode. Atomski radijusi elemenata

Atomski radijus 2 • Ako je pozitivno valentan, radijus opada dok ako je negativno valentan radijus raste. • Kada substance imaju isti broj elektrona (izoelektronik) radijus će zavisiti od toga koji ima najveći broj protona. PRIMJER: Odredi koja od slijedećih substanci ima najveći radijus: P 3 , S 2 , Cl , Ar, K+, Ca 2+.

Jonizaciona energija • Jonizaciona energija, Ei: minimalna energija potrebna da se elektron pomjeri iz osnovnog stanja M(g) + h M+ + e. • Ei je u vezi sa elektronskom konfiguracijom. Više energije = stabilno osnovno stanje. • Predznak jonizacione energije je uvijek pozitivan, tj. tu energiju treba dovesti da bi se desila jonizacija. • Jonizaciona energija je inverzno proporcionalna sa radijusom i direktno je u vezi sa Zeff.

Jonizaciona energija • Izuzeci: – B, Al, Ga, itd. : njihove jonizacione energije su malo niže od jonizacionih energija elemenata koji su prije njih u periodi. • Before ionization ns 2 np 1. • After ionization is ns 2. Higher energy smaller radius. – Group 6 A elements. • Before ionization ns 2 np 4. • After ionization ns 2 np 3 where each p electron in different orbital (Hund’s rule). • Electron-electron repulsion by two electrons in same orbital increases the energy (lowers EI).

Orbitalni Dijagrami

1 s 2 s 2 p



Periodni sistem i elektronska konfiguracija • Elementi u istoj koloni će imati istu elektronsku konfiguraciju zadnje ljuske.

Anomalne elektronske konfiguracije • Postoji nekoliko izuzetaka u odnosu na princip izgradnje. Stabilna konfiguracija: – Polu-popunjena d podljuska: • Cr has [Ar]4 s 13 d 5; • Mo has [Kr] 5 s 14 d 5 – Popunjena d podljuska: • Cu has [Ar]4 s 13 d 10 • Ag has [Kr]5 s 14 d 10. • Au has [Xe]6 s 14 f 145 d 10 • Izuzeci se dešavaju kod većih elemenata gdje su orbitalne energije slične.

Razvoj periodnog sistema • Mendeljejev je razvio periodni sistem tako što je redao elemente po njihovim hemijskim osobinama. • Alkalni metali imaju valenciju +1, alkalni metali zemlje + 2 • Nemetali obično imaju negativnu valenciju ( 1 za halide, 2 za grupu 6 A, itd. ) • Uočena su prazna mjesta gdje treba da se nalaze neki elementi • Otkrivanje elemenata sa tačnim osobinama.

Periodične osobine • Zakon periodičnosti = elementi koji su poredani po atomskom broju imaju fizičke i hemijske osobine koje se mijenjaju periodično. • Posmatrajmo slijedeće trendove periodičnosti: – Poluprečnici atoma – Energuja jonizacije – Elektronski afinitet

Orbitale i višeelektronski atomi • Elektrone privlači nukleus, ali ih odbijaju ostali elektroni u omotaču. • Ovo odbijanje od strane drugih elektrona smanjuje privlačenje od nukleusa za mali iznos pa zato govorimo o “efektivnom naboju nukleusa” • Efektivni naboj nukleusa: Čisti naboj nukleusa koji osjeća elektron nakon zaklanjanja drugim elektronima u atomu. • Zeff = Zact Zshield.

Atomic Radius • Atomski radijusi u stvari opadaju duž reda u periodnom sistemu usljed rasta efektivnog naboja nukleusa. • Unutar svake grupe (vertikalna kolona) atomski radijusi rastu sa brojem periode. Atomski radijusi elemenata

Atomski radijus 2 • Ako je pozitivno valentan, radijus opada dok ako je negativno valentan radijus raste. • Kada substance imaju isti broj elektrona (izoelektronik) radijus će zavisiti od toga koji ima najveći broj protona. PRIMJER: Odredi koja od slijedećih substanci ima najveći radijus: P 3 , S 2 , Cl , Ar, K+, Ca 2+.

Jonizaciona energija • Jonizaciona energija, Ei: minimalna energija potrebna da se elektron pomjeri iz osnovnog stanja M(g) + h M+ + e. • Ei je u vezi sa elektronskom konfiguracijom. Više energije = stabilno osnovno stanje. • Predznak jonizacione energije je uvijek pozitivan, tj. tu energiju treba dovesti da bi se desila jonizacija. • Jonizaciona energija je inverzno proporcionalna sa radijusom i direktno je u vezi sa Zeff.

Jonizaciona energija • Izuzeci: – B, Al, Ga, itd. : njihove jonizacione energije su malo niže od jonizacionih energija elemenata koji su prije njih u periodi. • Before ionization ns 2 np 1. • After ionization is ns 2. Higher energy smaller radius. – Group 6 A elements. • Before ionization ns 2 np 4. • After ionization ns 2 np 3 where each p electron in different orbital (Hund’s rule). • Electron-electron repulsion by two electrons in same orbital increases the energy (lowers EI).
- Slides: 38