Krystalizacja Wykad nr 9 Inynieria Chemiczna i Procesowa











- Slides: 41

Krystalizacja Wykład nr 9

Inżynieria Chemiczna i Procesowa Krystalizacja – jeden z najstarszych procesów przetwórczych. Jej szczególny przypadek czyli krystalizacja masowa z roztworów jest stosowana do wydzielania oczyszczania i formowania wielu różnorodnych substancji pochodzenia organicznego i nieorganicznego w przemyśle chemicznym, spożywczym i farmaceutycznym Właściwemu procesowi krystalizacji masowej z roztworów tj. zarodkowaniu i wzrostowi kryształów, towarzyszą liczne procesy ogólne i cząstkowe tj: wymiana ciepła i pędu, reakcja chemiczna, odparowanie , mieszanie , ścieranie, aglomeracja adsorpcja zanieczyszczeń. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Wykresy dla krystalizacji Na zasadzie danych rozpuszczalności konstruuje się wykresy fazowe krystalizacji. Pozwalają one określić rodzaj wydzielonej fazy stałej oraz prowadzić obliczenia bilansowe. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

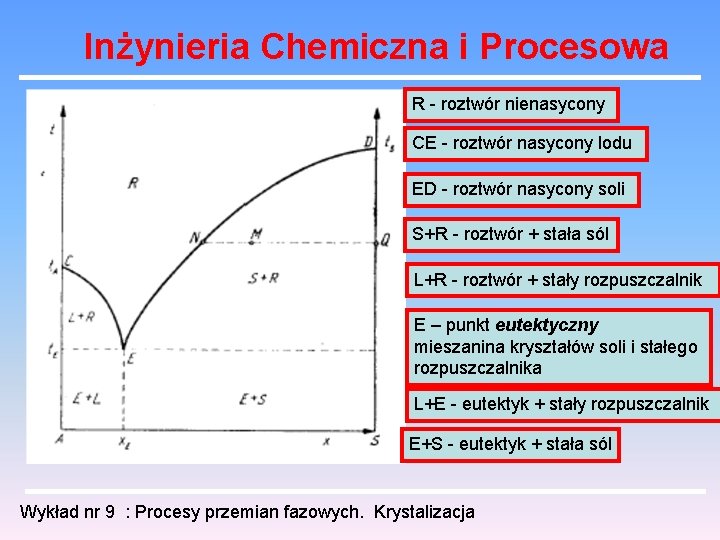
Inżynieria Chemiczna i Procesowa R - roztwór nienasycony CE - roztwór nasycony lodu ED - roztwór nasycony soli S+R - roztwór + stała sól L+R - roztwór + stały rozpuszczalnik E – punkt eutektyczny mieszanina kryształów soli i stałego rozpuszczalnika L+E - eutektyk + stały rozpuszczalnik E+S - eutektyk + stała sól Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

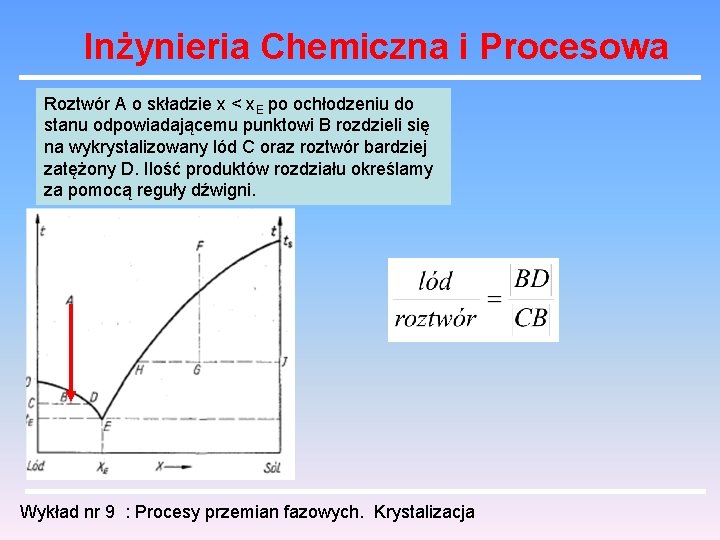
Inżynieria Chemiczna i Procesowa Roztwór A o składzie x < x. E po ochłodzeniu do stanu odpowiadającemu punktowi B rozdzieli się na wykrystalizowany lód C oraz roztwór bardziej zatężony D. Ilość produktów rozdziału określamy za pomocą reguły dźwigni. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

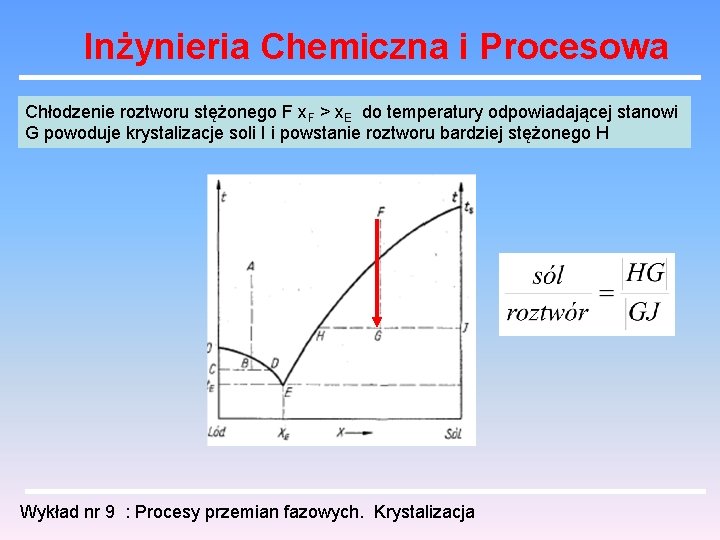
Inżynieria Chemiczna i Procesowa Chłodzenie roztworu stężonego F x. F > x. E do temperatury odpowiadającej stanowi G powoduje krystalizacje soli I i powstanie roztworu bardziej stężonego H Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

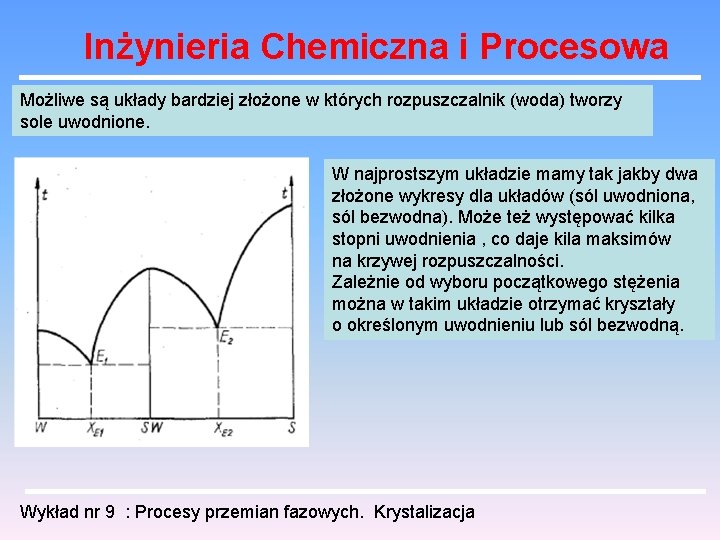
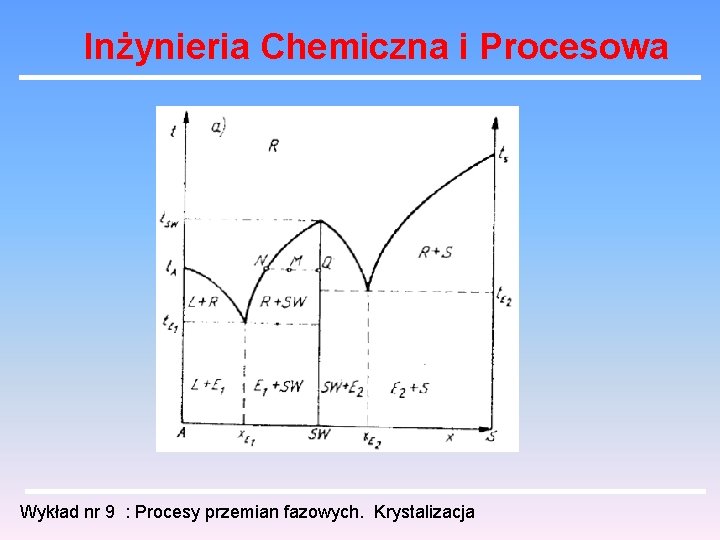
Inżynieria Chemiczna i Procesowa Możliwe są układy bardziej złożone w których rozpuszczalnik (woda) tworzy sole uwodnione. W najprostszym układzie mamy tak jakby dwa złożone wykresy dla układów (sól uwodniona, sól bezwodna). Może też występować kilka stopni uwodnienia , co daje kila maksimów na krzywej rozpuszczalności. Zależnie od wyboru początkowego stężenia można w takim układzie otrzymać kryształy o określonym uwodnieniu lub sól bezwodną. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

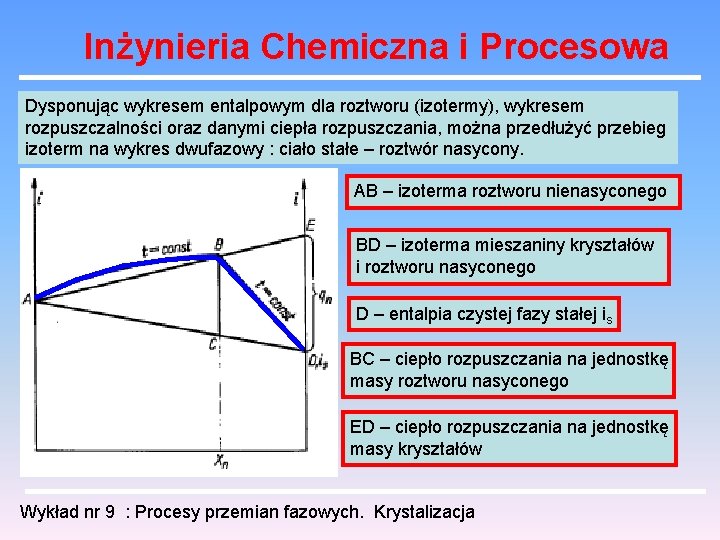
Inżynieria Chemiczna i Procesowa Dysponując wykresem entalpowym dla roztworu (izotermy), wykresem rozpuszczalności oraz danymi ciepła rozpuszczania, można przedłużyć przebieg izoterm na wykres dwufazowy : ciało stałe – roztwór nasycony. AB – izoterma roztworu nienasyconego BD – izoterma mieszaniny kryształów i roztworu nasyconego D – entalpia czystej fazy stałej is BC – ciepło rozpuszczania na jednostkę masy roztworu nasyconego ED – ciepło rozpuszczania na jednostkę masy kryształów Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

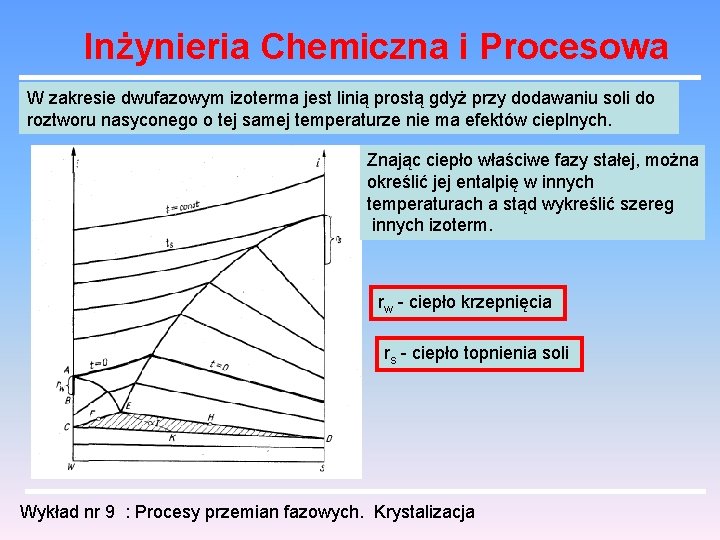
Inżynieria Chemiczna i Procesowa W zakresie dwufazowym izoterma jest linią prostą gdyż przy dodawaniu soli do roztworu nasyconego o tej samej temperaturze nie ma efektów cieplnych. Znając ciepło właściwe fazy stałej, można określić jej entalpię w innych temperaturach a stąd wykreślić szereg innych izoterm. rw - ciepło krzepnięcia rs - ciepło topnienia soli Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

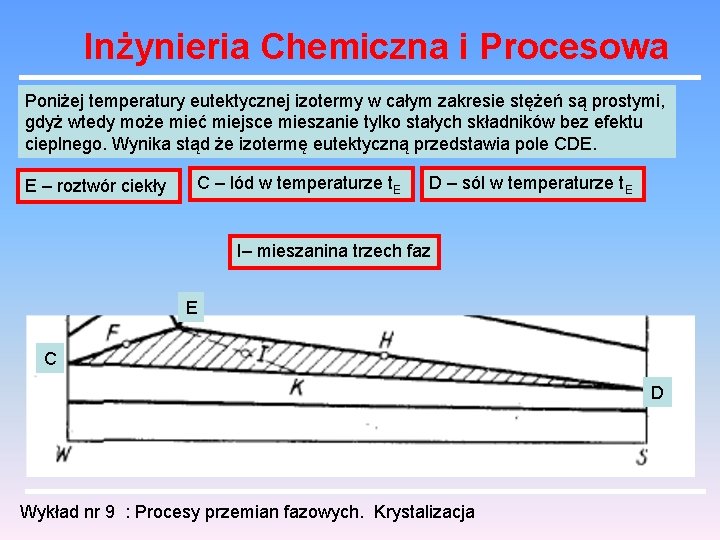
Inżynieria Chemiczna i Procesowa Poniżej temperatury eutektycznej izotermy w całym zakresie stężeń są prostymi, gdyż wtedy może mieć miejsce mieszanie tylko stałych składników bez efektu cieplnego. Wynika stąd że izotermę eutektyczną przedstawia pole CDE. E – roztwór ciekły C – lód w temperaturze t. E D – sól w temperaturze t. E I– mieszanina trzech faz E C D Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

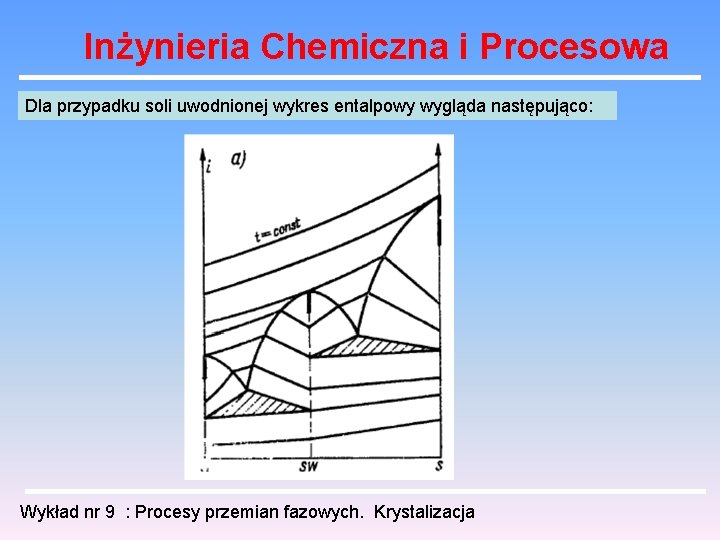
Inżynieria Chemiczna i Procesowa Dla przypadku soli uwodnionej wykres entalpowy wygląda następująco: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

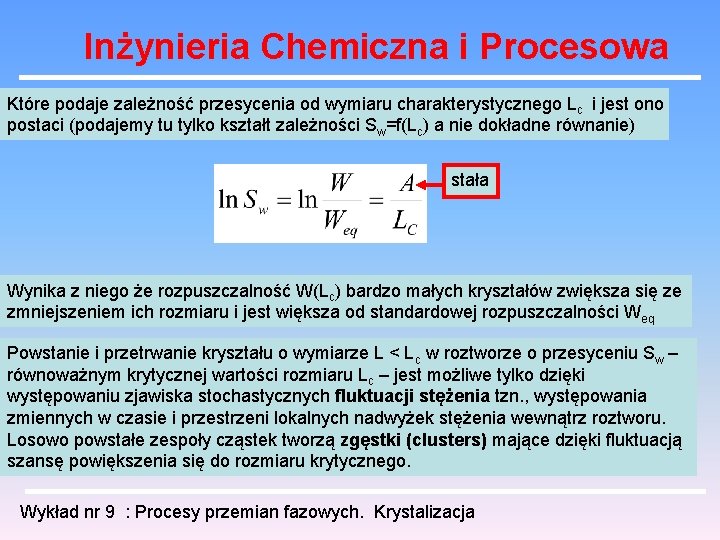
Inżynieria Chemiczna i Procesowa Kinetyka procesu krystalizacji Na proces krystalizacji z roztworu składają się dwa procesy : zarodkowanie i wzrost kryształów. Zarodkowaniem (nukleacją) nazywany jest proces powstawania najmniejszych kryształów substancji rozpuszczonej, jakie są stabilne termodynamicznie w kontakcie z przesyconym roztworem. Kryształy te noszą nazwę zarodków. Mają one rozmiary rzędu 10 -8 m i składają się z kilkunastu do kilkuset tysięcy cząsteczek. Rozmiar charakterystyczny Lc bardzo małego kryształu w równowadze z roztworem o danym stopniu przesycenia Sw nazywany jest krytycznym gdy kryształy mniejsze od niego rozpuszczają się natomiast o rozmiarze większym rosną dalej. Ilościowo ujmuje to równanie Ostwalda - Freundlicha Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Które podaje zależność przesycenia od wymiaru charakterystycznego Lc i jest ono postaci (podajemy tu tylko kształt zależności Sw=f(Lc) a nie dokładne równanie) stała Wynika z niego że rozpuszczalność W(Lc) bardzo małych kryształów zwiększa się ze zmniejszeniem ich rozmiaru i jest większa od standardowej rozpuszczalności Weq Powstanie i przetrwanie kryształu o wymiarze L < Lc w roztworze o przesyceniu Sw – równoważnym krytycznej wartości rozmiaru Lc – jest możliwe tylko dzięki występowaniu zjawiska stochastycznych fluktuacji stężenia tzn. , występowania zmiennych w czasie i przestrzeni lokalnych nadwyżek stężenia wewnątrz roztworu. Losowo powstałe zespoły cząstek tworzą zgęstki (clusters) mające dzięki fluktuacją szansę powiększenia się do rozmiaru krytycznego. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Zarodkowanie zachodzące wyłącznie wskutek fluktuacji dużego przesycenia średniego nosi nazwę zarodkowania homogenicznego Obecność cząstek obcych np. pyłu z atmosfery w roztworze znacznie zwiększa prawdopodobieństwo powstawania i wzrostu zgestka na cząstkach przy przesyceniu mniejszym niż dla procesu homogenicznego. Proces przebiegający według tego mechanizmu nazywany jest zarodkowaniem heterogenicznym Proces nie warunkowany obecnością kryształów substancji rozpuszczonej w roztworze zwany jest zarodkowaniem pierwotnym Występowanie kryształów jako niezbędny warunek powstawania zarodków jest charakterystyczny dla zarodkowaniem wtórnego Źródłem zarodków jest powierzchnia kryształów rosnących. Dodaje się je do roztworu gdzie rozpuszczają się lub rosną. Zarodkowanie wtórne zachodzi przy znacznie mniejszym przesyceniu niż zarodkowanie heterogeniczne. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa W warunkach przemysłowych, przy prawidłowej eksploatacji właściwie zaprojektowanego krystalizatora dominuje szczególny mechanizm zarodkowania wtórnego zwany – kontaktowym. (contact nucleation) wywołane jest ono przez zderzenia kryształów ze sobą, ze ścianami aparatu lub z mieszadłem Stwierdziliśmy, że rozpuszczalność bardzo małych kryształów jest większa niż kryształów dużych. Stąd też aby mogło nastąpić utworzenie pierwszych kryształów, roztwór musi być w pewnym stopniu przechładzany w stosunku do równowagi. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

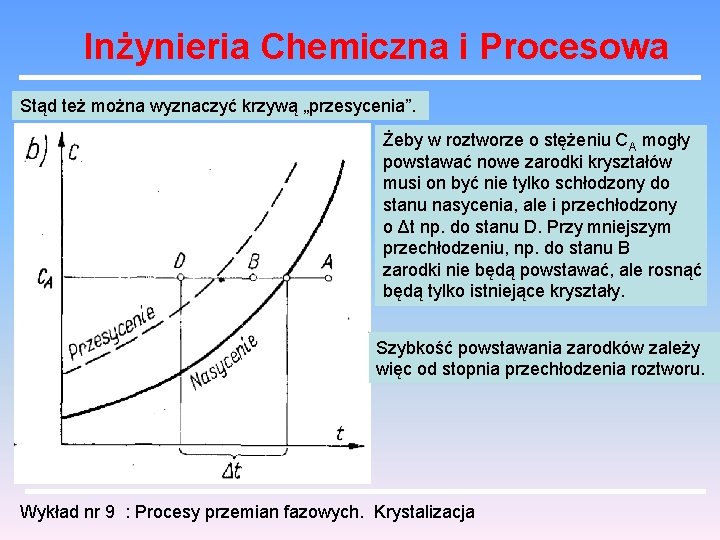
Inżynieria Chemiczna i Procesowa Stąd też można wyznaczyć krzywą „przesycenia”. Żeby w roztworze o stężeniu CA mogły powstawać nowe zarodki kryształów musi on być nie tylko schłodzony do stanu nasycenia, ale i przechłodzony o Δt np. do stanu D. Przy mniejszym przechłodzeniu, np. do stanu B zarodki nie będą powstawać, ale rosnąć będą tylko istniejące kryształy. Szybkość powstawania zarodków zależy więc od stopnia przechłodzenia roztworu. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

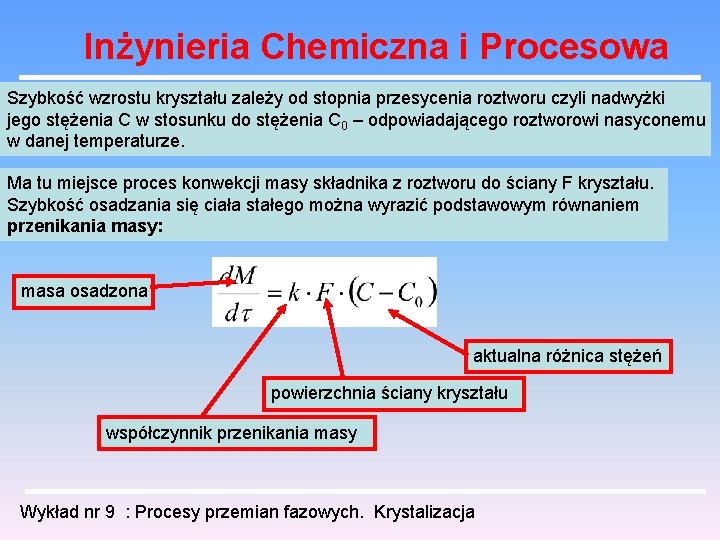
Inżynieria Chemiczna i Procesowa Szybkość wzrostu kryształu zależy od stopnia przesycenia roztworu czyli nadwyżki jego stężenia C w stosunku do stężenia C 0 – odpowiadającego roztworowi nasyconemu w danej temperaturze. Ma tu miejsce proces konwekcji masy składnika z roztworu do ściany F kryształu. Szybkość osadzania się ciała stałego można wyrazić podstawowym równaniem przenikania masy: masa osadzona aktualna różnica stężeń powierzchnia ściany kryształu współczynnik przenikania masy Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Analogiczne równania można ułożyć dla każdej ze ścian kryształu: Ze względu na prawidłowość formy geometrycznej kryształu każda ze ścian stanowi pewien ułamek całej powierzchni kryształu: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

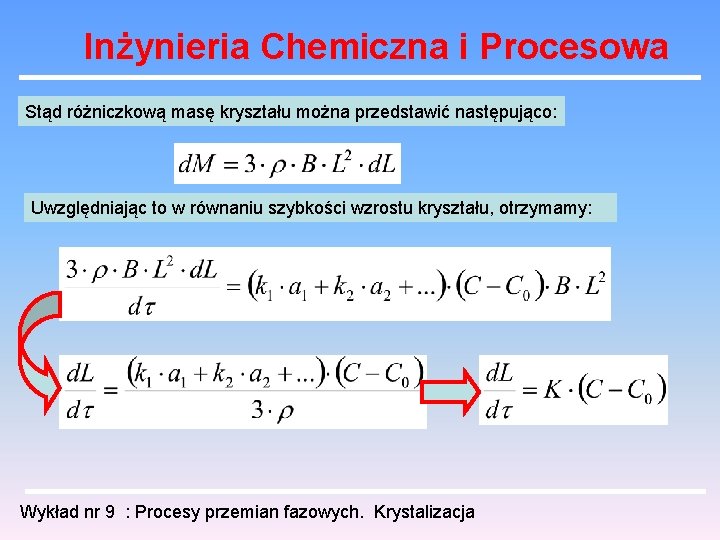
Inżynieria Chemiczna i Procesowa Suma wzrostu poszczególnych ścian jest miarą szybkości wzrostu całego kryształu: Powierzchnia kryształu jest proporcjonalna do kwadratu charakterystycznego wymiaru liniowego L (np. głównej osi): Objętość zaś będzie proporcjonalna do L 3: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Stąd różniczkową masę kryształu można przedstawić następująco: Uwzględniając to w równaniu szybkości wzrostu kryształu, otrzymamy: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa A więc w danym roztworze wszystkie kryształy (małe i duże) rosną z jednakową szybkością liniową. W ciągu tego samego czasu wszystkie kryształy powiększają swój charakterystyczny wymiar liniowy o tą samą wartość. Charakterystyczny jest wpływ stopnia przesycenia ( C - C 0 ) lub przechłodzenia –Δt na szybkość wzrostu kryształu. Według ostatniego równania, szybkość ta jest proporcjonalna do przesycenia ( C - C 0 ). Przy większych przesyceniach zależność ta zawodzi, gdyż wskutek wzrostu lepkości roztworu maleje współczynnik kinetyczny K. Otrzymuje się dość charakterystyczny przebieg szybkości wzrostu kryształu od stopnia przesycenia lub przechłodzenia: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

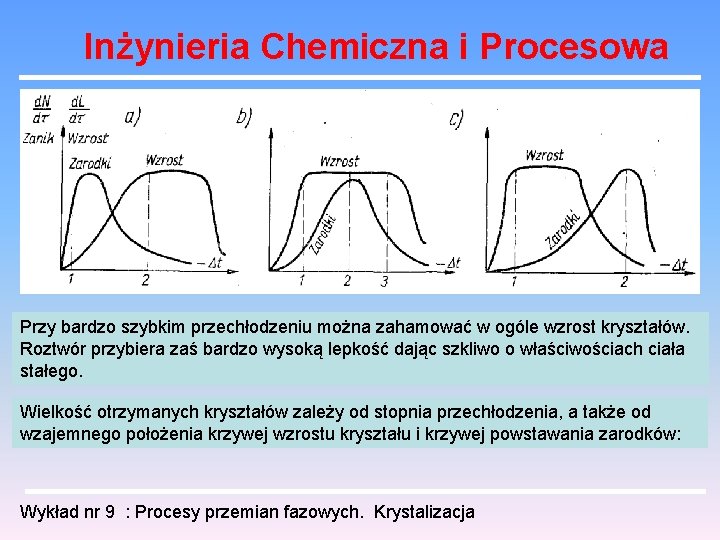
Inżynieria Chemiczna i Procesowa Przy bardzo szybkim przechłodzeniu można zahamować w ogóle wzrost kryształów. Roztwór przybiera zaś bardzo wysoką lepkość dając szkliwo o właściwościach ciała stałego. Wielkość otrzymanych kryształów zależy od stopnia przechłodzenia, a także od wzajemnego położenia krzywej wzrostu kryształu i krzywej powstawania zarodków: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

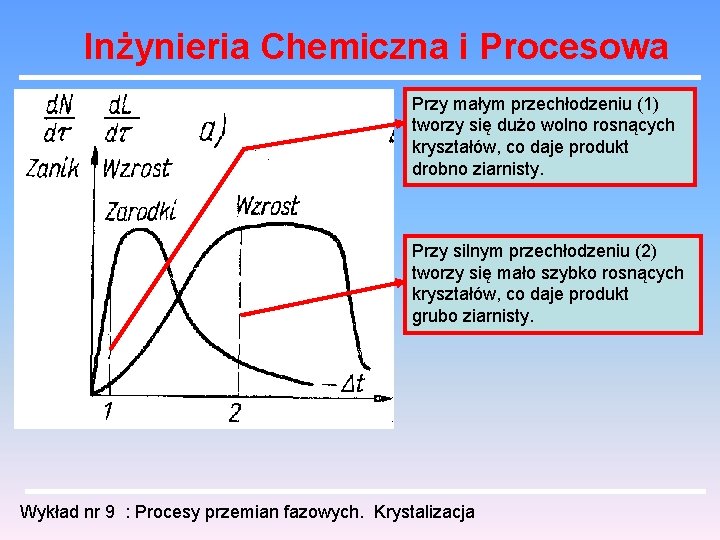
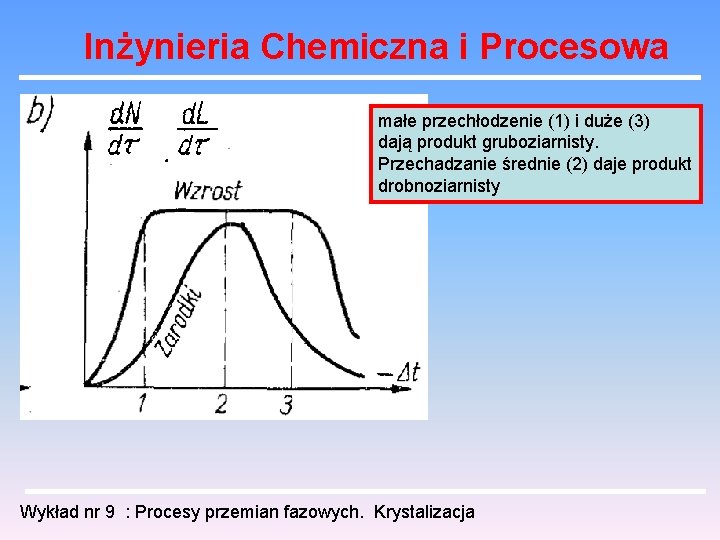
Inżynieria Chemiczna i Procesowa Przy małym przechłodzeniu (1) tworzy się dużo wolno rosnących kryształów, co daje produkt drobno ziarnisty. Przy silnym przechłodzeniu (2) tworzy się mało szybko rosnących kryształów, co daje produkt grubo ziarnisty. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

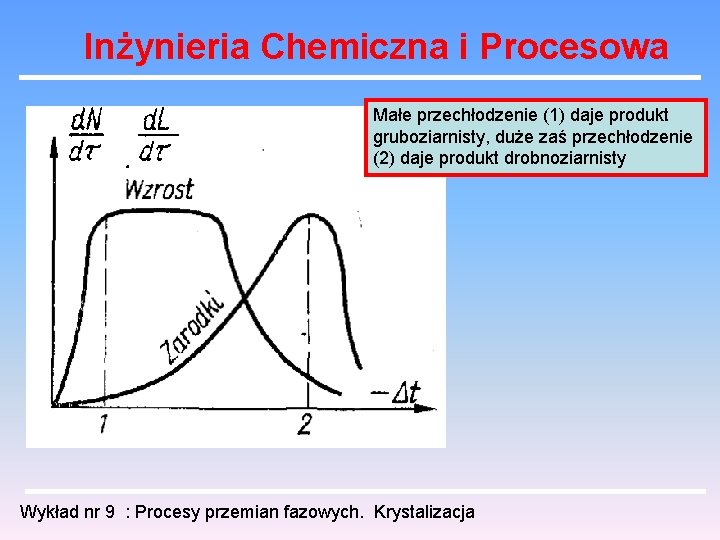
Inżynieria Chemiczna i Procesowa małe przechłodzenie (1) i duże (3) dają produkt gruboziarnisty. Przechadzanie średnie (2) daje produkt drobnoziarnisty Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Małe przechłodzenie (1) daje produkt gruboziarnisty, duże zaś przechłodzenie (2) daje produkt drobnoziarnisty Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

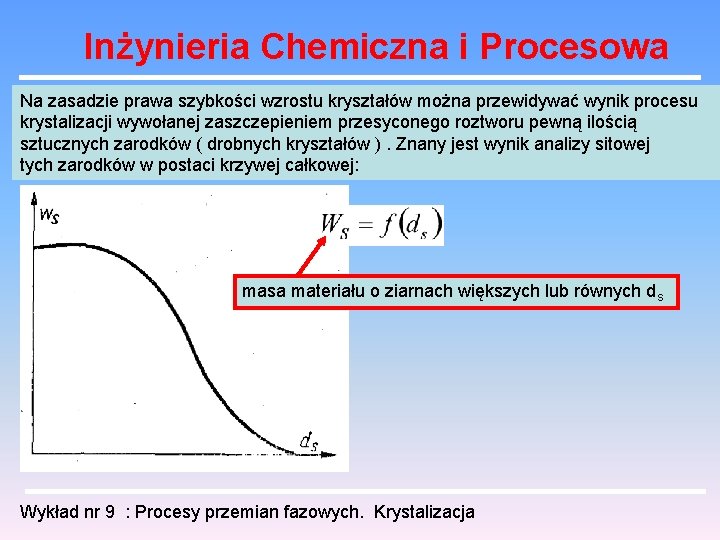
Inżynieria Chemiczna i Procesowa Na zasadzie prawa szybkości wzrostu kryształów można przewidywać wynik procesu krystalizacji wywołanej zaszczepieniem przesyconego roztworu pewną ilością sztucznych zarodków ( drobnych kryształów ). Znany jest wynik analizy sitowej tych zarodków w postaci krzywej całkowej: masa materiału o ziarnach większych lub równych ds Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

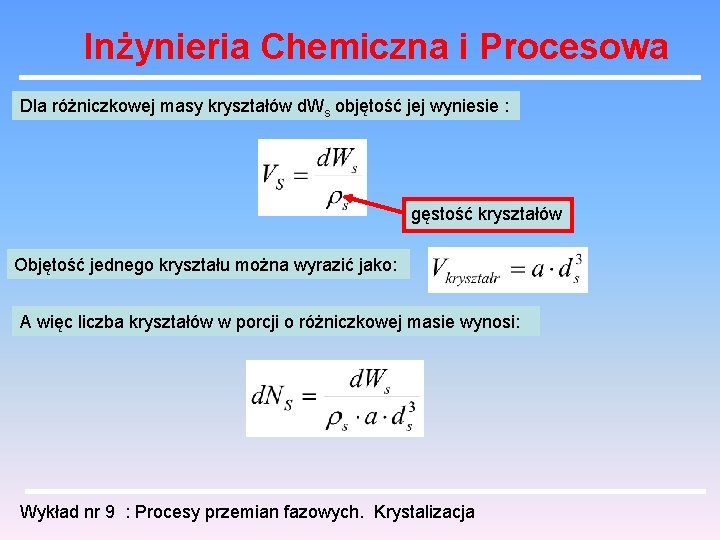
Inżynieria Chemiczna i Procesowa Dla różniczkowej masy kryształów d. Ws objętość jej wyniesie : gęstość kryształów Objętość jednego kryształu można wyrazić jako: A więc liczba kryształów w porcji o różniczkowej masie wynosi: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

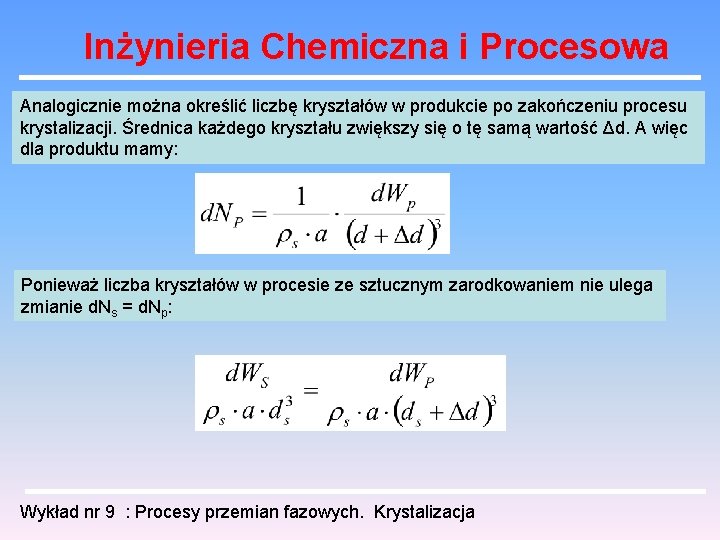
Inżynieria Chemiczna i Procesowa Analogicznie można określić liczbę kryształów w produkcie po zakończeniu procesu krystalizacji. Średnica każdego kryształu zwiększy się o tę samą wartość Δd. A więc dla produktu mamy: Ponieważ liczba kryształów w procesie ze sztucznym zarodkowaniem nie ulega zmianie d. Ns = d. Np: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

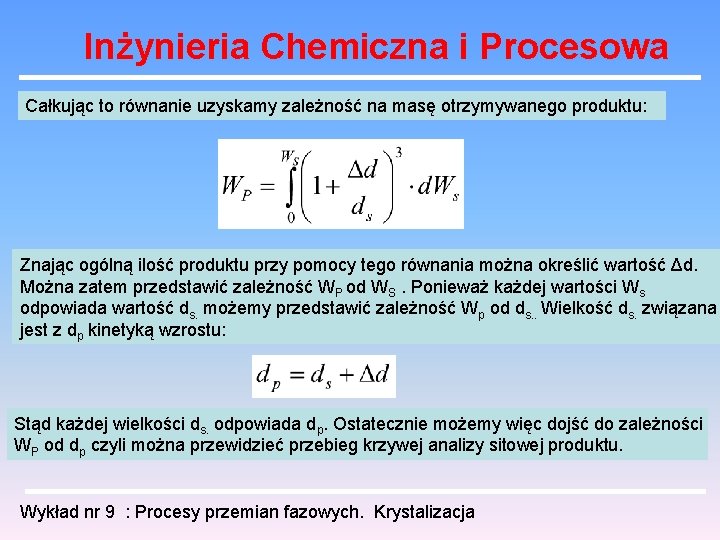
Inżynieria Chemiczna i Procesowa Całkując to równanie uzyskamy zależność na masę otrzymywanego produktu: Znając ogólną ilość produktu przy pomocy tego równania można określić wartość Δd. Można zatem przedstawić zależność WP od WS. Ponieważ każdej wartości Ws odpowiada wartość ds. możemy przedstawić zależność Wp od ds. . Wielkość ds. związana jest z dp kinetyką wzrostu: Stąd każdej wielkości ds. odpowiada dp. Ostatecznie możemy więc dojść do zależności WP od dp czyli można przewidzieć przebieg krzywej analizy sitowej produktu. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

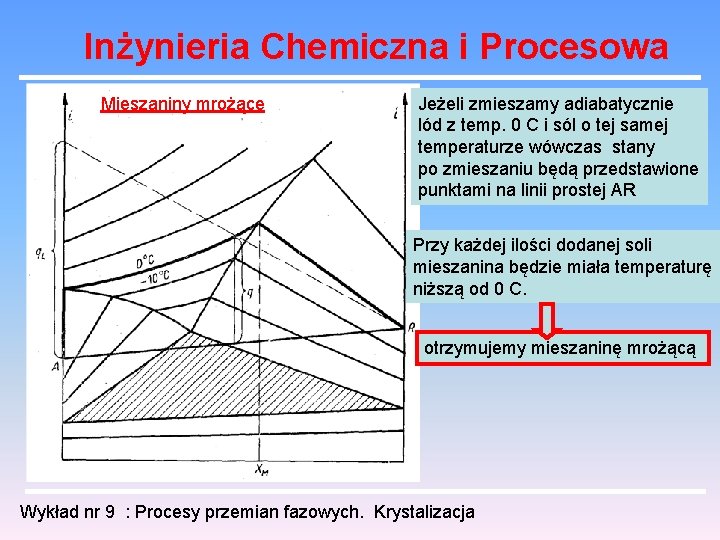
Inżynieria Chemiczna i Procesowa Mieszaniny mrożące Jeżeli zmieszamy adiabatycznie lód z temp. 0 C i sól o tej samej temperaturze wówczas stany po zmieszaniu będą przedstawione punktami na linii prostej AR Przy każdej ilości dodanej soli mieszanina będzie miała temperaturę niższą od 0 C. otrzymujemy mieszaninę mrożącą Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

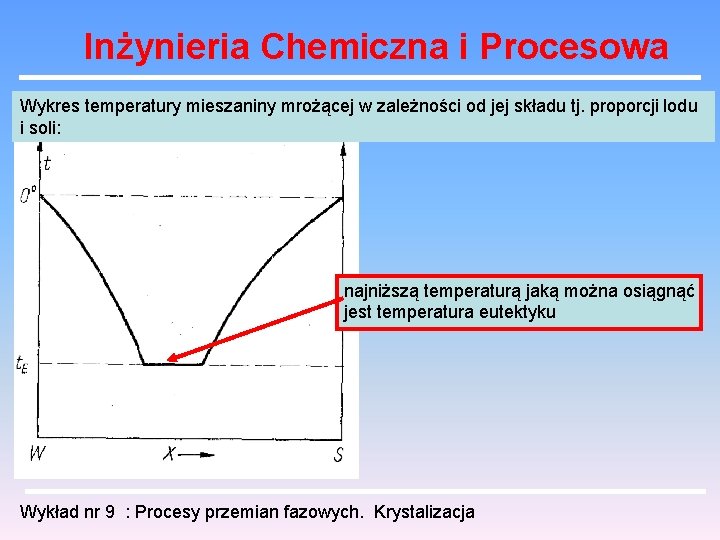
Inżynieria Chemiczna i Procesowa Wykres temperatury mieszaniny mrożącej w zależności od jej składu tj. proporcji lodu i soli: najniższą temperaturą jaką można osiągnąć jest temperatura eutektyku Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

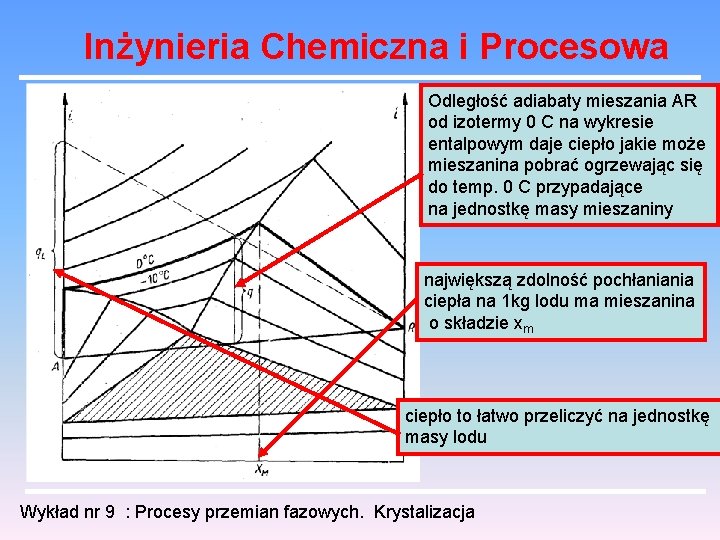
Inżynieria Chemiczna i Procesowa Odległość adiabaty mieszania AR od izotermy 0 C na wykresie entalpowym daje ciepło jakie może mieszanina pobrać ogrzewając się do temp. 0 C przypadające na jednostkę masy mieszaniny największą zdolność pochłaniania ciepła na 1 kg lodu ma mieszanina o składzie xm ciepło to łatwo przeliczyć na jednostkę masy lodu Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

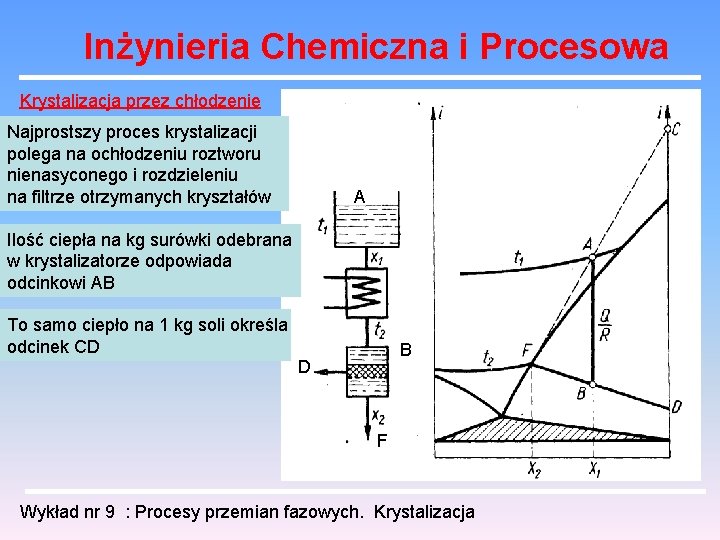
Inżynieria Chemiczna i Procesowa Krystalizacja przez chłodzenie Najprostszy proces krystalizacji polega na ochłodzeniu roztworu nienasyconego i rozdzieleniu na filtrze otrzymanych kryształów A Ilość ciepła na kg surówki odebrana w krystalizatorze odpowiada odcinkowi AB To samo ciepło na 1 kg soli określa odcinek CD B D F Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

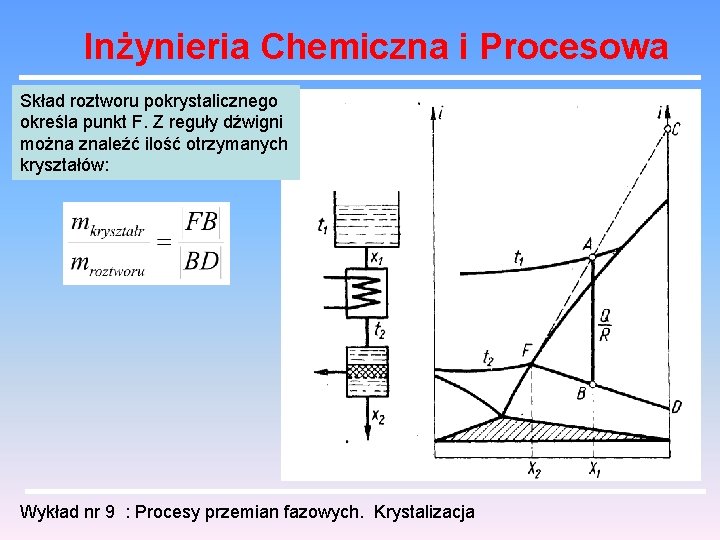
Inżynieria Chemiczna i Procesowa Skład roztworu pokrystalicznego określa punkt F. Z reguły dźwigni można znaleźć ilość otrzymanych kryształów: Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Krystalizacja przez odparowanie Znając charakter wykresu entalpowego dla roztworów nienasyconych z fazą parową, można je złączyć z wykresami krystalizacyjnymi w jedną całość Dla soli o wysokiej temperaturze topnienia i wrzenia pod wysokim ciśnieniem izobara nie przecina się z linią rozpuszczalności (a) Natomiast dla ciśnienia niższego otrzymujemy charakterystyczne przecięcie izobary z krzywą rozpuszczalności soli. Odpowiada ona roztworowi nasyconemu Xn wrzącemu pod ciśnieniem P. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

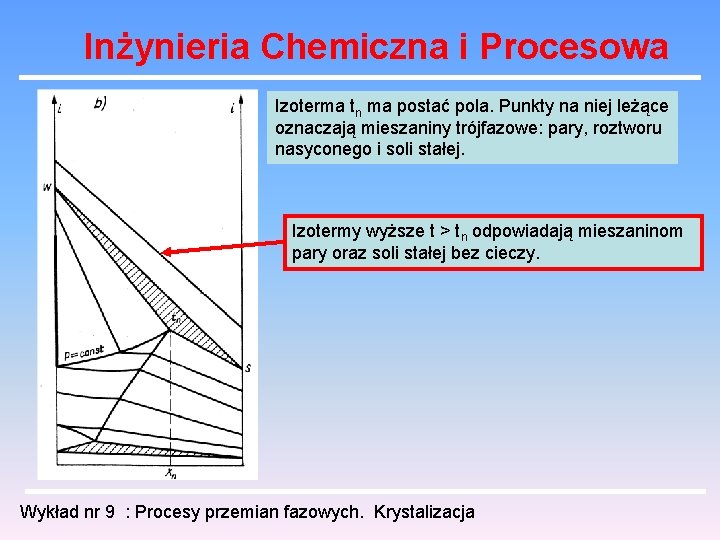
Inżynieria Chemiczna i Procesowa Izoterma tn ma postać pola. Punkty na niej leżące oznaczają mieszaniny trójfazowe: pary, roztworu nasyconego i soli stałej. Izotermy wyższe t > tn odpowiadają mieszaninom pary oraz soli stałej bez cieczy. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

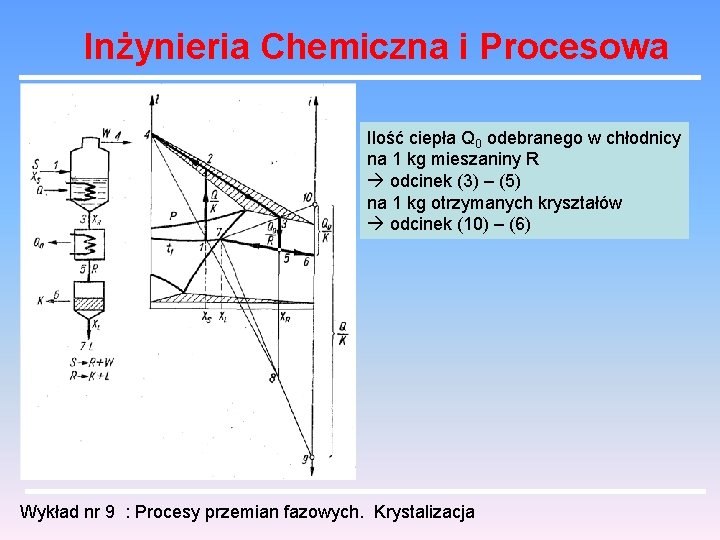
Inżynieria Chemiczna i Procesowa Na wykresie takim można analizować proces krystalizacji polegającego na odparowaniu rozpuszczalnika. Do warnika doprowadzamy ciepło tak że surówka (1) osiąga stan (2), a więc rozkłada się na opary (4) i mieszaninę (3). Mieszanina ta zostaje schłodzona do temperatury t 1 ( jak surówka) i w filtrze rozdzielona zostaje na kryształy (6) i roztwór nasycony (7). Ilość doprowadzonego ciepła na kg surówki odcinek (1) – (2) na kg roztworu opuszczającego warnik (3) odcinek (3) – (8) na kg otrzymanych kryształów odcinek (9) – (10) Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

Inżynieria Chemiczna i Procesowa Ilość ciepła Q 0 odebranego w chłodnicy na 1 kg mieszaniny R odcinek (3) – (5) na 1 kg otrzymanych kryształów odcinek (10) – (6) Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

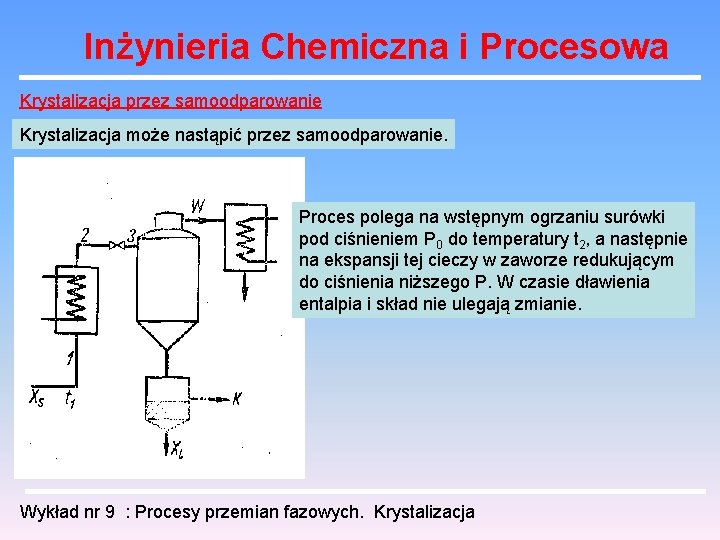
Inżynieria Chemiczna i Procesowa Krystalizacja przez samoodparowanie Krystalizacja może nastąpić przez samoodparowanie. Proces polega na wstępnym ogrzaniu surówki pod ciśnieniem P 0 do temperatury t 2, a następnie na ekspansji tej cieczy w zaworze redukującym do ciśnienia niższego P. W czasie dławienia entalpia i skład nie ulegają zmianie. Wykład nr 9 : Procesy przemian fazowych. Krystalizacja

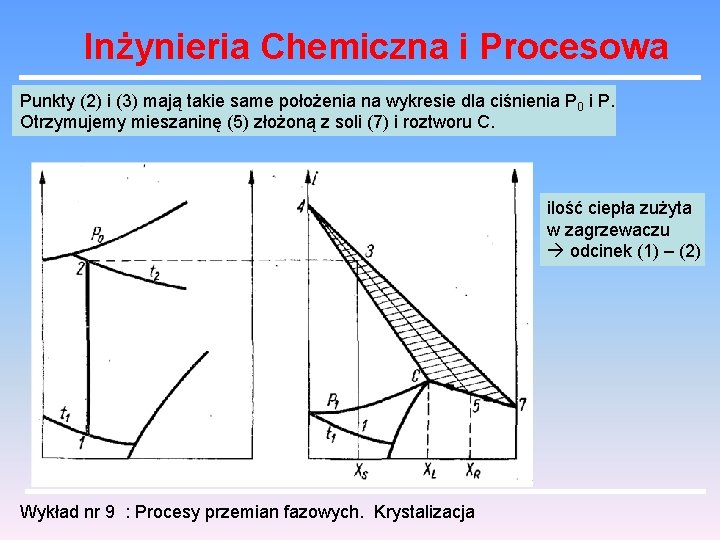
Inżynieria Chemiczna i Procesowa Punkty (2) i (3) mają takie same położenia na wykresie dla ciśnienia P 0 i P. Otrzymujemy mieszaninę (5) złożoną z soli (7) i roztworu C. ilość ciepła zużyta w zagrzewaczu odcinek (1) – (2) Wykład nr 9 : Procesy przemian fazowych. Krystalizacja