Koroze kov a slitin 1 Defincia korzie Korzia














- Slides: 40

Koroze kovů a slitin 1

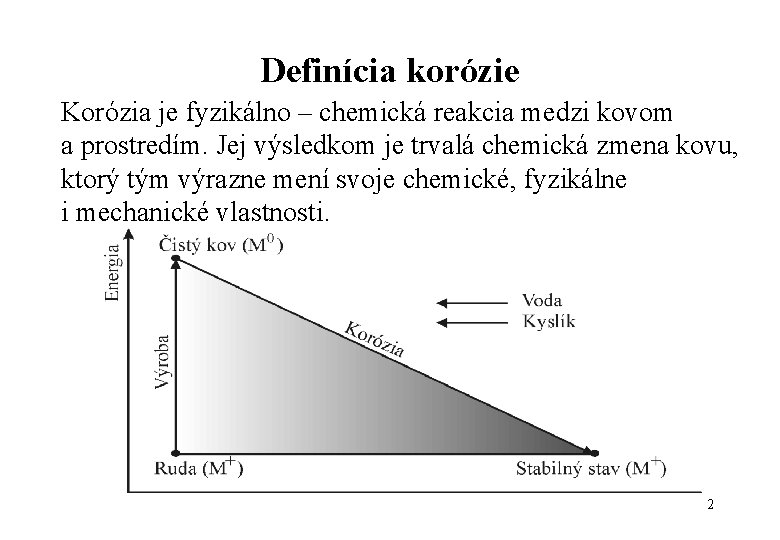
Definícia korózie Korózia je fyzikálno – chemická reakcia medzi kovom a prostredím. Jej výsledkom je trvalá chemická zmena kovu, ktorý tým výrazne mení svoje chemické, fyzikálne i mechanické vlastnosti. 2

Rozdelenie korózie • chemická – v elektricky nevodivých prostrediach resp. systémoch – korózia nezahrňujúca elektrochemickú reakciu §oxidácia kovov pri vysokých teplotách §korózia plastov v rôznych prostrediach §korózia kovov v kvapalinách – neelektrolytoch • elektrochemická – v elektricky vodivých prostrediach resp. systémoch elektródovú reakciu §korózia kovov v elektrolytoch, §korózia kovov vo vode, §korózia kovov v pôde, §korózia kovov v atmosfére. – zahŕňa 3

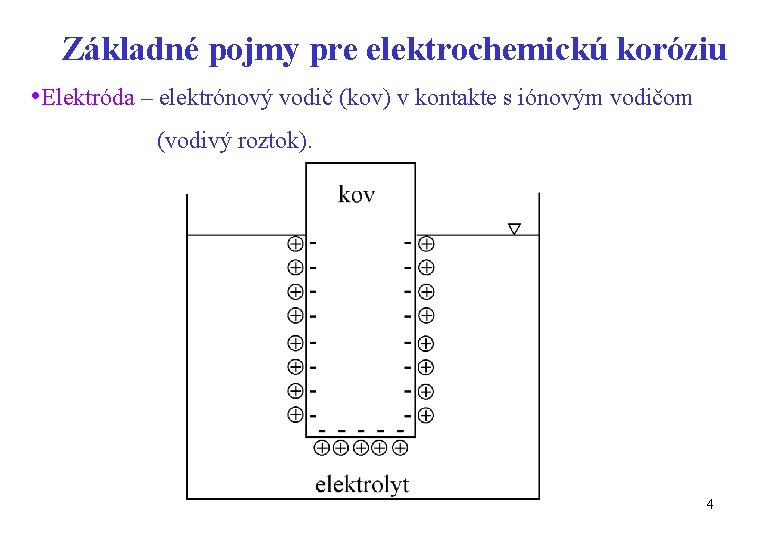
Základné pojmy pre elektrochemickú koróziu • Elektróda – elektrónový vodič (kov) v kontakte s iónovým vodičom (vodivý roztok). 4

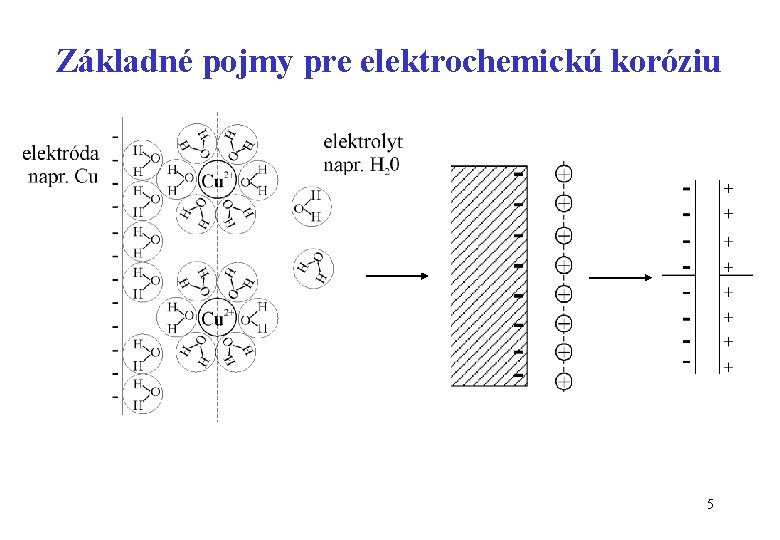
Základné pojmy pre elektrochemickú koróziu 5

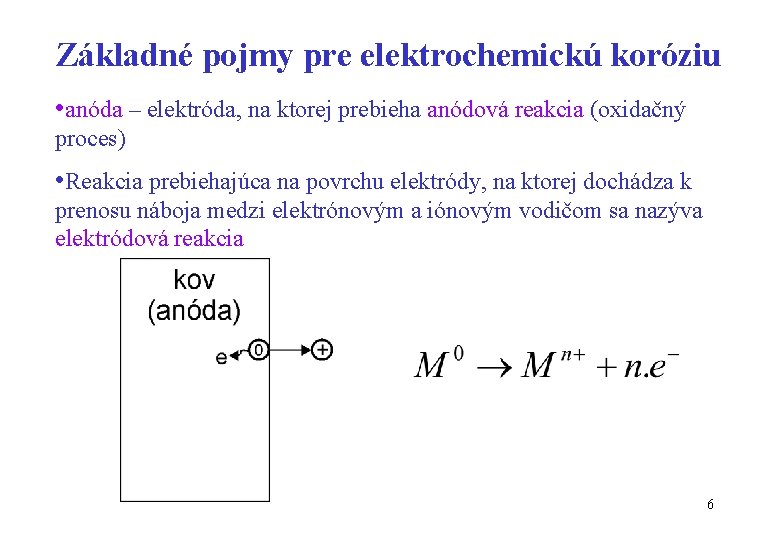
Základné pojmy pre elektrochemickú koróziu • anóda – elektróda, na ktorej prebieha anódová reakcia (oxidačný proces) • Reakcia prebiehajúca na povrchu elektródy, na ktorej dochádza k prenosu náboja medzi elektrónovým a iónovým vodičom sa nazýva elektródová reakcia 6

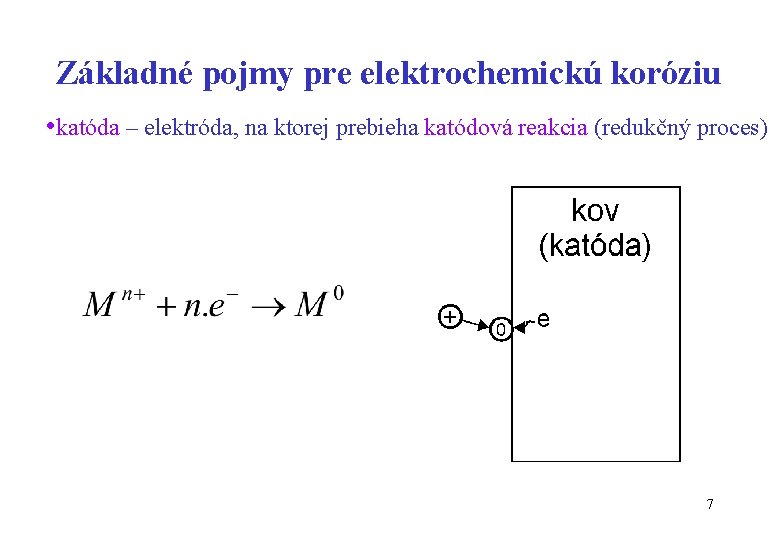
Základné pojmy pre elektrochemickú koróziu • katóda – elektróda, na ktorej prebieha katódová reakcia (redukčný proces) 7

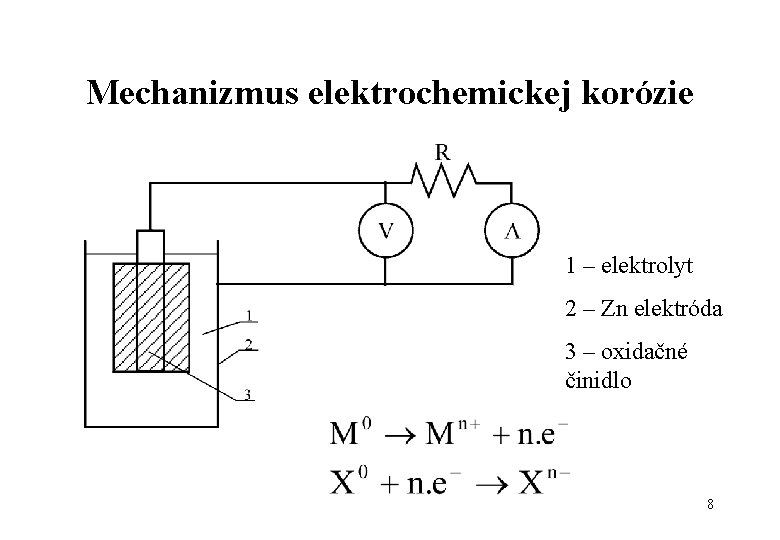
Mechanizmus elektrochemickej korózie 1 – elektrolyt 2 – Zn elektróda 3 – oxidačné činidlo 8

Termodynamika koroze Korozní reakce M 0 … čistý kov / Mn+ … oxidovaný kov X 0 … redukující se látka / Xn- … aniont G 0 … G (stand. podm. ), a. Mn+ / a. Xn- … aktivní konc. oxidující / redukující l. G > 0. . . systém práci přijíma - děj není spontánní G < 0. . . systém práci vykonává - děj probíhá spontánně G = 0. . . systém je ve stavu termodynam. rovnováhy 9

Elektrodový potenciál (U …vnitřní energie) Při (p, T) = konst. , je w = G (w. . . uvolněná energie) Podmínka: A = w elektrická práce A = n. FE E – Er = 0 > 0 oxidace < 0 redukce 10

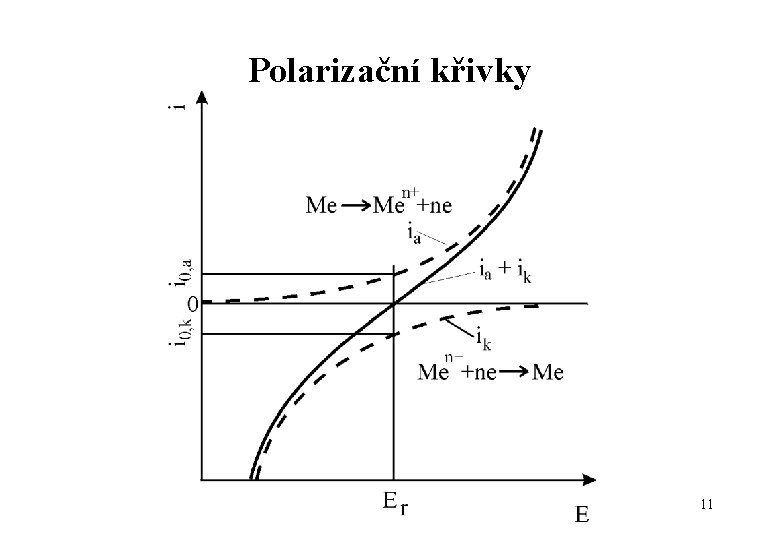
Polarizační křivky 11

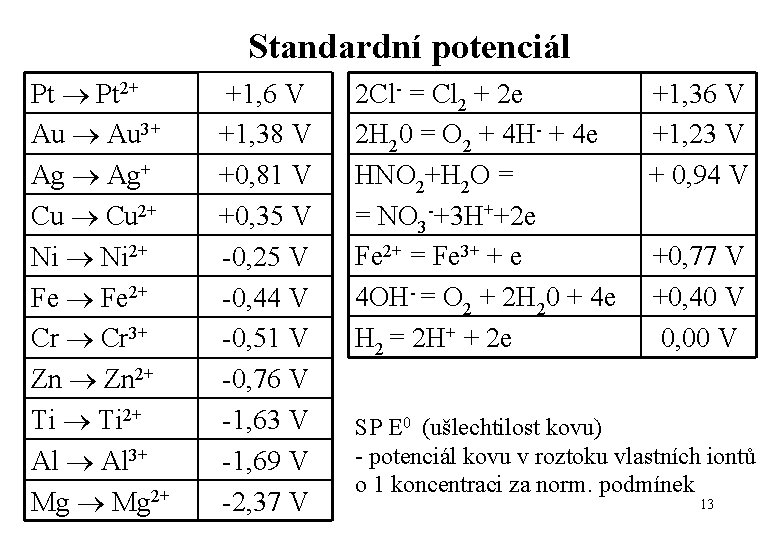
Standardní potenciál Za standardních podmínek a při jednotkové koncentraci Mn+ iónů se logaritmický člen rovná 0 a Er = E 0 12

Standardní potenciál Pt 2+ Au 3+ Ag Ag+ Cu 2+ Ni 2+ Fe 2+ Cr 3+ Zn 2+ Ti 2+ Al 3+ Mg 2+ +1, 6 V +1, 38 V +0, 81 V +0, 35 V -0, 25 V -0, 44 V -0, 51 V -0, 76 V -1, 63 V -1, 69 V -2, 37 V 2 Cl- = Cl 2 + 2 e 2 H 20 = O 2 + 4 H- + 4 e HNO 2+H 2 O = = NO 3 -+3 H++2 e Fe 2+ = Fe 3+ + e 4 OH- = O 2 + 2 H 20 + 4 e H 2 = 2 H+ + 2 e +1, 36 V +1, 23 V + 0, 94 V +0, 77 V +0, 40 V 0, 00 V SP E 0 (ušlechtilost kovu) - potenciál kovu v roztoku vlastních iontů o 1 koncentraci za norm. podmínek 13

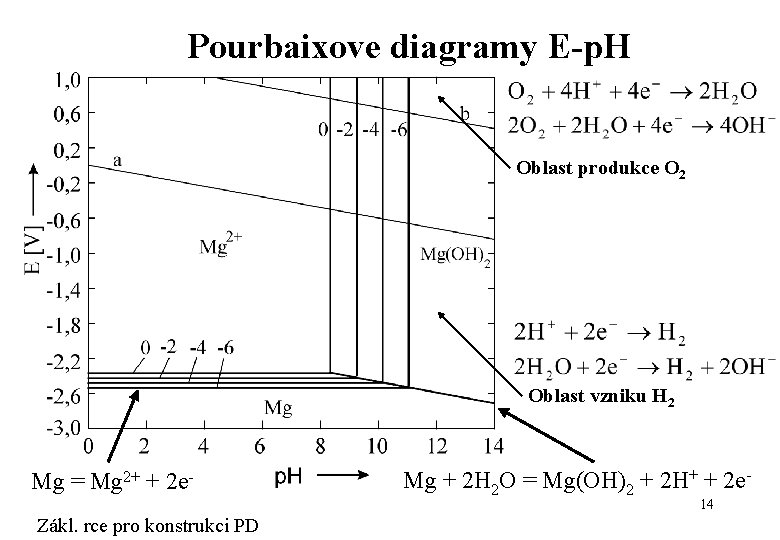
Pourbaixove diagramy E-p. H Oblast produkce O 2 Oblast vzniku H 2 Mg = Mg 2+ + 2 e- Mg + 2 H 2 O = Mg(OH)2 + 2 H+ + 2 e- 14 Zákl. rce pro konstrukci PD

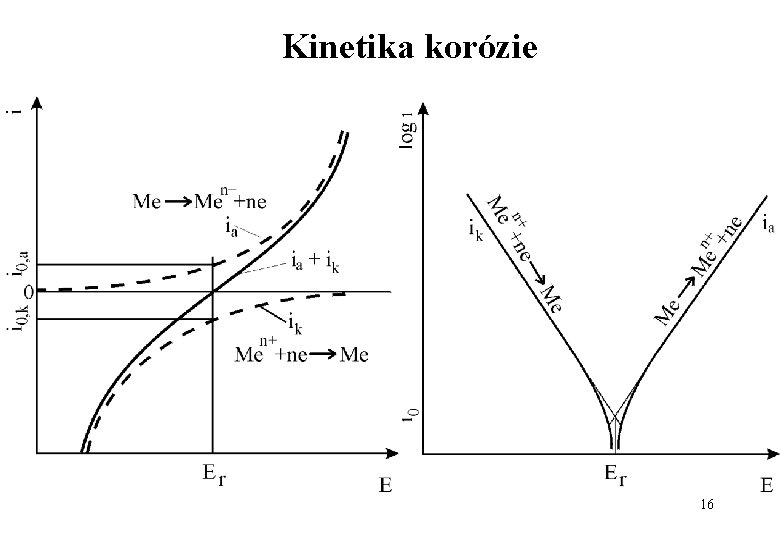
Kinetika korózie Rýchlosť korózie je daná rýchlosťou čiastkových dejov: • transportných (napr. konvekcia, difúzia) (přívod složek, odvod korozních produktů • chemických reakcií (kov x prostředí) Celkovú rýchlosť určuje pomalší z dejov. Množstvo premenenej látky: Rýchlosť korózie: 15

Kinetika korózie 16

Kinetika koroze i 0 = i 0, a = -i 0, k 17

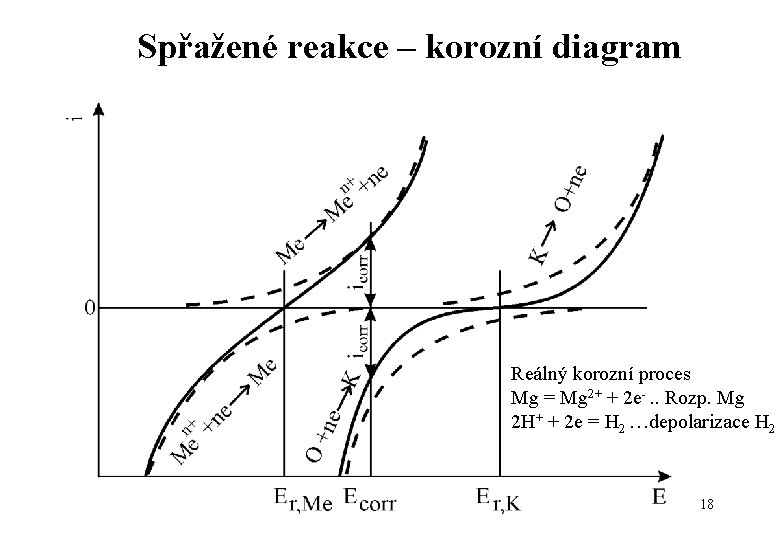
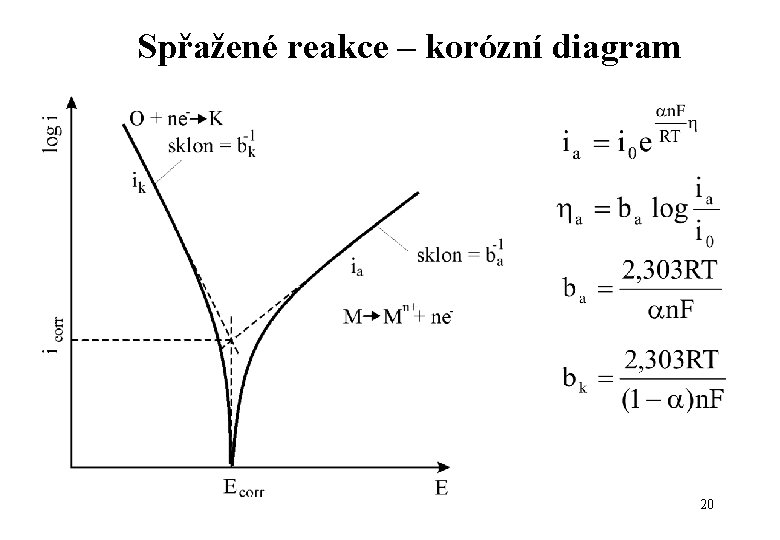
Spřažené reakce – korozní diagram Reálný korozní proces Mg = Mg 2+ + 2 e-. . Rozp. Mg 2 H+ + 2 e = H 2 …depolarizace H 2 18

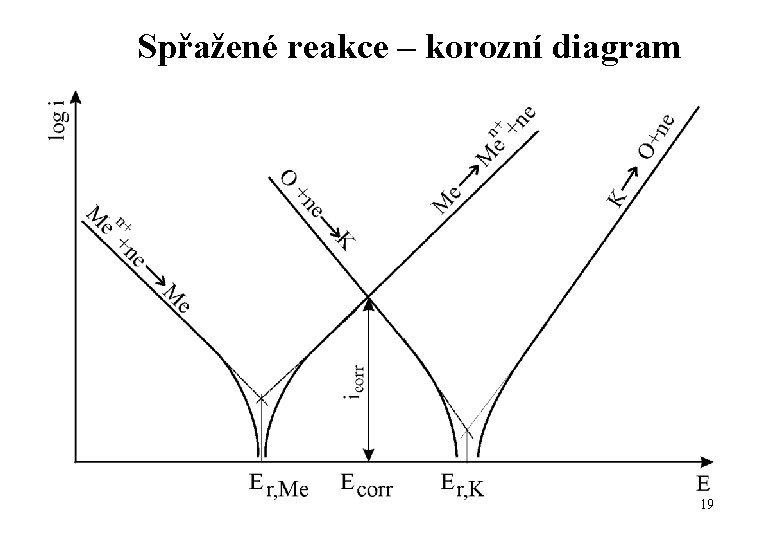
Spřažené reakce – korozní diagram 19

Spřažené reakce – korózní diagram 20

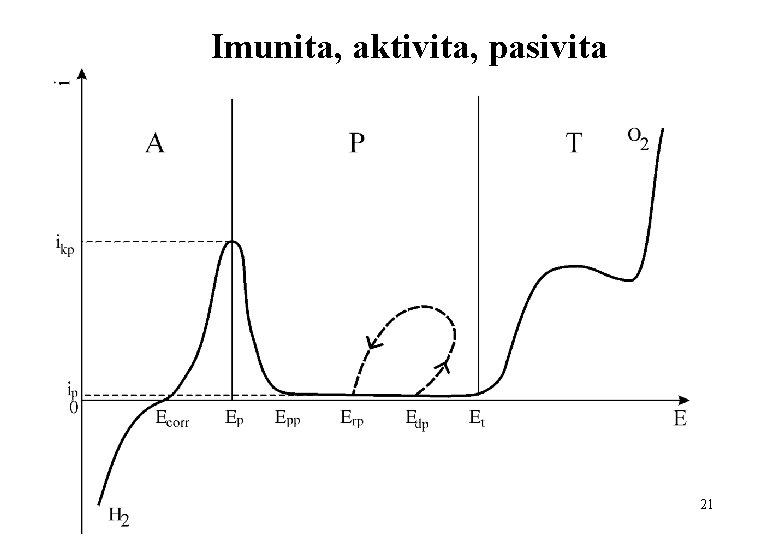
Imunita, aktivita, pasivita 21

Formy koroze Všeobecná koroze Bodová a štěrbinová koroze Interkrystalická koroze Korozní praskání Korozní únava 22

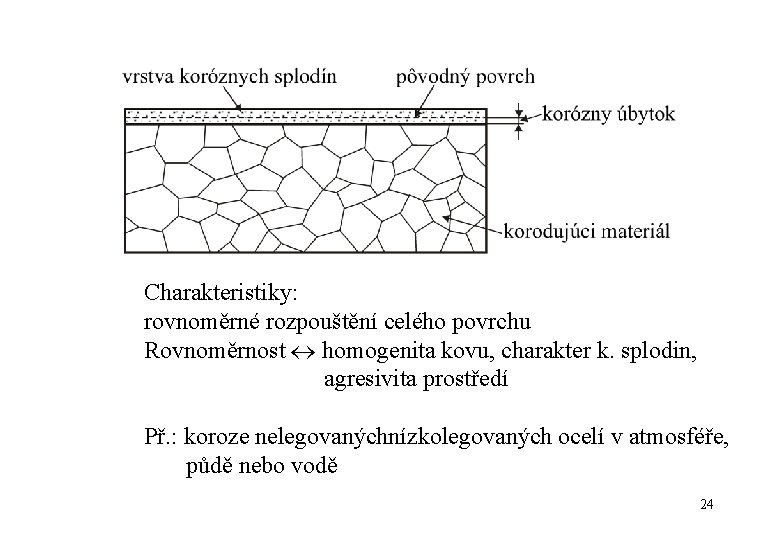
Všeobecná koroze • napadá kovy, které sa nedokáží v daném prostředí pasivovat • postup vš. korózie sa dá vyčíslit hmotnostními úbytky 23

Charakteristiky: rovnoměrné rozpouštění celého povrchu Rovnoměrnost homogenita kovu, charakter k. splodin, agresivita prostředí Př. : koroze nelegovanýchnízkolegovaných ocelí v atmosféře, půdě nebo vodě 24

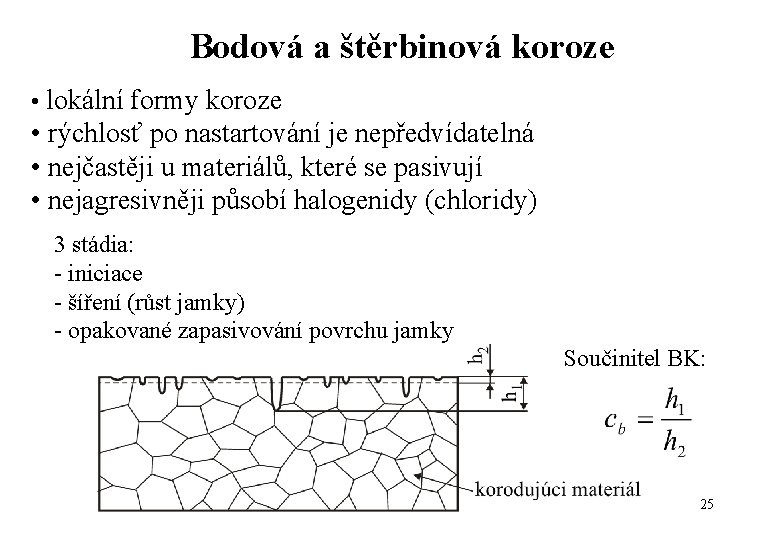
Bodová a štěrbinová koroze • lokální formy koroze • rýchlosť po nastartování je nepředvídatelná • nejčastěji u materiálů, které se pasivují • nejagresivněji působí halogenidy (chloridy) 3 stádia: - iniciace - šíření (růst jamky) - opakované zapasivování povrchu jamky Součinitel BK: 25

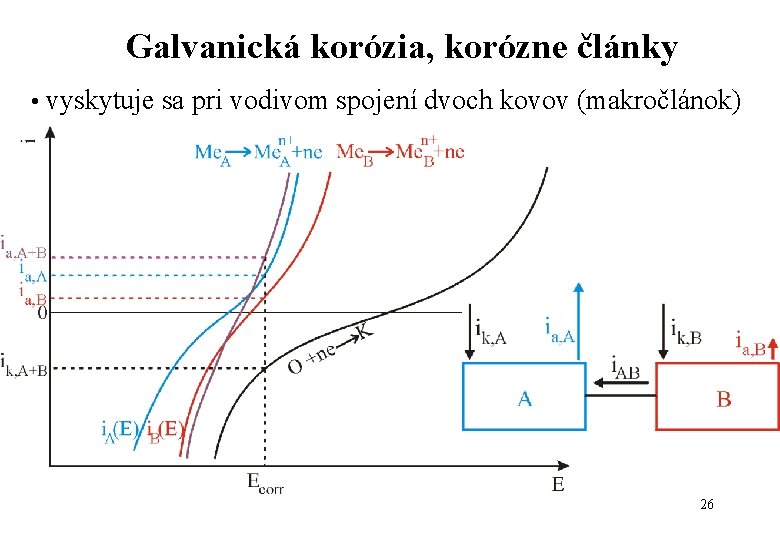
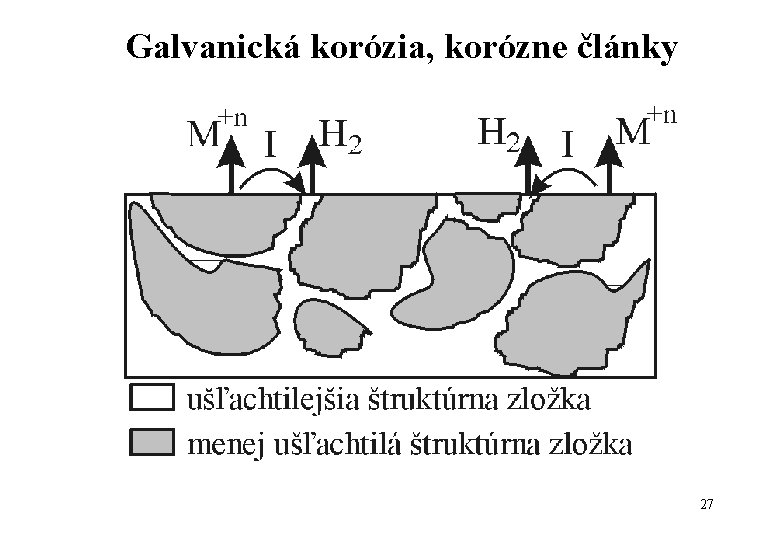
Galvanická korózia, korózne články • vyskytuje sa pri vodivom spojení dvoch kovov (makročlánok) 26

Galvanická korózia, korózne články 27

Mikrobiálna korózia • prostredia s p. H od 4 do 8, 5 a pri teplote 10 až 50°C • stojaté vody, ílovité pôdy s určitou organickou masou • mikroorganizmy Desulfomonas, Sporovibrio, Desulphuricus (p. H 4 -8) redukujú sírany na sulfidy – nie je potrebný kyslík na katódovú reakciu • mikroorganizmy Thiobacillus, Thioxidaus, Thiobacillus ferooxidaus (p. H 0, 5 -8) majú schopnosť oxidovať síru resp. sulfidy až na kyselinu sírovú a Fe 2+ na Fe 3+ • nebezbečné aj z hľadiska rozkladu ochranných organických vrstiev 28

Korozní praskání • vzniká za současného působení korózního prostředía napětí • musí být splněny následující podmínky Ø korozní prostředí, Ø materiál náchylný na praskání, Ø přítomnost složky tahového napětí. Al-Mg, Al-Cu-Mg, Al-Mg-Zn mořská voda Cu-Al, Cu-Zn-Ni, Cu-Sn amoniak uhlíkové ocele horké roztoky dusičnanů, uhličitanů a hydroxidů vysokopevné ocele vodní roztoky s H 2 S austenitické antikorózní oceli horké koncentrované chloridové roztoky, chloridmi znečištěné páry 29

Korózní praskání Vlastnosti: interkrystalické porušení - nehomogenity (segregáty) na GBs transkrystalické porušení - trhlina se šíří po rovinách s nízkými indexy Nukleace na poruchách povrchu Modely lomové mechaniky 30

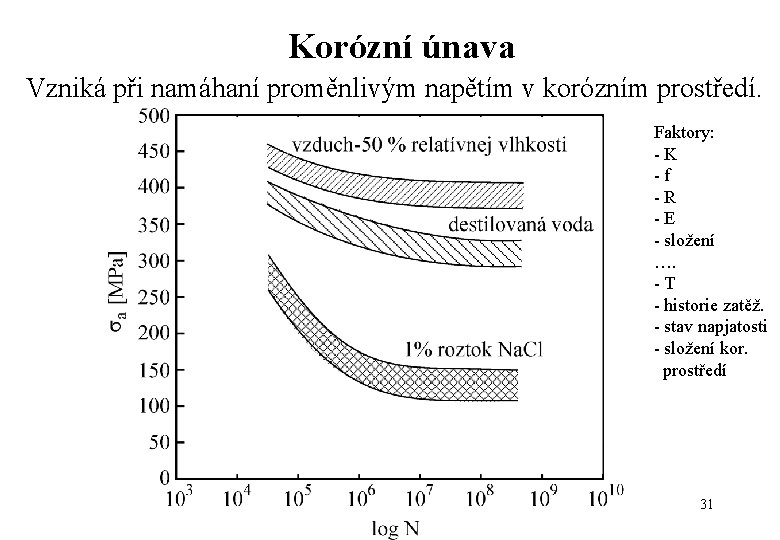
Korózní únava Vzniká při namáhaní proměnlivým napětím v korózním prostředí. Faktory: - K - f - R - E - složení …. - T - historie zatěž. - stav napjatosti - složení kor. prostředí 31

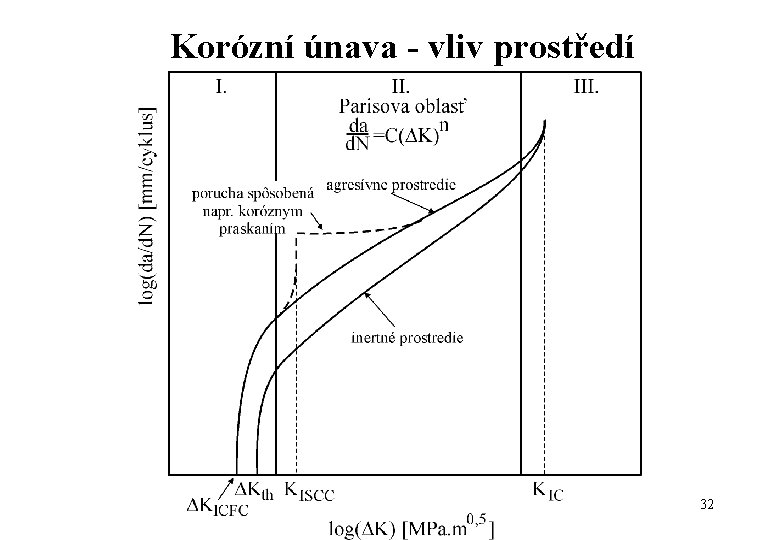
Korózní únava - vliv prostředí 32

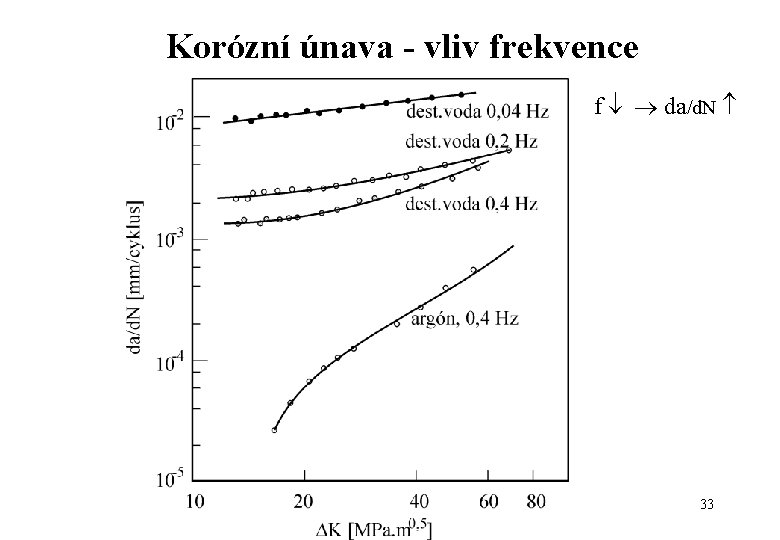
Korózní únava - vliv frekvence f da/d. N 33

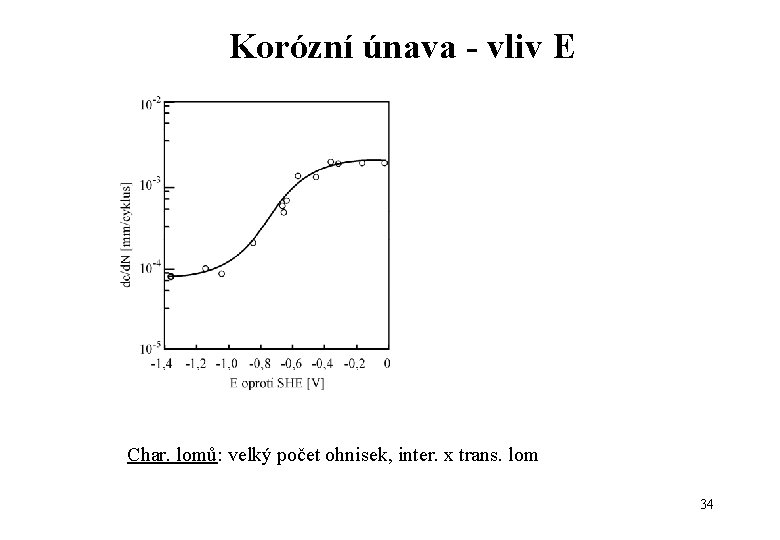
Korózní únava - vliv E Char. lomů: velký počet ohnisek, inter. x trans. lom 34

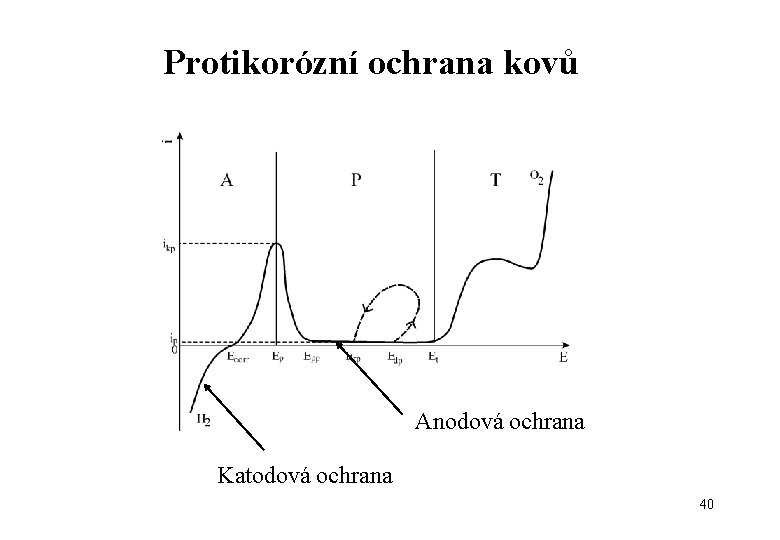
Protikorózní ochrana kovů Cílem protikorozní ochrany kovů a slitin je snížiť rychlost koroze na přijatelnou hodnotu. • ochrana založená na ovlivňování termodynamiky korozních reakcí – např. výběr vhodného materiálu pro dané prostředí, • ochrana založená na ovlivňování kinetiky (rychlosti) korozních reakcí – např. katodová ochrana • bariérová ochrana – např. anodová ochrana 35

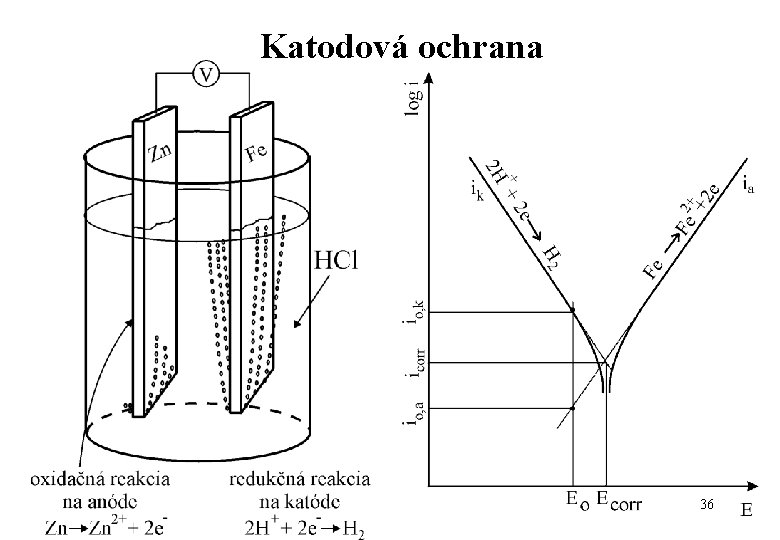
Katodová ochrana 36

Katódová ochrana • ochrana obětovanou anodou (protektor) • eletromotorická síla musí být dostatočně velká, aby chránila co největší plochu • účinný potenciál anody musí být málo ovlivňovaný anodickou polarizací • anoda by sa měla rozpouštět převážne v důsledku produkce ochranného proudu • ekonomicky dostupný materiál • Mg-Al-Zn; Zn s vysokou čistotou; Al-Zn-(Hg, Ti, In) 37

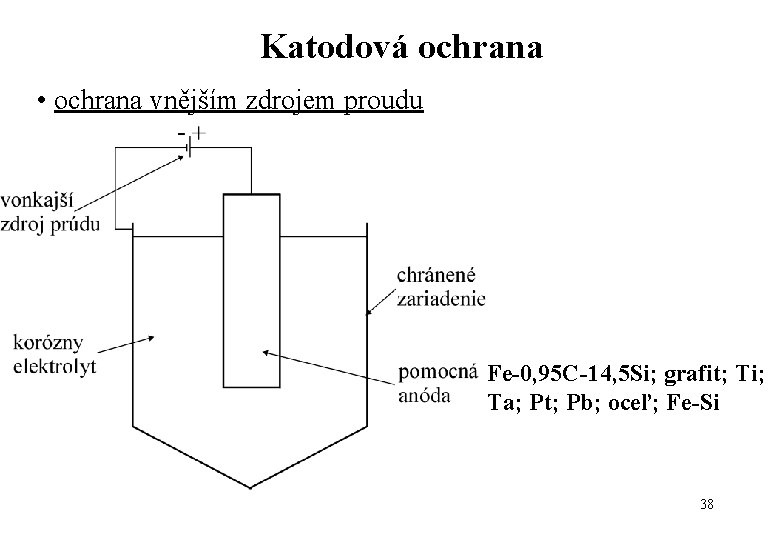
Katodová ochrana • ochrana vnějším zdrojem proudu Fe-0, 95 C-14, 5 Si; grafit; Ti; Ta; Pt; Pb; oceľ; Fe-Si 38

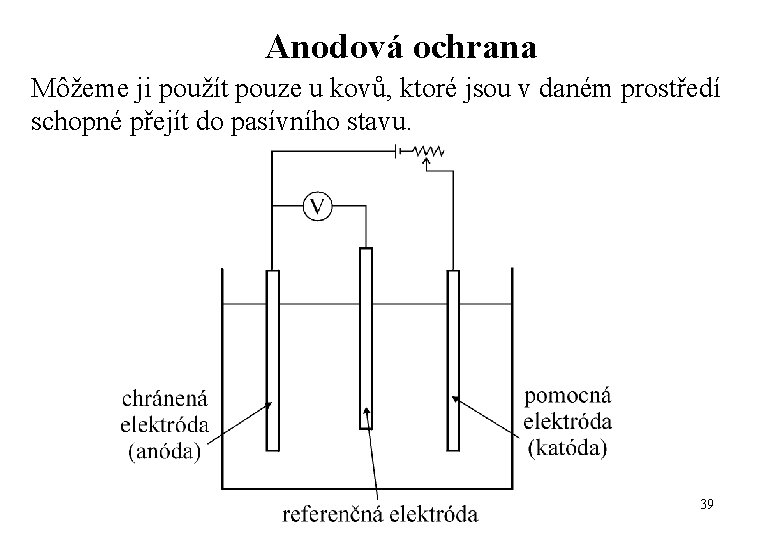
Anodová ochrana Môžeme ji použít pouze u kovů, ktoré jsou v daném prostředí schopné přejít do pasívního stavu. 39

Protikorózní ochrana kovů Anodová ochrana Katodová ochrana 40