Konsep mol Ar Mr massa volume bil avogadro

Konsep mol ( Ar, Mr, massa, volume, bil avogadro, pereaksi pembatas) Irnin Agutsina Dwi Astuti, M. Pd. http: //irnien. wordpress. com

X Menerapkan Hukum Gay Lussac dan Hipotesis Avogadro Apabila diukur pada suhu dan tekanan yang sama, maka perbandingan volume gas yang bereaksi dan hasil reaksi merupakan bilangan bulat dan sederhana (Hk. Guy Lussac) Pada suhu dan tekanan yang sama, maka semua gas yang volumenya sama akan mengandung jumlah molekul yang sama (Hipotesis Avogadro) 2
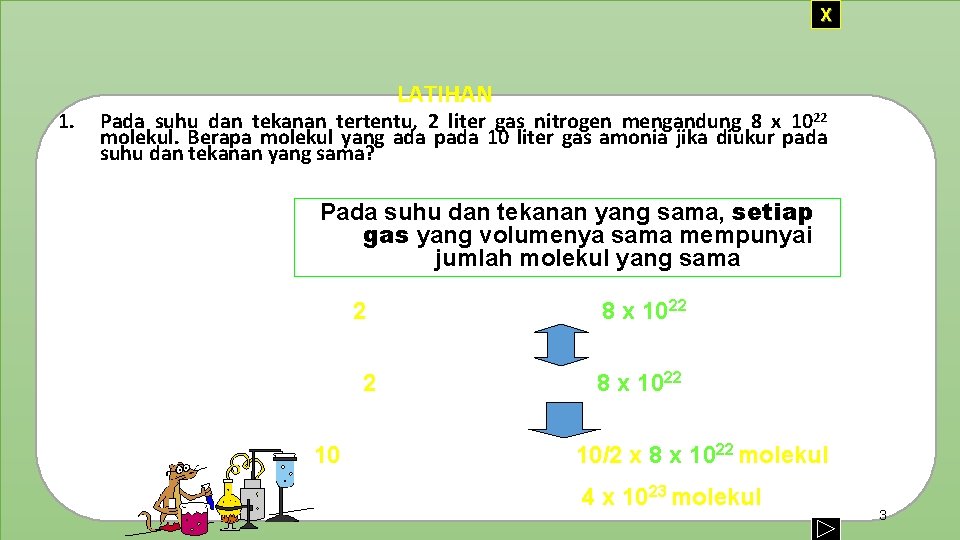
X 1. LATIHAN Pada suhu dan tekanan tertentu, 2 liter gas nitrogen mengandung 8 x 1022 molekul. Berapa molekul yang ada pada 10 liter gas amonia jika diukur pada suhu dan tekanan yang sama? Jawab : Pada suhu dan tekanan yang sama, setiap gas yang volumenya sama mempunyai jumlah molekul yang sama 2 liter gas nitrogen = 8 x 1022 molekul 2 liter gas amonia = 8 x 1022 molekul 10 liter gas amonia = = 10/2 x 8 x 1022 molekul 4 x 1023 molekul 3
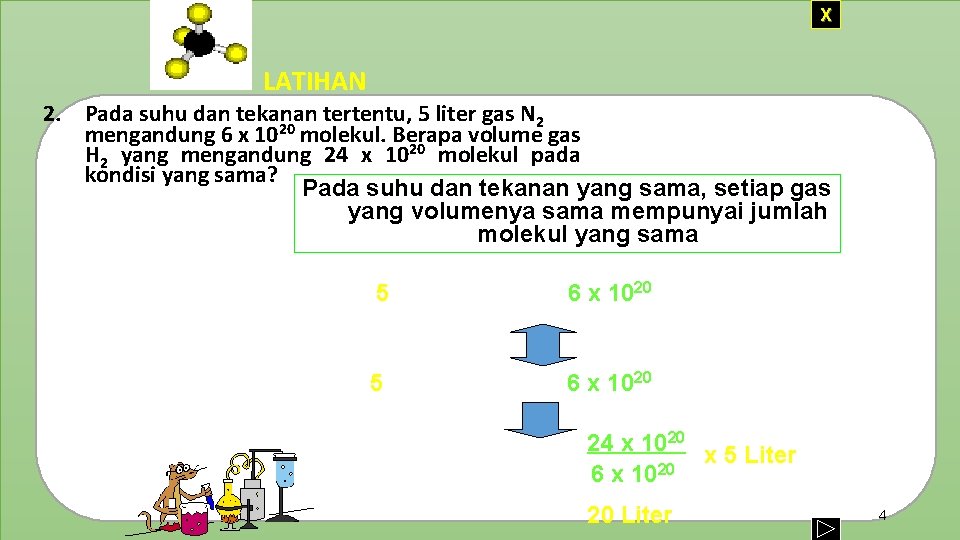
X LATIHAN 2. Pada suhu dan tekanan tertentu, 5 liter gas N 2 mengandung 6 x 1020 molekul. Berapa volume gas H 2 yang mengandung 24 x 1020 molekul pada kondisi yang sama? Pada suhu dan tekanan yang sama, setiap gas Jawab : yang volumenya sama mempunyai jumlah molekul yang sama 5 liter gas N 2 = 6 x 1020 molekul 5 liter gas H 2 = 6 x 1020 molekul 24 x 1020 molekul H 2 = = 24 x 1020 x 5 Liter 6 x 1020 20 Liter 4
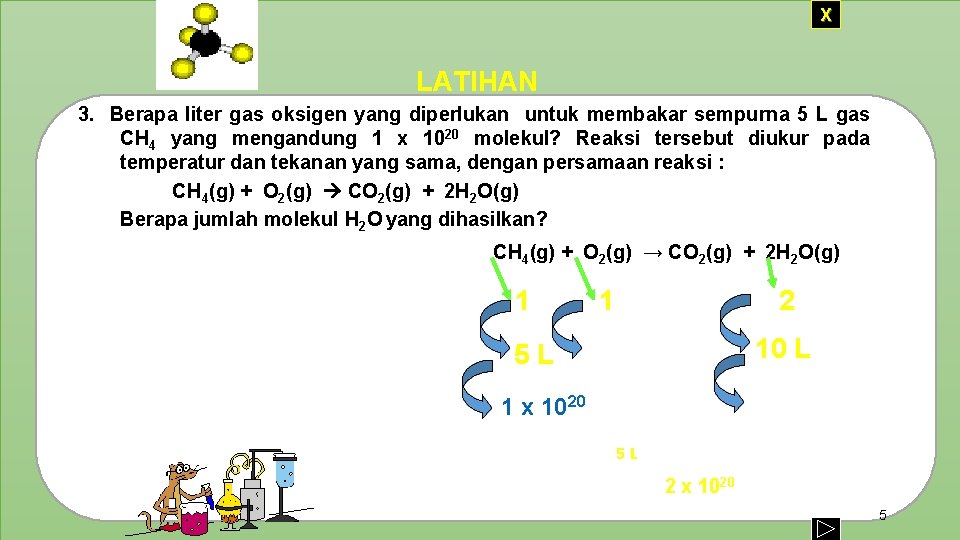
X LATIHAN 3. Berapa liter gas oksigen yang diperlukan untuk membakar sempurna 5 L gas CH 4 yang mengandung 1 x 1020 molekul? Reaksi tersebut diukur pada temperatur dan tekanan yang sama, dengan persamaan reaksi : CH 4(g) + O 2(g) CO 2(g) + 2 H 2 O(g) Berapa jumlah molekul H 2 O yang dihasilkan? Jawab : Persamaan reaksi: CH 4(g) + O 2(g) → CO 2(g) + 2 H 2 O(g) Perb. volume : 1 Volume : 5 L Jml. Molekul : 1 2 5 L 10 L 1 x 1020 2 x 1020 Jadi volume gas oksigen yang diperlukan 5 L Jumlah molekul H 2 O yang dihasilkan 2 x 1020 5
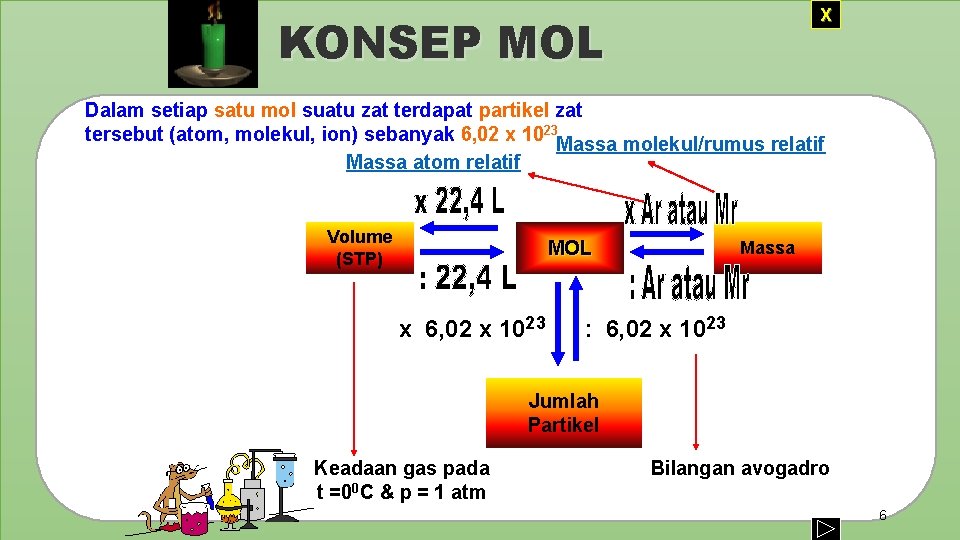
X KONSEP MOL Dalam setiap satu mol suatu zat terdapat partikel zat tersebut (atom, molekul, ion) sebanyak 6, 02 x 1023 Massa molekul/rumus relatif Massa atom relatif Volume (STP) MOL x 6, 02 x 1023 Massa : 6, 02 x 1023 Jumlah Partikel Keadaan gas pada t =00 C & p = 1 atm Bilangan avogadro 6
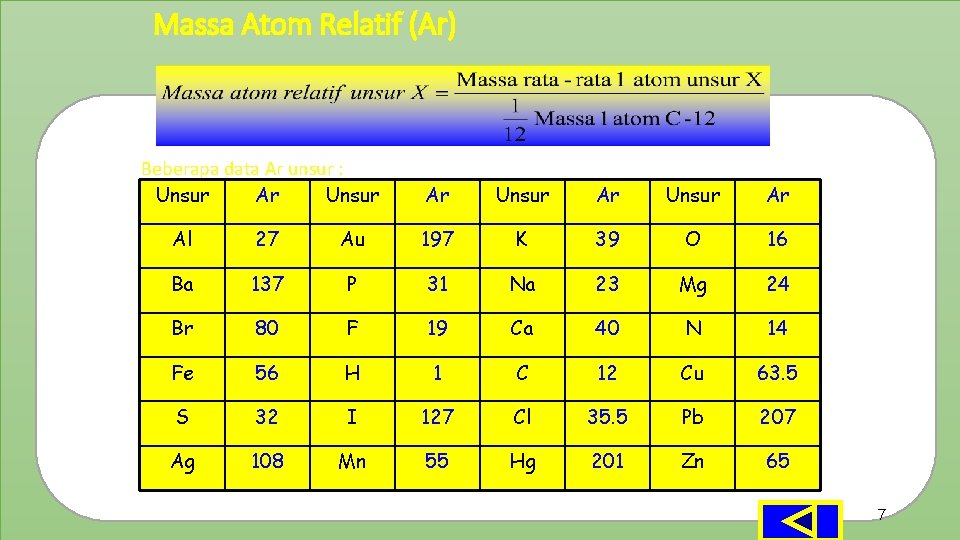
Massa Atom Relatif (Ar) Beberapa data Ar unsur : Unsur Ar Al 27 Au 197 K 39 O 16 Ba 137 P 31 Na 23 Mg 24 Br 80 F 19 Ca 40 N 14 Fe 56 H 1 C 12 Cu 63. 5 S 32 I 127 Cl 35. 5 Pb 207 Ag 108 Mn 55 Hg 201 Zn 65 7

Massa Molekul Relatif (Mr) Massa molekul relatif (Mr) sama dengan jumlah Ar dari semua massa penyusunnya. Mr = Jumlah Ar Atau Mr Senyawa AB = Ar A + Ar B Contoh : Mr C 2 H 5 OH = (2 x Ar C) + (6 x Ar H) + (1 x Ar O) = (2 x 12) + (6 x 1) + (1 x 16) = 46 8
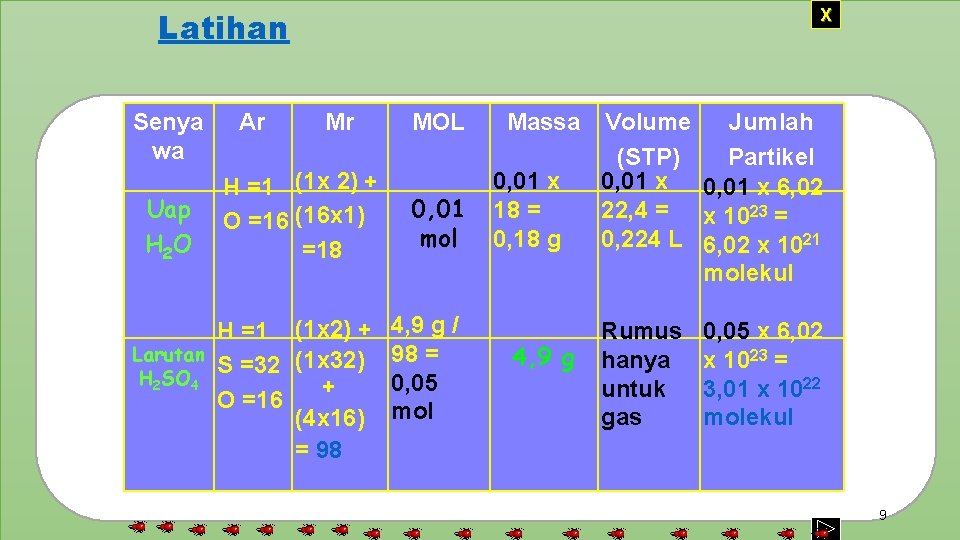
Latihan Senya wa Uap H 2 O Ar X Mr H =1 (1 x 2) + O =16 (16 x 1) =18 H =1 (1 x 2) + Larutan (1 x 32) S =32 H 2 SO 4 + O =16 (4 x 16) = 98 MOL 0, 01 mol 4, 9 g / 98 = 0, 05 mol Massa 0, 01 x 18 = 0, 18 g 4, 9 g Volume Jumlah (STP) Partikel 0, 01 x 6, 02 22, 4 = x 1023 = 0, 224 L 6, 02 x 1021 molekul Rumus hanya untuk gas 0, 05 x 6, 02 x 1023 = 3, 01 x 1022 molekul 9
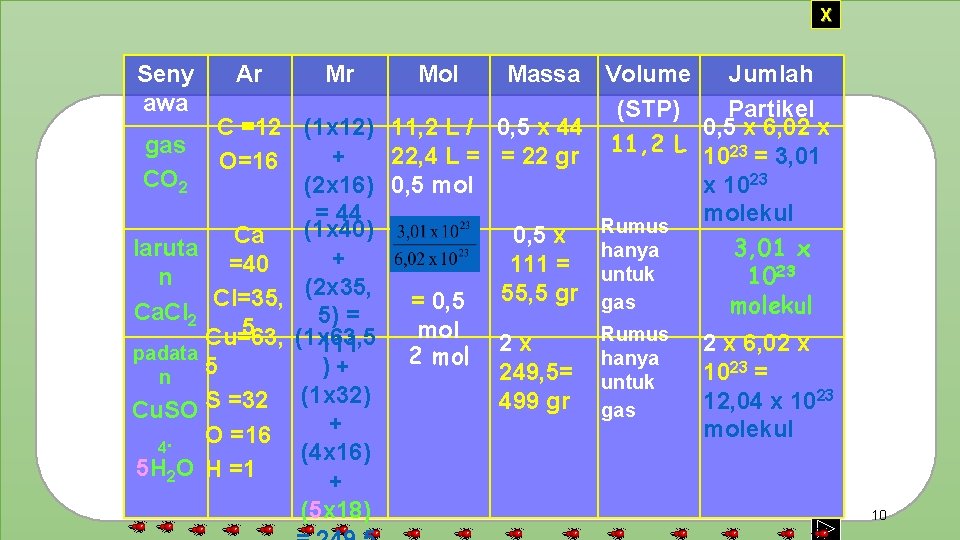
X Seny awa Ar Mr C =12 (1 x 12) gas + O=16 CO 2 (2 x 16) = 44 (1 x 40) Ca laruta + =40 n Cl=35, (2 x 35, Ca. Cl 2 5) = 5 Cu=63, (1 x 63, 5 111 padata 5 )+ n (1 x 32) S =32 Cu. SO + O =16 4. (4 x 16) 5 H 2 O H =1 + (5 x 18) Mol Massa Volume Jumlah (STP) Partikel 11, 2 L / 0, 5 x 44 0, 5 x 6, 02 x 22, 4 L = = 22 gr 11, 2 L 1023 = 3, 01 0, 5 mol x 1023 molekul Rumus 0, 5 x 3, 01 x hanya 111 = untuk 1023 55, 5 gr gas = 0, 5 molekul mol Rumus 2 x 2 x 6, 02 x 2 mol hanya 249, 5= untuk 1023 = 499 gr gas 12, 04 x 1023 molekul 10

X PENENTUAN KADAR ZAT Kadar zat dalam suatu senyawa ditetapkan berdasarkan hasil percobaan analisis kimia. Tetapi jika rumus senyawa dan Ar masing-masing zat penyusun diketahui maka kadar zat penyusun dalam senyawa tersebut dapat dihitung Prosentase zat = % Massa zat = 11
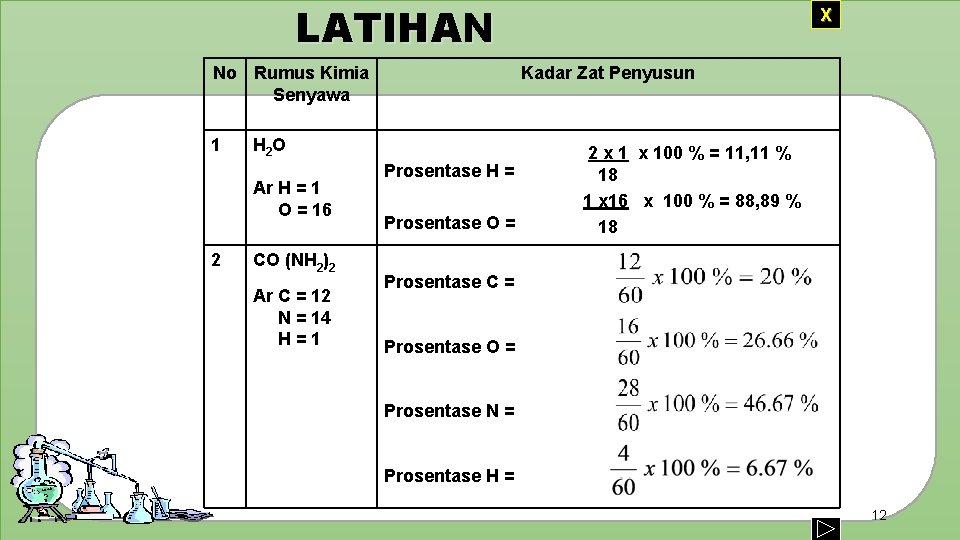
LATIHAN No Rumus Kimia Senyawa 1 2 Kadar Zat Penyusun H 2 O Ar H = 1 O = 16 CO (NH 2)2 Ar C = 12 N = 14 H=1 X Prosentase H = Prosentase O = 2 x 100 % = 11, 11 % 18 1 x 16 x 100 % = 88, 89 % 18 Prosentase C = Prosentase O = Prosentase N = Prosentase H = 12

X 3 Ca. CO 3 2 gram Ar Ca = 40 C = 12 O = 16 Massa Ca = Massa C = Massa O = 4 C 6 H 12 O 6 5 gram Ar C = 12 H=1 O = 16 Massa C = Massa H = Massa O = 13

RUMUS KIMIA X Rumus kimia merupakan simbol dari senyawa kimia yang dinyatakan oleh huruf dan angka, rumus kimia menyatakan jenis atom unsur dan jumlah relatif atom-atom yang terdapat di dalam zat itu Rumus Empiris Rumus empiris menyatakan angka perbandingan bilangan bulat terkecil dari jumlah atom dalam suatu senyawa. Rumus empiris senyawa dapat ditentukan berdasarkan data kadar zat dalam suatu senyawa dan Mr senyawa. Rumus Molekul Rumus molekul menyatakan banyaknya atom suatu unsur yang terdapat dalam satu molekul suatu senyawa. Rumus molekul merupakan kelipatan bulat dari rumus empiris. Air kristal merupakan rumus molekul senyawa garam yang mengikat air. Contoh Cu. SO 4. 5 H 2 O. Rumus air kristal dapat ditentukan berdasarkan data kadar air yang terikat oleh suatu garam. 14

X Contoh rumus molekul : Nama Rumus Molekul Model Molekul Arti Metana CH 4 Tiap molekul metana terdiri atas 1 atom C dan 4 atom H Amoniak NH 3 Tiap molekul amoniak terdiri atas 1 atom N dan 3 atom H Karbon dioksida CO 2 Tiap molekul karbon dioksida terdiri atas 1 atom C dan 2 atom O 15
CH 4 C 6 H 12 O 6 16
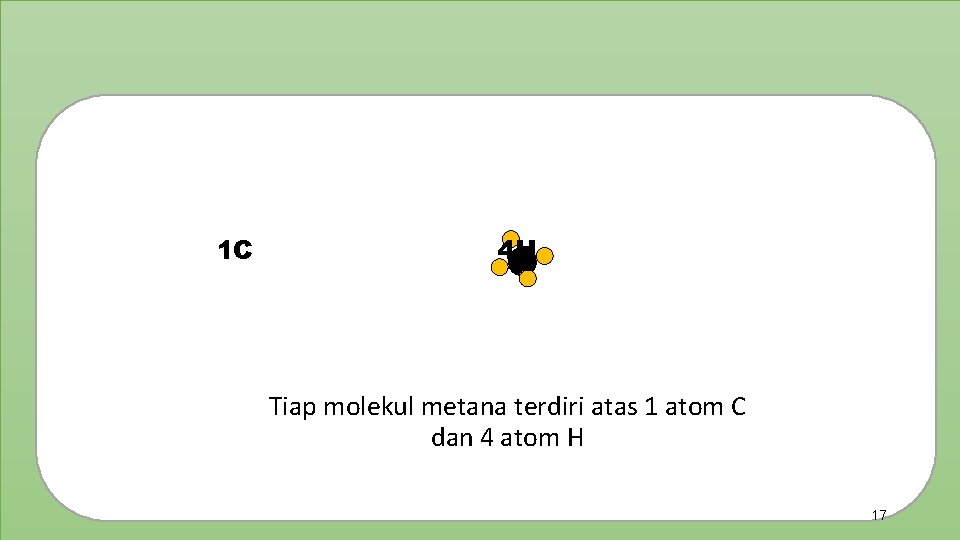
1 C 4 H Tiap molekul metana terdiri atas 1 atom C dan 4 atom H 17
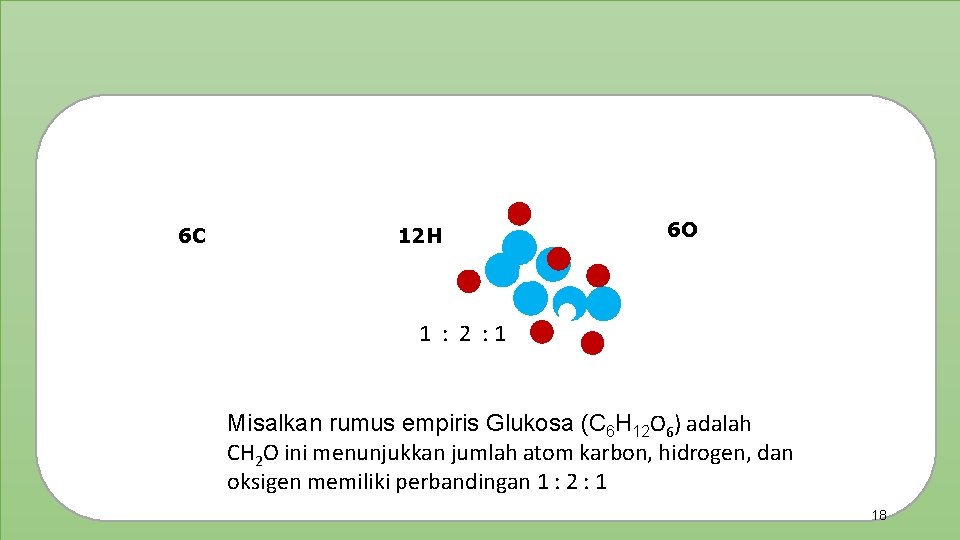
6 C 12 H 6 O 1 : 2 : 1 Misalkan rumus empiris Glukosa (C 6 H 12 O 6) adalah CH 2 O ini menunjukkan jumlah atom karbon, hidrogen, dan oksigen memiliki perbandingan 1 : 2 : 1 18

Hubungan antara rumus molekul dan rumus empiris Nama Rumus Molekul (RM) Rumus Empiris (RE) Perbandingan Atom-Atom pada RE Glukosa C 6 H 12 O 6 CH 2 O C : H : O = 1 : 2 : 1 C 2 H 6 CH 3 C: H=1: 3 KI KI K: I=1: 1 Etana Kalium Iodida X 19
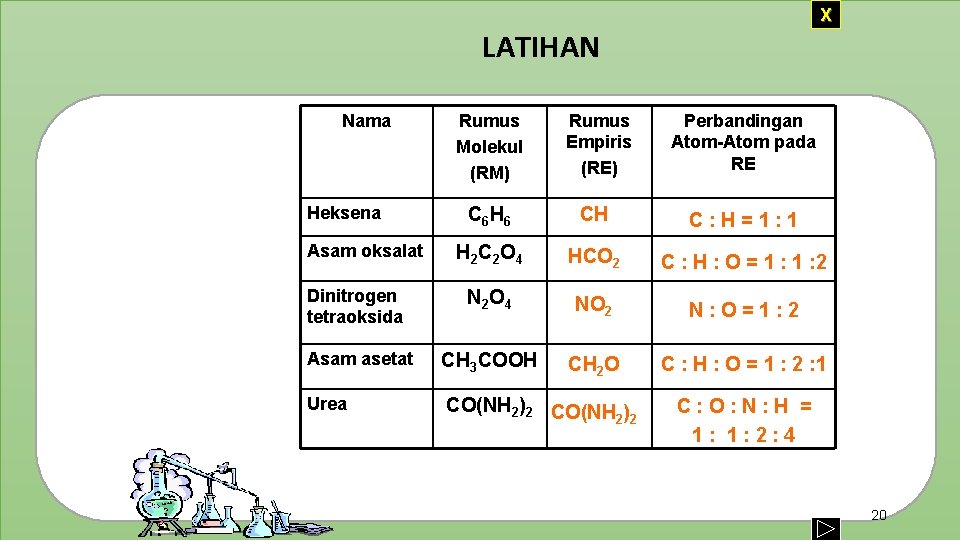
X LATIHAN Nama Rumus Molekul (RM) Rumus Empiris (RE) Perbandingan Atom-Atom pada RE C 6 H 6 CH C: H=1: 1 H 2 C 2 O 4 HCO 2 C : H : O = 1 : 2 Dinitrogen tetraoksida N 2 O 4 NO 2 N: O=1: 2 Asam asetat CH 3 COOH CH 2 O C : H : O = 1 : 2 : 1 Urea CO(NH 2)2 CO(NH ) 2 2 Heksena Asam oksalat C: O: N: H = 1: 1: 2: 4 20

X CONTOH 1. Hasil analisis kimia yang dilakukan terhadap senyawa hidrazin ( Mr = 32) ditemukan bahwa senyawa tersebut terdiri atas 87, 42 % massa N dan 12, 48 % massa H. Tentukan rumus empiris dan rumus molekul senyawa hidrazin. Jawab perbandingan jumlah atom = perbandingan mol Mol atom N = 87, 42 = 6, 24 mol Ar N 14 Mol atom H = 12, 48 mol Ar H 1 Perbandingan mol N : mol H = 6, 24 : 12, 48 = 1 : 2 Perbandingan jumlah atom N : H = 1 : 2 Rumus empiris hidrazin = NH 2 Rumus molekul hidrazin = (NH 2)n Mr hidrazin = n x Ar N + n x 2 x Ar H 32 = 14 n + 2 n n =2 Jadi rumus molekul hidrazin = (NH 2)2 = N 2 H 4 21

X 3. Seorang siswa memanaskan kristal tembaga (II) sulfat (Cu. SO 4. x. H 2 O) sebanyak 4, 98 gram. Massa senyawa tersebut setelah airnya terlepas adalah 3, 18 gram. Tentukan rumus air kristal tersebut. Jawab : Massa Cu. SO 4 = 3, 18 gram Massa Air Mol Cu. SO 4 Mol Air = (4, 98 – 3, 18) gram = 1, 8 gram = 3, 18/159, 5 = 0, 02 mol = 1, 8 / 18 = 0, 1 mol Perbandingan mol Cu. SO 4 : mol H 2 O = 0, 02 : 0, 1 = 1 : 5 Perbandingan jumlah Cu. SO 4 : jumlah H 2 O = 1 : 5 Rumus air kristal : Cu. SO 4. 5 H 2 O 22

X PERHITUNGAN BERDASAR PERSAMAAN REAKSI Koefisien-koefisien dalam suatu persamaan reaksi merupakan angka banding antara mol pereaksi dengan mol hasil reaksi 23
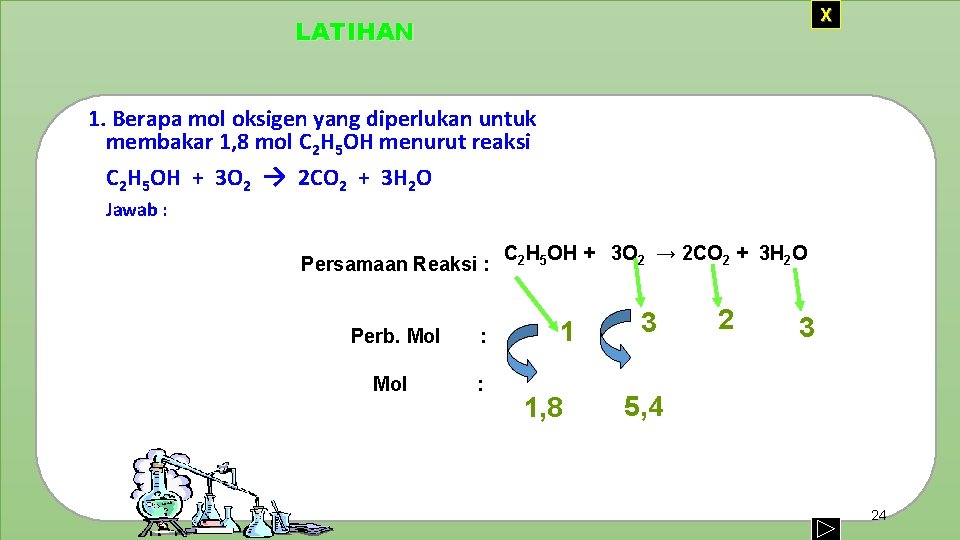
X LATIHAN 1. Berapa mol oksigen yang diperlukan untuk membakar 1, 8 mol C 2 H 5 OH menurut reaksi C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O Jawab : Persamaan Reaksi : Perb. Mol : C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O 1 1, 8 3 2 3 5, 4 24

X 2. Berapa mol karbon dioksida dan uap air yang dihasilkan bila 1, 8 mol C 2 H 5 OH dibakar menurut reaksi C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O Jawab : Persamaan Reaksi : C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O Perb. Mol : 1, 8 3 2 3 3, 6 5, 4 25
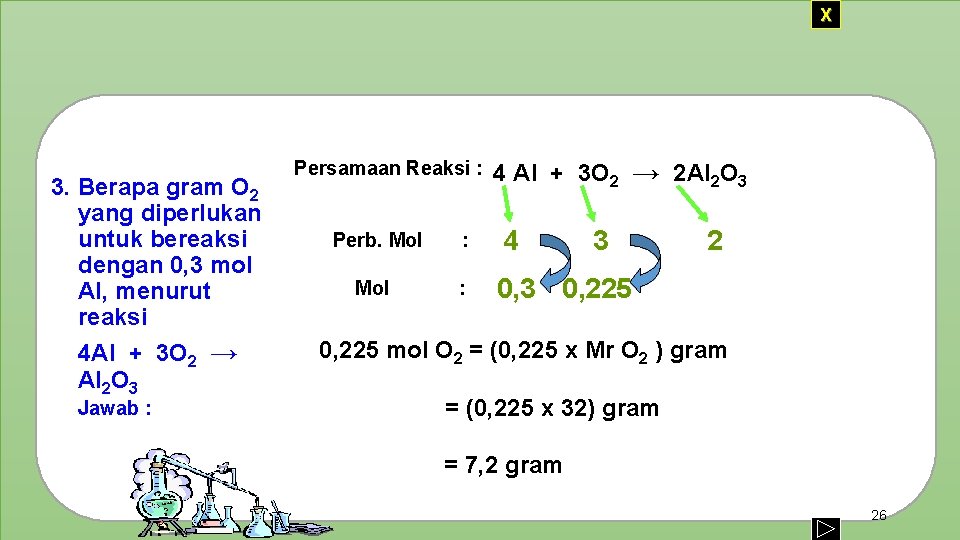
X 3. Berapa gram O 2 yang diperlukan untuk bereaksi dengan 0, 3 mol Al, menurut reaksi 4 Al + 3 O 2 → Al 2 O 3 Jawab : Persamaan Reaksi : Perb. Mol : 4 Al + 3 O 2 → 2 Al 2 O 3 4 3 2 0, 3 0, 225 mol O 2 = (0, 225 x Mr O 2 ) gram = (0, 225 x 32) gram = 7, 2 gram 26

X PENENTUAN PEREAKSI PEMBATAS Dalam reaksi kimia, pereaksi tidak selalu dicampurkan dalam perbandingan yang tepat sehingga semua pereaksi habis bereaksi Sering terjadi kondisi dimana salah satu pereaksi dalam keadaan berlebih Sehingga salah satu pereaksi sudah habis bereaksi sementara pereaksi lain masih bersisa Pereaksi yang duluan habis bereaksi disebut pereaksi pembatas 27
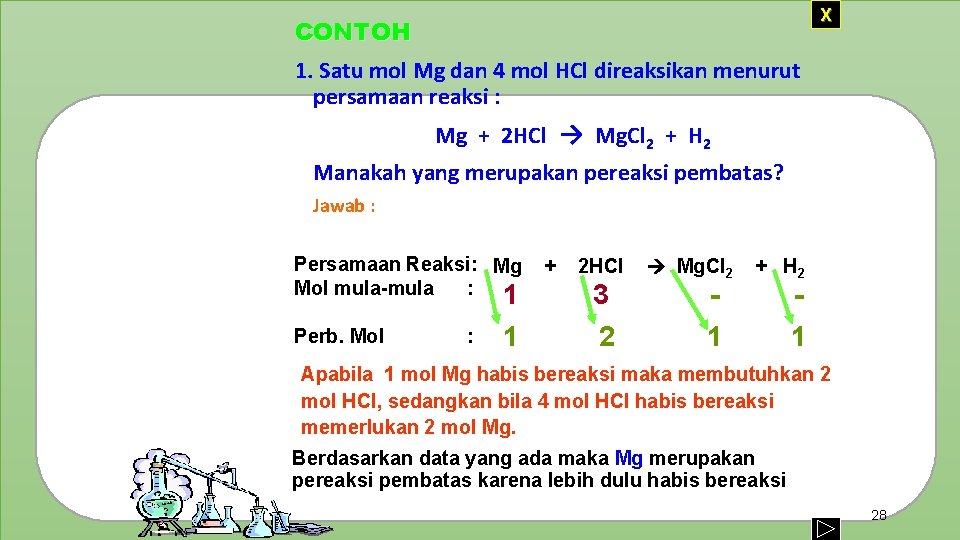
X CONTOH 1. Satu mol Mg dan 4 mol HCl direaksikan menurut persamaan reaksi : Mg + 2 HCl → Mg. Cl 2 + H 2 Manakah yang merupakan pereaksi pembatas? Jawab : Persamaan Reaksi: Mg Mol mula-mula : 1 Perb. Mol : 1 + 2 HCl 3 2 Mg. Cl 2 1 + H 2 1 Apabila 1 mol Mg habis bereaksi maka membutuhkan 2 mol HCl, sedangkan bila 4 mol HCl habis bereaksi memerlukan 2 mol Mg. Berdasarkan data yang ada maka Mg merupakan pereaksi pembatas karena lebih dulu habis bereaksi 28

X 2. 0, 5 mol O 2 bereaksi dengan 0, 3 mol Al, menurut persamaan reaksi : 4 Al + 3 O 2 → 2 Al 2 O 3 Tentukan manakah yang merupakan pereaksi pembatas? Jawab : Persamaan Reaksi: Mol mula-mula : Perb. Mol : 4 Al 0, 3 4 + 3 O 2 0, 5 3 2 Al 2 O 3 2 Apabila 0, 3 mol Al habis bereaksi maka membutuhkan 0, 225 mol O 2, sedangkan bila 0, 5 mol O 2 habis bereaksi memerlukan 0, 67 mol Al. Berdasarkan data yang ada maka Al merupakan pereaksi pembatas karena lebih dulu habis bereaksi 29
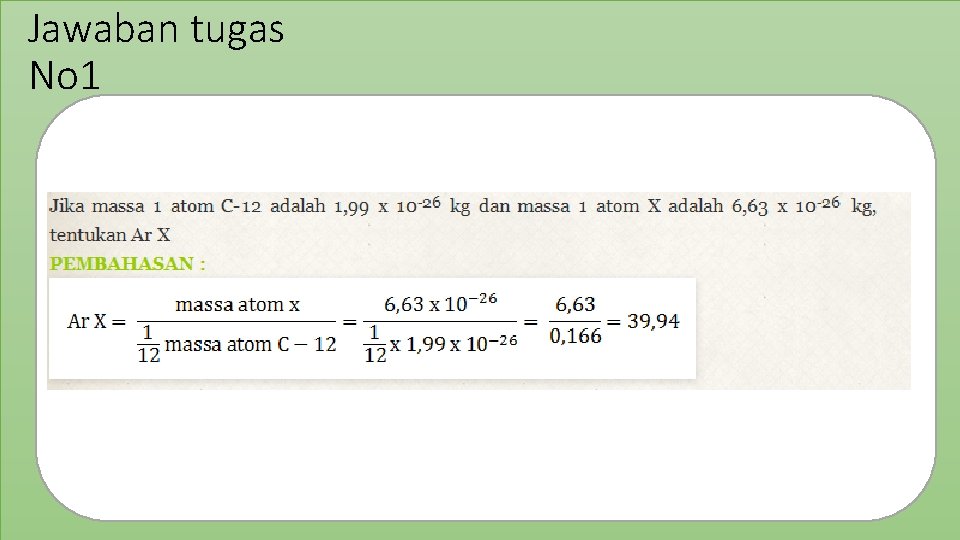
Jawaban tugas No 1
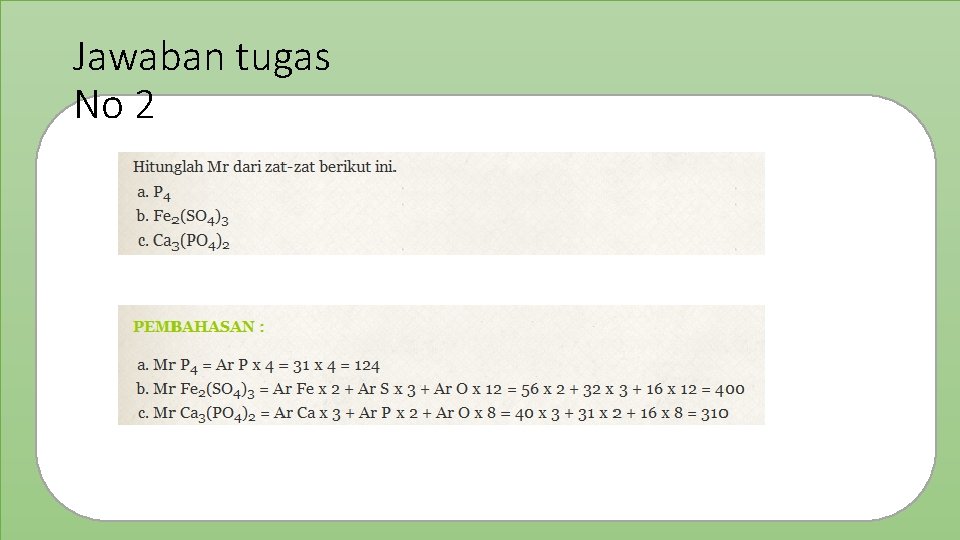
Jawaban tugas No 2

Jawaban tugas No 3

Jawaban tugas No 4

Jawaban tugas No 5

Jawaban tugas No 6

Jawaban tugas No 7 Suatu senyawa memiliki rumus empiris CH 3. Jika Mr senyawa tersebut adalah 30, tentukanlah rumus molekul dari senyawa tersebut!

Jawaban tugas No 8
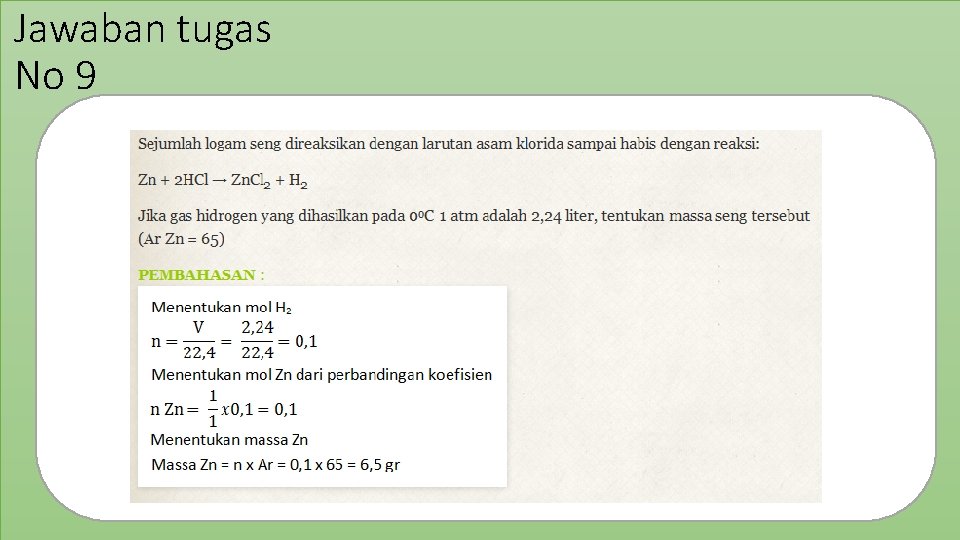
Jawaban tugas No 9
- Slides: 38