KONFIGURASI ELEKTRON WIDYA HILALIA ISWARA EXO L KOMPETENSI















- Slides: 16

KONFIGURASI ELEKTRON WIDYA HILALIA ISWARA EXO L

KOMPETENSI DASAR Menentukan letak suatu unsur dalam tabel periodik berdasarkan konfigurasi elektron.

INDIKATOR Menghubungkan konfigurasi elektron suatu unsur dengan letaknya dalam sistem periodik

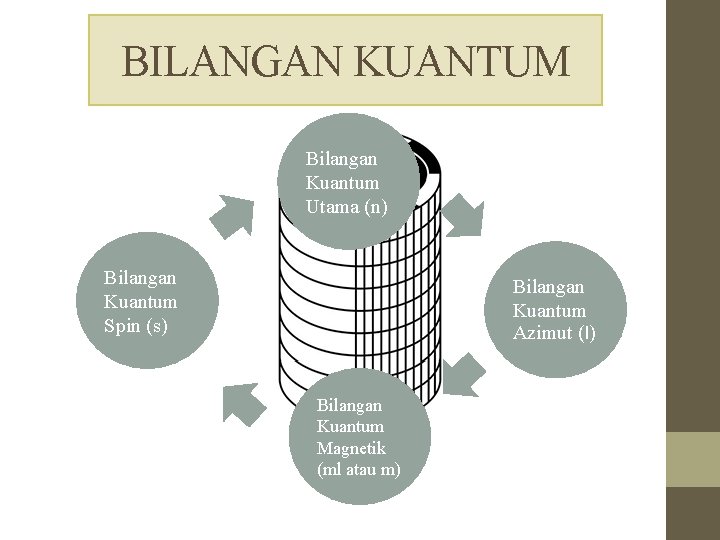
BILANGAN KUANTUM Bilangan Kuantum Utama (n) Bilangan Kuantum Spin (s) Bilangan Kuantum Azimut (l) Bilangan Kuantum Magnetik (ml atau m)

BILANGAN KUANTUM UTAMA (n) • Bilangan kuantum utama menyatakan kulit utama atau tingkat energi tempat orbital berada. • Nilai bilangan kuantum utama (n) bulat dan berharga positif, yaitu 1, 2, 3, 4, . . . sampai tidak terhingga. • n = 1 untuk kulit K n = 2 untuk kulit L n = 3 untuk kulit M n = 4 untuk kulit N dan seterusnya.

BILANGAN KUANTUM AZIMUT (l) • Bilangan kuantum azimut menyatakan subkulit tempat elektron berada serta menunjukkan bentuk orbital suatu elektron.

BILANGAN KUANTUM MAGNETIK(ml atau m) • Bilangan kuantum magnetik menyatakan orbital-orbital yang menyusun subkulit. Nilai setiap subkulit l mempunyai harga m dimulai dari –l sampai +l.

BILANGAN KUANTUM SPIN (s) • Bilangan kuantum spin menyatakan arah perputaran elektron pada sumbunya. Nilai positif atau negatif dari spin menyatakan spin atau rotasi partikel pada sumbu. • Contoh : • Perputaran elektron yang searah jarum jam harga s-nya = +1⁄2 • Perputaran elektron berlawanan arah jarum jam harga s-nya = -1⁄2.

ASAS AUFBAU • Menurut asas Auf. Bau, ‘’pengisian elektron dimulai dari subkulit yang berenergi paling rendah dilanjutkan pada subkulit yang lebih tinggi energinya’’. • Sehingga susunan konfigurasi elektronnya menjadi : 1 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 4 f, 5 d, 6 p, 7 s, 5 f, 6 d, 7 p.

KAIDAH HUND • Dalam kaidah Hund, dikemukakan oleh Friedrich Hund bahwa pada pengisian orbital-orbital yang berenergi sama maka elektron - elektron akan menempati orbital secara sendiri-sendiri dengan spin yang paralel kemudian baru berpasangan. Elektron – elektron baru berpasangan apabila pada subkulit itu sudah tidak ada lagi orbital kosong. • Contoh pengisian yang benar : Orbital p (2 elektron) orbital p (3 elektron) orbital p ( 4 elektron) orbital p (5 elektron)

LARANGAN PAULI • Larangan Pauli menjelaskan suatu orbital maksimum hanya dapat ditempati dua elektron yang arah spinnya berlawanan. Subkulit s mempunyai 1 orbital, elektron maksimumnya 2. Jadi, setiap orbital hanya dapat berisi 2 elektron dengan spin yang berpasangan. • S P

• Subkulit elektron. s ( 1 orbital ) maksimum 2 p ( 3 orbital ) maksimum 6 d ( 5 orbital ) maksimum 10 f ( 7 orbital ) maksimum 14

CONTOH 1. Tentukan konfigurasi elektron dan jumlah elektron yang tidak berpasangan untuk atom unsur berikut : a. Ni (Z = 28 ) b. Sr (Z = 38 ) Jawab : a. Ni (Z = 28 ) : 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 8 n= 1 l=0 4 s 2 m=0 s=-½ 3 d 8 n=3 l =2 m = -2, -1, 0, +1, +2 s =-½

b. Sr (Z = 38) : 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 n=1 l=0 m=0 s=-½ 4 p 6 n=2 l=1 m = -1, 0, +1 s =-½

PENENTUAN PERIODE DAN GOLONGAN SUATU UNSUR • Periode suatu unsur sama dengan nomor kulit terbesarnya dalam konfigurasi elektron, minsalnya : Cr (Z = 24 ) : 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 5 Nomor kulit terbesarnya adalah 4 (dalam 4 s 1) maka Cr terletak dalam periode 4. • Penentuna golongan dapat dilihat dari tabel berikut :

TERIMA KASIH
 54xe konfigurasi elektron
54xe konfigurasi elektron Konfigurasi elektron
Konfigurasi elektron Konfigurasi elektron kalsium
Konfigurasi elektron kalsium Letak elektron dalam atom
Letak elektron dalam atom Konfigurasi elektron unsur transisi periode 4
Konfigurasi elektron unsur transisi periode 4 Konfigurasi elektron
Konfigurasi elektron Konfigurasi elektron v
Konfigurasi elektron v Penempatan elektron
Penempatan elektron Konfigurasi elektron dari unsur 31p15 dengan notasi adalah
Konfigurasi elektron dari unsur 31p15 dengan notasi adalah Koordinat umum
Koordinat umum Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Standar kompetensi dan kompetensi dasar mata pelajaran ips
Standar kompetensi dan kompetensi dasar mata pelajaran ips Pertanyaan tentang kompetensi inti dan kompetensi dasar
Pertanyaan tentang kompetensi inti dan kompetensi dasar Hubungan kompetensi inti kompetensi dasar dan indikator
Hubungan kompetensi inti kompetensi dasar dan indikator Kompetensi inti dan kompetensi dasar
Kompetensi inti dan kompetensi dasar Jenis kompetensi berdasarkan strata kompetensi
Jenis kompetensi berdasarkan strata kompetensi Pola ilmiah pokok universitas indonesia
Pola ilmiah pokok universitas indonesia