Komplement truktra a funkcia komplementu Aktivcia a regulcia









- Slides: 27

Komplement Štruktúra a funkcia komplementu. Aktivácia a regulácia. Metódy stanovenia

História komplementu • objavený v 1893 Julesom Bordetom a nazvaný „alexín“ • v 1899 ho Paul Ehrlich premenoval na komplement (kompletizuje funkciu protilátok) • netvorí ho jedna látka ale komplex rôznych molekúl

Nomenklatúra • zložky komplementu sa označujú písmenom C + číslo v poradí, v akom boli objavené • C 1 má 3 podjednotky (C 1 q, 2 x. C 1 r a 2 x. C 1 s) • fragmenty proteolytického štiepenia zložiek sa označujú „a“ (menší fragment) a „b“ (väčší fragment) – výnimka C 2 • ďalšia degradácia fragmentu b sa označuje c, d, . . . • zložky komplementu resp. komplex zložiek označené nad svojím názvom vodorovnou čiarou majú enzýmovú aktivitu (napr. C 4 b 2 b) • zložky označené ako faktory (faktor B, D, P, H, I) patria k alternatívnej ceste aktivácie alebo k regulačným proteínom • fragment so stratenou biologickou aktivitou sa označuje na začiatku „i“ (napr. i. C 3 b) • niektoré zložky majú označenie podľa funkcie (MBP, . . . )

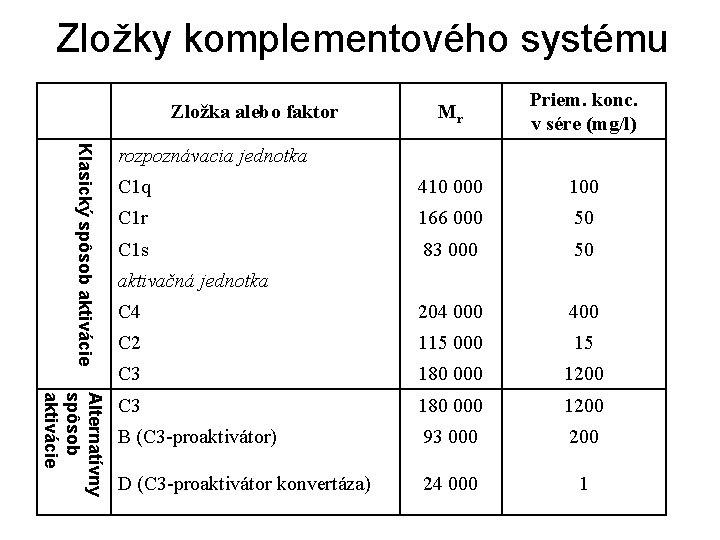
Zložky komplementového systému Mr Priem. konc. v sére (mg/l) C 1 q 410 000 100 C 1 r 166 000 50 C 1 s 83 000 50 C 4 204 000 400 C 2 115 000 15 C 3 180 000 1200 B (C 3 -proaktivátor) 93 000 200 D (C 3 -proaktivátor konvertáza) 24 000 1 Zložka alebo faktor Klasický spôsob aktivácie rozpoznávacia jednotka aktivačná jednotka Alternatívny spôsob aktivácie

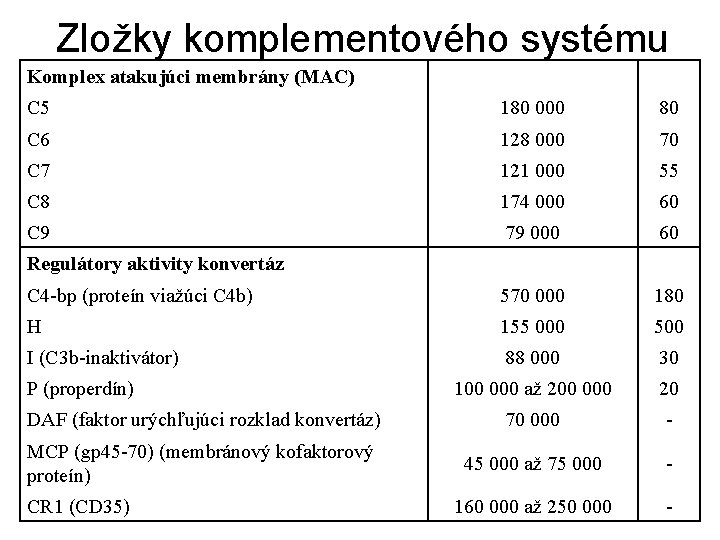
Zložky komplementového systému Komplex atakujúci membrány (MAC) C 5 180 000 80 C 6 128 000 70 C 7 121 000 55 C 8 174 000 60 C 9 79 000 60 C 4 -bp (proteín viažúci C 4 b) 570 000 180 H 155 000 500 I (C 3 b-inaktivátor) 88 000 30 100 000 až 200 000 20 DAF (faktor urýchľujúci rozklad konvertáz) 70 000 - MCP (gp 45 -70) (membránový kofaktorový proteín) 45 000 až 75 000 - 160 000 až 250 000 - Regulátory aktivity konvertáz P (properdín) CR 1 (CD 35)

Zložky komplementového systému Iné regulátory C 1 -INH (C 1 inhibítor) 104 000 165 SCPN (sérová karboxypeptidáza N) 300 000 50 CFI (inaktivátor chemotaktického faktora) 160 000 50 70 000 až 80 000 350 65 000 - Proteín S (vitronektín) HRF (homológny reštrikčný faktor)

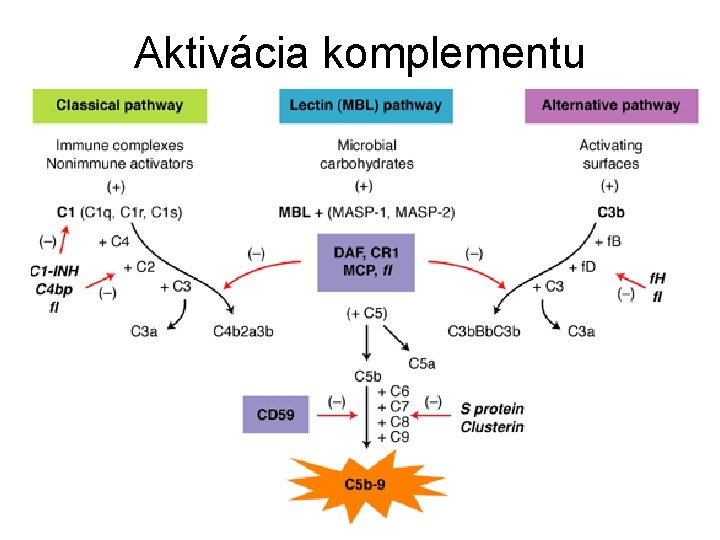
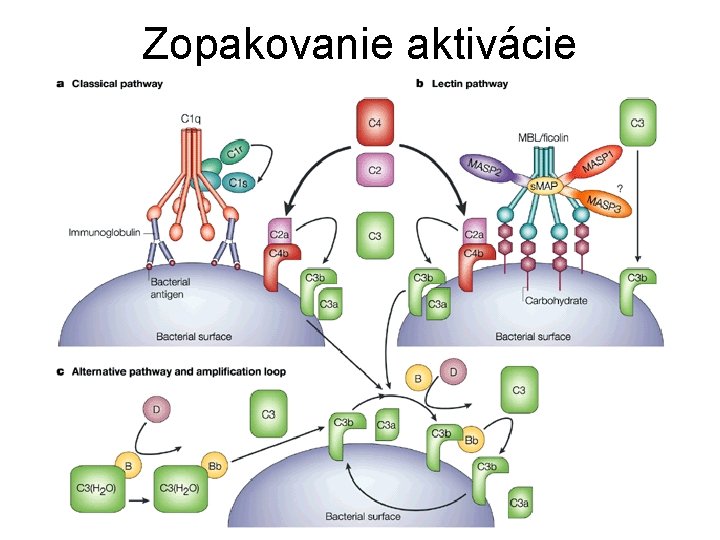
Aktivácia komplementu • všetky zložky okrem faktora D sa syntetizujú v neaktívnom stave • aktivácia je kaskádový proces na základe limitovanej proteolýzy • amplifikácia signálu • aktivácia je prísne regulovaná • 3 cesty aktivácie – klasická (imunokomplexy, agregáty Ig. G al. Ig. M, . . . ) – lektínová (Man, NAc. Glc, Na. Ac. Man, Glc na povrchu) – alternatívna (baktérie, huby, vírusy, nádory, Ig. A, Ig. E, . . . ) • od vytvorenia C 3 b je zvyšok cesty rovnaký • výsledok – tvorba MAC

Aktivácia komplementu

Klasická cesta aktivácie • objavená ako prvá • závislá na protilátkach a ich reakcii s antigénom • spúšťaná tiež retrovírusmi, mykoplazmami, E. coli, Klebsiella pneumoniae, pneumokokovým polysacharidom, polyaniónmi (heparín, protamín, dextran) • dochádza k časovému posunu naštartovania o 4 -5 dní • CRP má niektoré podobné vlastnosti ako protilátky (opsonizuje cudzorodé častice a spúšťa aj klasickú cestu aktivácie) a vzniká do 1 -2 dní

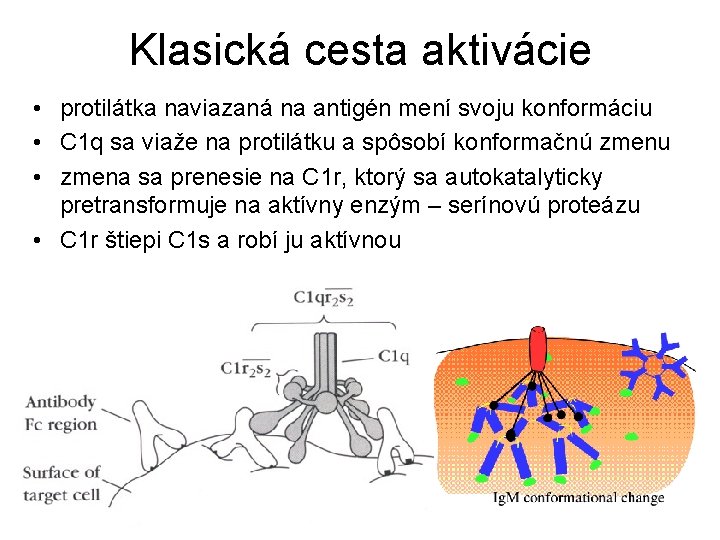
Klasická cesta aktivácie • protilátka naviazaná na antigén mení svoju konformáciu • C 1 q sa viaže na protilátku a spôsobí konformačnú zmenu • zmena sa prenesie na C 1 r, ktorý sa autokatalyticky pretransformuje na aktívny enzým – serínovú proteázu • C 1 r štiepi C 1 s a robí ju aktívnou

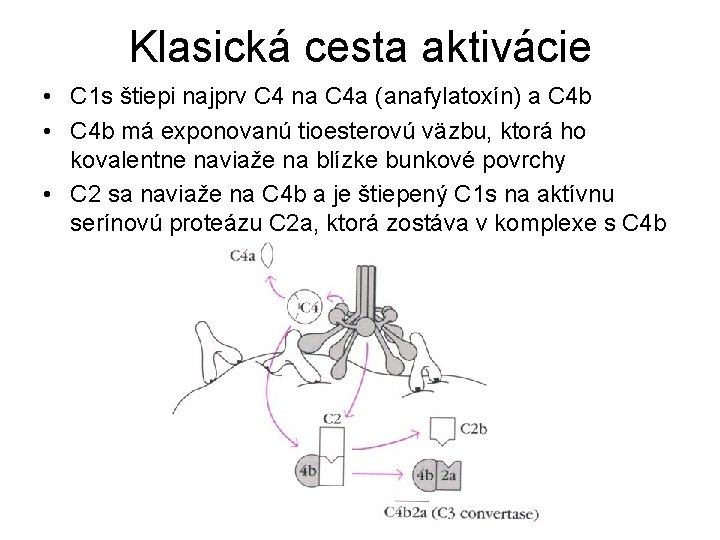
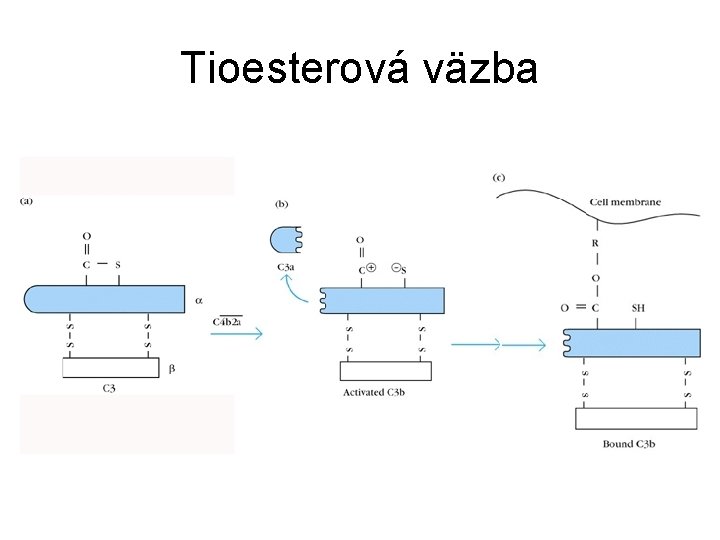
Klasická cesta aktivácie • C 1 s štiepi najprv C 4 na C 4 a (anafylatoxín) a C 4 b • C 4 b má exponovanú tioesterovú väzbu, ktorá ho kovalentne naviaže na blízke bunkové povrchy • C 2 sa naviaže na C 4 b a je štiepený C 1 s na aktívnu serínovú proteázu C 2 a, ktorá zostáva v komplexe s C 4 b

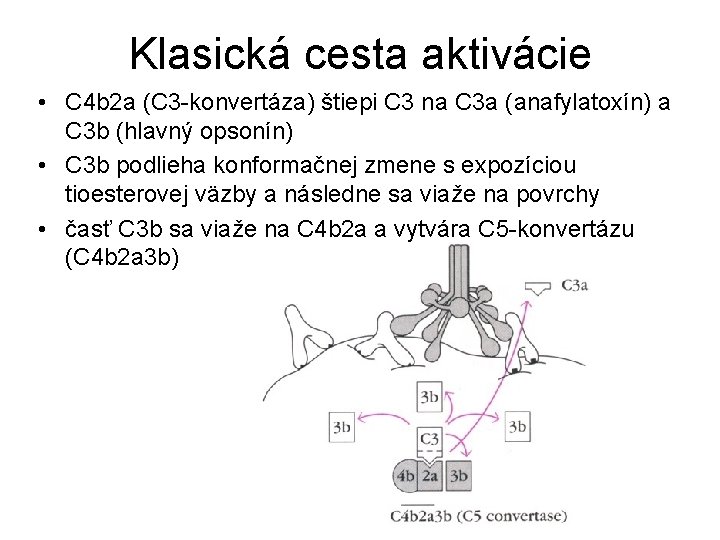
Klasická cesta aktivácie • C 4 b 2 a (C 3 -konvertáza) štiepi C 3 na C 3 a (anafylatoxín) a C 3 b (hlavný opsonín) • C 3 b podlieha konformačnej zmene s expozíciou tioesterovej väzby a následne sa viaže na povrchy • časť C 3 b sa viaže na C 4 b 2 a a vytvára C 5 -konvertázu (C 4 b 2 a 3 b)

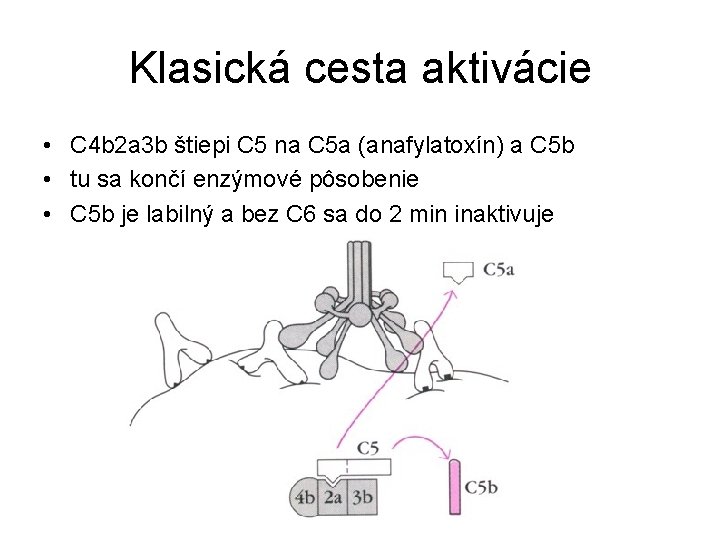
Klasická cesta aktivácie • C 4 b 2 a 3 b štiepi C 5 na C 5 a (anafylatoxín) a C 5 b • tu sa končí enzýmové pôsobenie • C 5 b je labilný a bez C 6 sa do 2 min inaktivuje

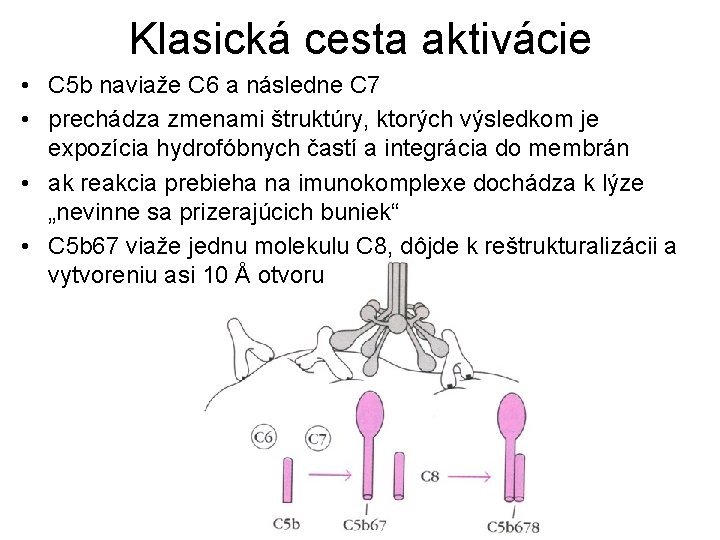
Klasická cesta aktivácie • C 5 b naviaže C 6 a následne C 7 • prechádza zmenami štruktúry, ktorých výsledkom je expozícia hydrofóbnych častí a integrácia do membrán • ak reakcia prebieha na imunokomplexe dochádza k lýze „nevinne sa prizerajúcich buniek“ • C 5 b 67 viaže jednu molekulu C 8, dôjde k reštrukturalizácii a vytvoreniu asi 10 Å otvoru

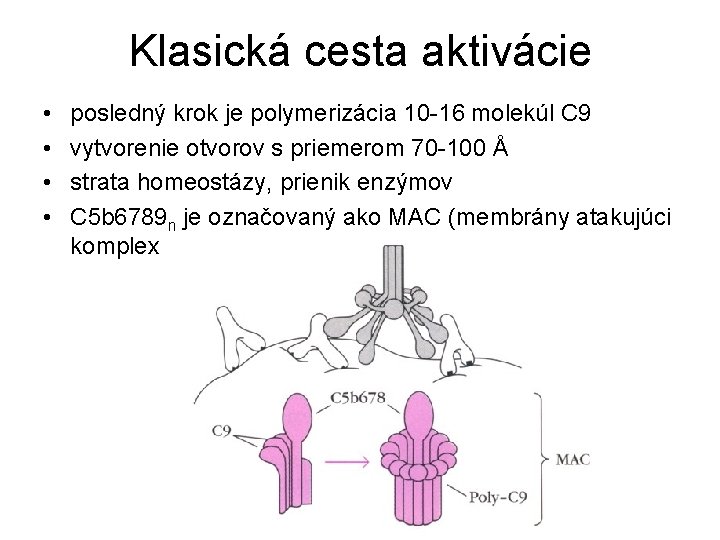
Klasická cesta aktivácie • • posledný krok je polymerizácia 10 -16 molekúl C 9 vytvorenie otvorov s priemerom 70 -100 Å strata homeostázy, prienik enzýmov C 5 b 6789 n je označovaný ako MAC (membrány atakujúci komplex

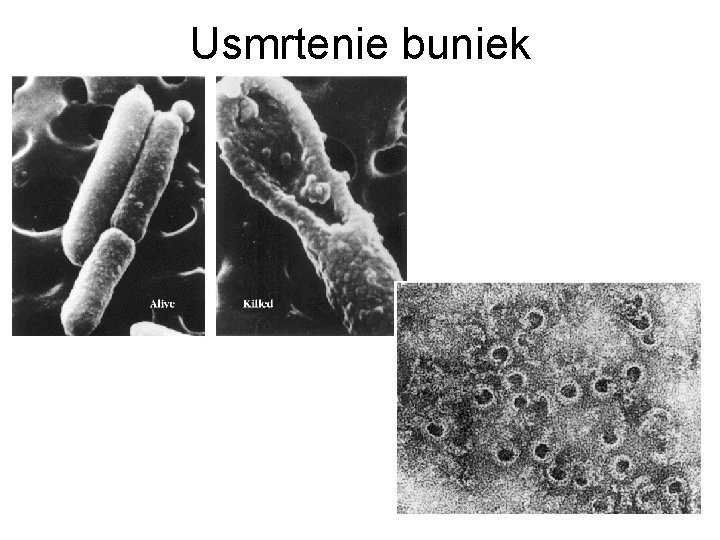
Usmrtenie buniek

Tioesterová väzba

Lektínová cesta aktivácie • objavená ako posledná • makrofágy po pohltení baktérií produkujú cytokíny, ktoré indukujú tvorbu zápalových proteínov v pečeni • kolektín MBP (manose binding protein) sa viaže na sacharidy vo forme tetraméru alebo hexaméru (analóg C 1 q) • následne sa viažu MASP-1 a MASP-2 (MBP asociated serine protease sú analógy C 1 r a C 1 s) • zvyšok lektínovej cesty je rovnaký s klasickou cestou • proteíny lektínovej cesty sú fylogeneticky staršie

Alternatívna cesta aktivácie Schopnosť aktivácie ihneď po vstupe cudzorodých buniek • agregovanými Ig. G, Ig. A a Ig. E • polysacharidmi (dextrán, zymozán, inulín, agar) • LPS (G-), kys. teichoovou (G+) • polyaniónmi, DNA • vírusmi • hubami (kvasinky, plesne) • parazitmi • mnohými nádorovými bunkami Vyžaduje sa prítomnosť C 3 b (môže byť aj hydrolyzovaná forma C 3(H 2 O) resp. C 3(NH 3))

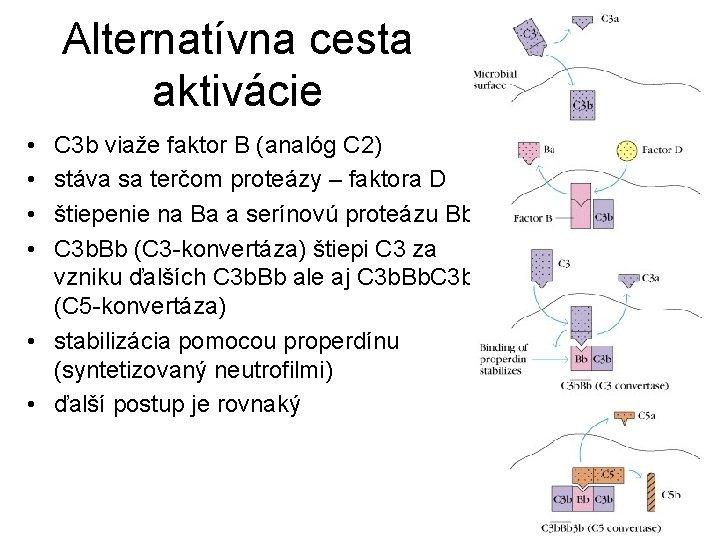
Alternatívna cesta aktivácie • • C 3 b viaže faktor B (analóg C 2) stáva sa terčom proteázy – faktora D štiepenie na Ba a serínovú proteázu Bb C 3 b. Bb (C 3 -konvertáza) štiepi C 3 za vzniku ďalších C 3 b. Bb ale aj C 3 b. Bb. C 3 b (C 5 -konvertáza) • stabilizácia pomocou properdínu (syntetizovaný neutrofilmi) • ďalší postup je rovnaký

Zopakovanie aktivácie

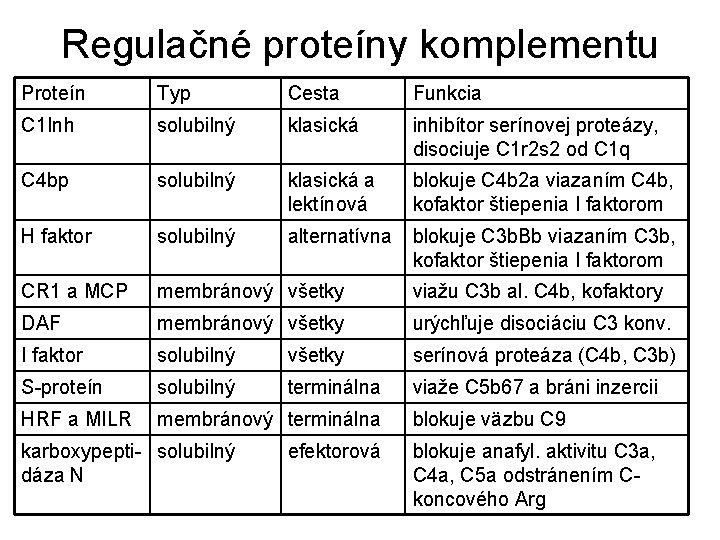
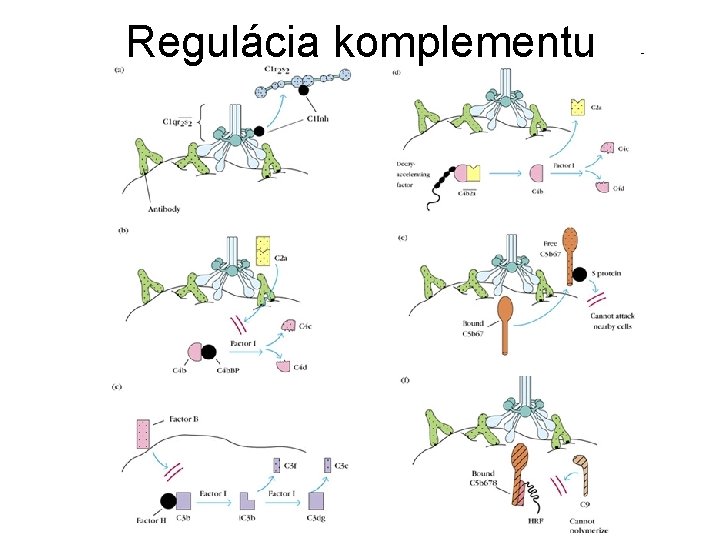
Regulačné proteíny komplementu Proteín Typ Cesta Funkcia C 1 Inh solubilný klasická inhibítor serínovej proteázy, disociuje C 1 r 2 s 2 od C 1 q C 4 bp solubilný klasická a lektínová blokuje C 4 b 2 a viazaním C 4 b, kofaktor štiepenia I faktorom H faktor solubilný alternatívna blokuje C 3 b. Bb viazaním C 3 b, kofaktor štiepenia I faktorom CR 1 a MCP membránový všetky viažu C 3 b al. C 4 b, kofaktory DAF membránový všetky urýchľuje disociáciu C 3 konv. I faktor solubilný všetky serínová proteáza (C 4 b, C 3 b) S-proteín solubilný terminálna viaže C 5 b 67 a bráni inzercii HRF a MILR membránový terminálna karboxypepti- solubilný dáza N efektorová blokuje väzbu C 9 blokuje anafyl. aktivitu C 3 a, C 4 a, C 5 a odstránením Ckoncového Arg

Regulácia komplementu

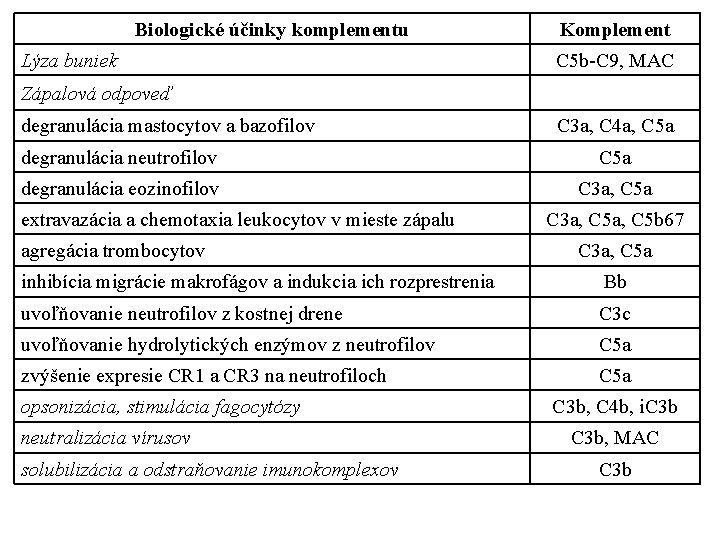
Biologické účinky komplementu Lýza buniek Komplement C 5 b-C 9, MAC Zápalová odpoveď degranulácia mastocytov a bazofilov C 3 a, C 4 a, C 5 a degranulácia neutrofilov C 5 a degranulácia eozinofilov C 3 a, C 5 a extravazácia a chemotaxia leukocytov v mieste zápalu agregácia trombocytov C 3 a, C 5 b 67 C 3 a, C 5 a inhibícia migrácie makrofágov a indukcia ich rozprestrenia Bb uvoľňovanie neutrofilov z kostnej drene C 3 c uvoľňovanie hydrolytických enzýmov z neutrofilov C 5 a zvýšenie expresie CR 1 a CR 3 na neutrofiloch C 5 a opsonizácia, stimulácia fagocytózy neutralizácia vírusov solubilizácia a odstraňovanie imunokomplexov C 3 b, C 4 b, i. C 3 b, MAC C 3 b

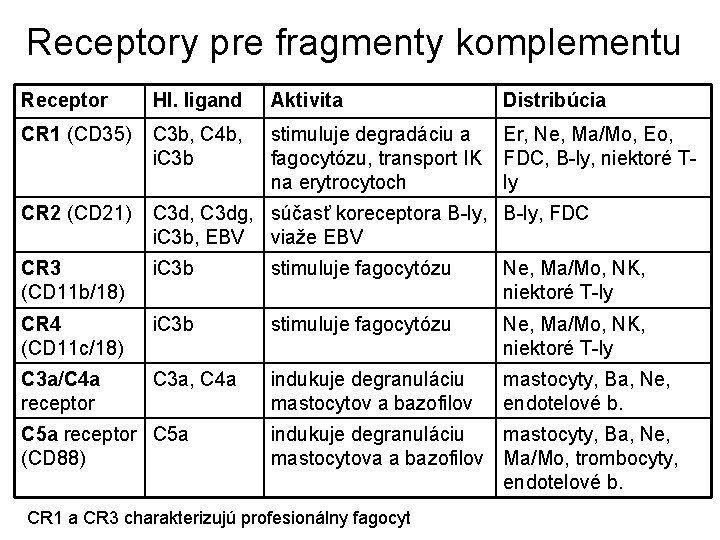
Receptory pre fragmenty komplementu Receptor Hl. ligand Aktivita Distribúcia CR 1 (CD 35) C 3 b, C 4 b, i. C 3 b stimuluje degradáciu a fagocytózu, transport IK na erytrocytoch Er, Ne, Ma/Mo, Eo, FDC, B-ly, niektoré Tly CR 2 (CD 21) C 3 d, C 3 dg, súčasť koreceptora B-ly, FDC i. C 3 b, EBV viaže EBV CR 3 (CD 11 b/18) i. C 3 b stimuluje fagocytózu Ne, Ma/Mo, NK, niektoré T-ly CR 4 (CD 11 c/18) i. C 3 b stimuluje fagocytózu Ne, Ma/Mo, NK, niektoré T-ly C 3 a/C 4 a receptor C 3 a, C 4 a indukuje degranuláciu mastocytov a bazofilov mastocyty, Ba, Ne, endotelové b. C 5 a receptor C 5 a (CD 88) indukuje degranuláciu mastocyty, Ba, Ne, mastocytova a bazofilov Ma/Mo, trombocyty, endotelové b. CR 1 a CR 3 charakterizujú profesionálny fagocyt

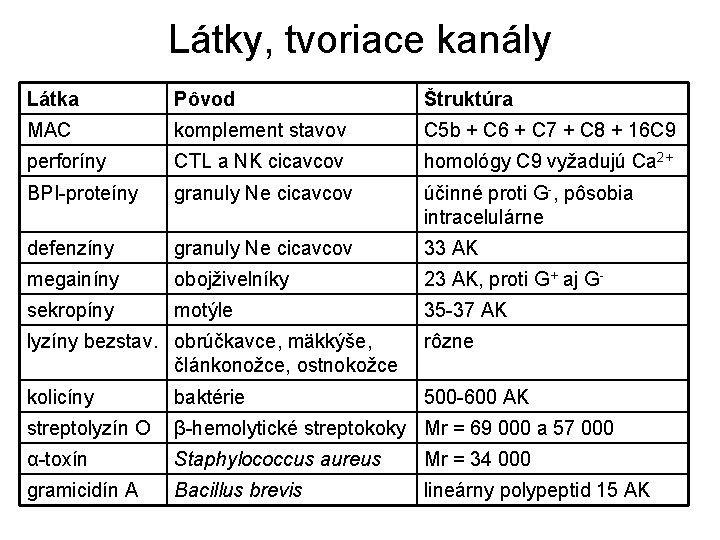
Látky, tvoriace kanály Látka Pôvod Štruktúra MAC komplement stavov C 5 b + C 6 + C 7 + C 8 + 16 C 9 perforíny CTL a NK cicavcov homológy C 9 vyžadujú Ca 2+ BPI-proteíny granuly Ne cicavcov účinné proti G-, pôsobia intracelulárne defenzíny granuly Ne cicavcov 33 AK megainíny obojživelníky 23 AK, proti G+ aj G- sekropíny motýle 35 -37 AK lyzíny bezstav. obrúčkavce, mäkkýše, článkonožce, ostnokožce rôzne kolicíny baktérie 500 -600 AK streptolyzín O β-hemolytické streptokoky Mr = 69 000 a 57 000 α-toxín Staphylococcus aureus Mr = 34 000 gramicidín A Bacillus brevis lineárny polypeptid 15 AK

Vrodené poruchy komplementu Deficiencia Choroba Dedičnosť C 1 q SLE, glomerulonefritída, CHPI AR C 1 r SLE, CHPI AR C 4 SLE, Sjogrenov syndróm, CHPI, autoimunitné choroby AR C 2 SLE, juvenilná reumatoidná artritída, glomerulonefritída AR + HLA C 3 CHPI, glomerulonefritída, reumatoidná artritída AR C 5 SLE, chronické neisseriové inf. AR C 6 -8 SLE, chronické neisseriové inf. AR C 9 sklerodermia, purpura AR C 1 Inh hereditárny angioedém AR P, D, I CHPI AR SLE systémový lupus erythematosus, CHPI chronické pyogénne infekcie