Klinische Forschung in der Schweiz Gesetzliche Grundlagen Humanforschungsgesetz





















- Slides: 33

Klinische Forschung in der Schweiz: Gesetzliche Grundlagen Humanforschungsgesetz PD Dr. med. Gabriela Senti, Leitung Clinical Trials Center Veranstaltung «Forschungsanträge erfolgreich gestalten» 23. Februar 2015 Forschungsanträge erfolgreich planen

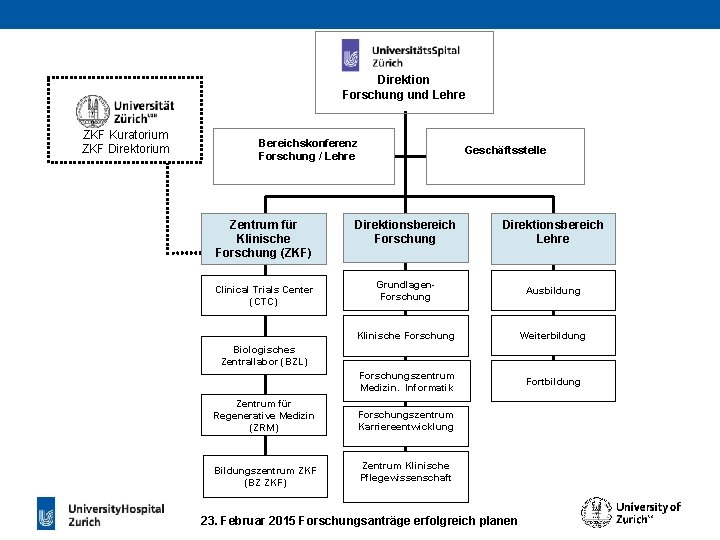
Direktion Forschung und Lehre ZKF Kuratorium ZKF Direktorium Bereichskonferenz Forschung / Lehre Geschäftsstelle Zentrum für Klinische Forschung (ZKF) Direktionsbereich Forschung Direktionsbereich Lehre Clinical Trials Center (CTC) Grundlagen. Forschung Ausbildung Klinische Forschung Weiterbildung Forschungszentrum Medizin. Informatik Fortbildung Biologisches Zentrallabor (BZL) Zentrum für Regenerative Medizin (ZRM) Bildungszentrum ZKF (BZ ZKF) Forschungszentrum Karriereentwicklung Zentrum Klinische Pflegewissenschaft 23. Februar 2015 Forschungsanträge erfolgreich planen

CTC-Dienstleistungen § Schwerpunkt Investigator Initiated Trials (IITs) § Phase I Unit, Investigators und Study Coordinators § Regulatory Affairs, Monitoring, Data Management § Unterstützung bei Inspektionen und Audits § Leitlinien Klinische Forschung § Qualitätsmanagement-System § Aus-/Weiter-/Fortbildung im Bereich der Forschung am Menschen § Unterstützung bei der Registrierung der Projekte 23. Februar 2015 Forschungsanträge erfolgreich planen

23. Februar 2015 Forschungsanträge erfolgreich planen

Humanforschungsgesetz (HFG) 2010: • Art. 118 b Bundesverfassung 2011: • Humanforschungsgesetz (HFG) 2013: • Verordnungsrecht (Klin. V, HFV, OV) 2014: • 1. Januar 2014: Inkrafttreten Graphik C. Jenny, BAG; Nov 2013 23. Februar 2015 Forschungsanträge erfolgreich planen

Zweck des HFG (HFG Art. 1) § Würde, Persönlichkeit und Gesundheit des Menschen in der Forschung schützen § Günstige Rahmenbedingungen für die Forschung am Menschen schaffen § Qualität der Forschung am Menschen sicherstellen § Transparenz der Forschung am Menschen gewährleisten 23. Februar 2015 Forschungsanträge erfolgreich planen

Wissenschaftliche Anforderungen (HFG Art. 10) Forschung am Menschen darf nur durchgeführt werden, wenn: § die anerkannten Regelungen über die wissenschaftliche Integrität eingehalten werden, insbesondere bezüglich des Umgangs mit Interessenkonflikten; § die Anforderungen an die wissenschaftliche Qualität erfüllt sind; § die anerkannten internationalen Regeln der Guten Praxis über die Forschung am Menschen eingehalten werden; § die verantwortlichen Personen fachlich hinreichend qualifiziert sind. 23. Februar 2015 Forschungsanträge erfolgreich planen

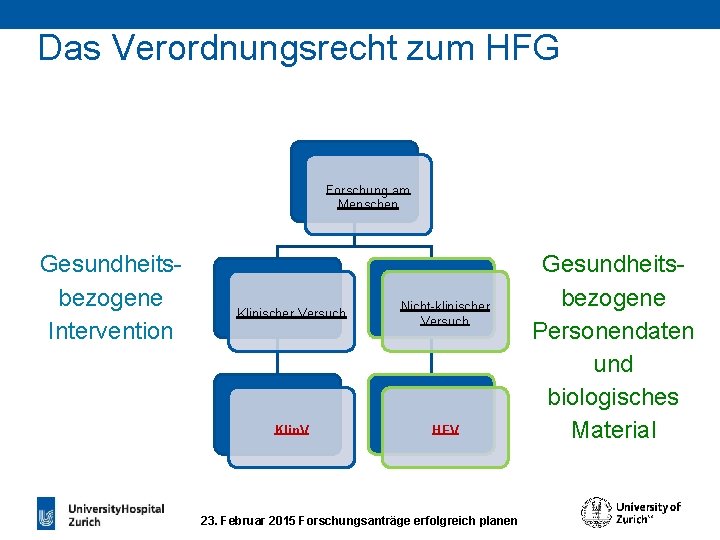
Das Verordnungsrecht zum HFG § Humanforschungsverordnung Klin. V Verordnung über klinische Versuche gemäss Definition HFG Art. 3 lit. l § Humanforschungsverordnung HFV Verordnung über die Humanforschung mit Ausnahme der klinischen Versuche § Organisationsverordnung OV-HFG Ethikkommissionen, Koordinationsstelle, Datenschutz 23. Februar 2015 Forschungsanträge erfolgreich planen

Das Verordnungsrecht zum HFG Forschung am Menschen Gesundheitsbezogene Intervention Klinischer Versuch Nicht-klinischer Versuch Klin. V HFV 23. Februar 2015 Forschungsanträge erfolgreich planen Gesundheitsbezogene Personendaten und biologisches Material

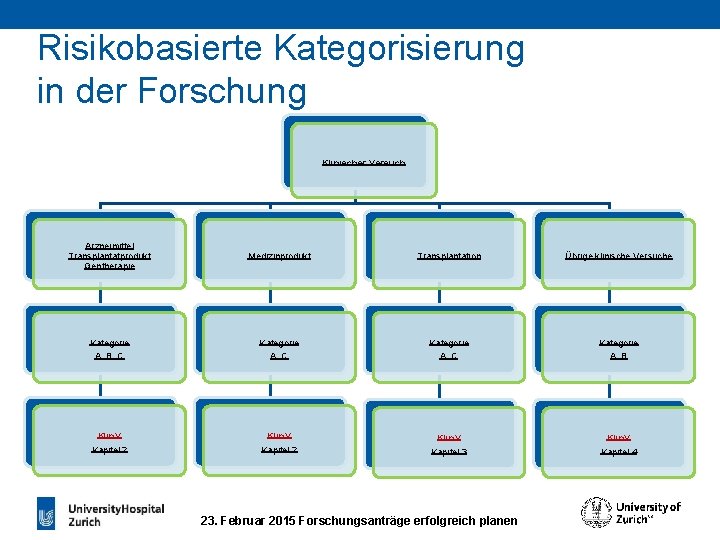
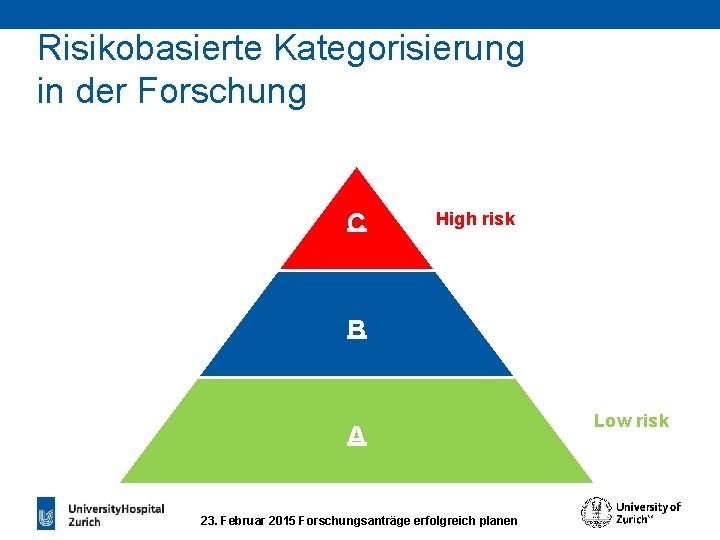
Risikobasierte Kategorisierung in der Forschung Klinischer Versuch Arzneimittel Transplantatprodukt Gentherapie Medizinprodukt Transplantation Übrige klinische Versuche Kategorie A, B, C Kategorie A, B Klin. V Kapitel 2 Klin. V Kapitel 3 Klin. V Kapitel 4 23. Februar 2015 Forschungsanträge erfolgreich planen

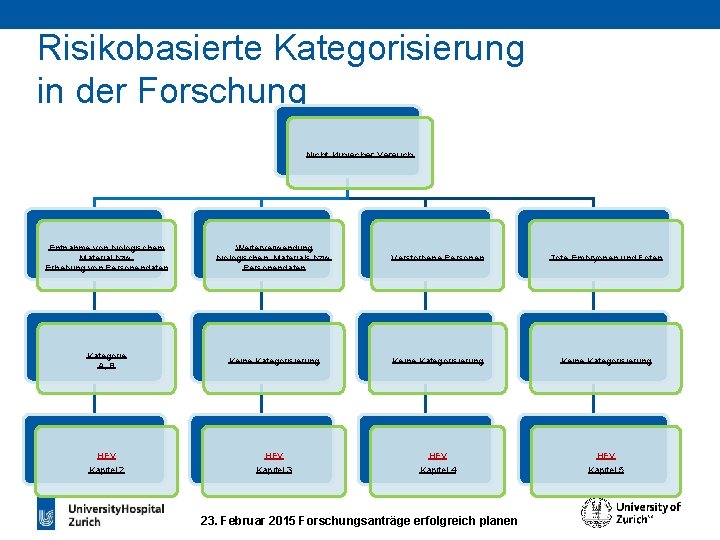
Risikobasierte Kategorisierung in der Forschung Nicht klinischer Versuch Entnahme von biologischem Material bzw. Erhebung von Personendaten Weiterverwendung biologischen Materials bzw. Personendaten Verstorbene Personen Tote Embryonen und Föten Kategorie A, B Keine Kategorisierung HFV HFV Kapitel 2 Kapitel 3 Kapitel 4 Kapitel 5 23. Februar 2015 Forschungsanträge erfolgreich planen

Das Verordnungsrecht zum HFG 23. Februar 2015 Forschungsanträge erfolgreich planen

Änderungen zum bisherigen Recht § Risikokategorisierung: Bewilligungsverfahren, Versicherung, Meldepflichten je nach Gefahrenpotenzial abgestuft § Bewilligungsverfahren bei Ethikkommission und Swissmedic § Multizentrische Forschungsprojekte: Leitkommissionsverfahren § Transparenz: Registrierung der klinischen Versuche 23. Februar 2015 Forschungsanträge erfolgreich planen

Risikobasierte Kategorisierung in der Forschung C High risk B A 23. Februar 2015 Forschungsanträge erfolgreich planen Low risk

Änderungen zum bisherigen Recht Günstige Rahmenbedingungen für die Forschung in der Schweiz durch gefährdungsbezogenen Regelungsansatz Kategorisierung: § Erleichterung des administrativen Aufwands § Differenzierte Bewilligungsverfahren bei der EK (ordentlich, vereinfacht, Präsidialentscheid) § Vereinfachtes Verfahren zum Beispiel bei klinischen Versuchen der Kategorie A § Unterschiedlich strenge Dokumentations- und Meldepflichten bzgl. AEs/SAEs § Risiko-adaptiertes Monitoring (Qualitätskontrolle) 23. Februar 2015 Forschungsanträge erfolgreich planen

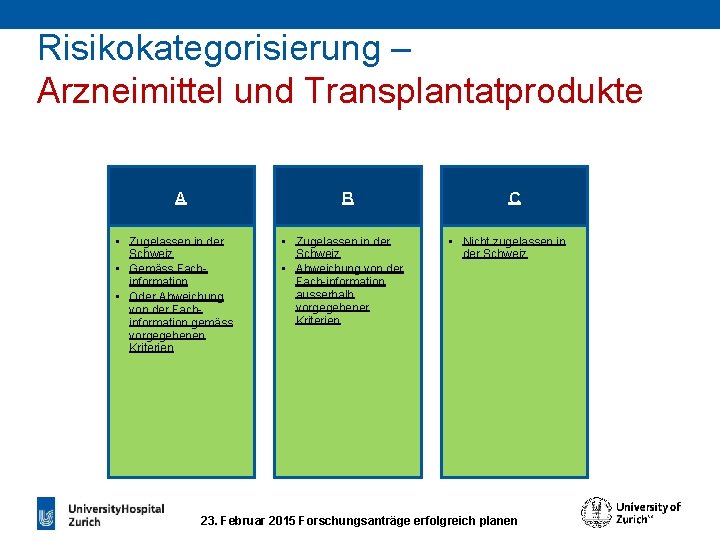
Risikokategorisierung – Arzneimittel und Transplantatprodukte A B • Zugelassen in der Schweiz • Gemäss Fachinformation • Oder Abweichung von der Fachinformation gemäss vorgegebenen Kriterien • Zugelassen in der Schweiz • Abweichung von der Fach-information ausserhalb vorgegebener Kriterien C • Nicht zugelassen in der Schweiz 23. Februar 2015 Forschungsanträge erfolgreich planen

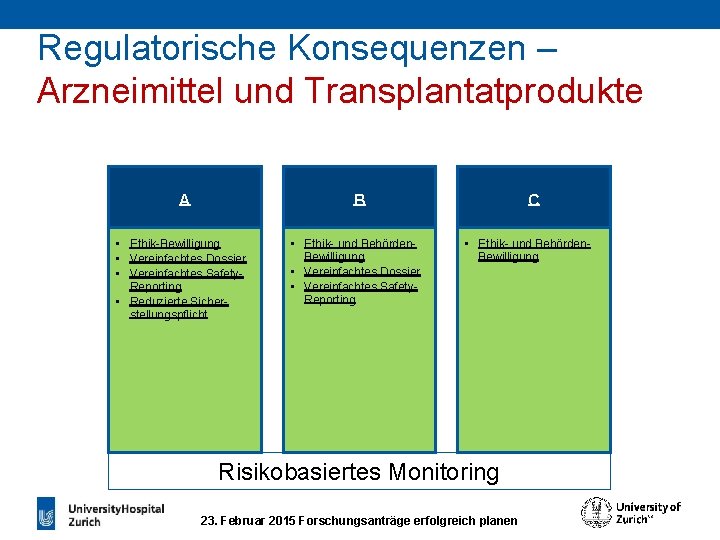
Regulatorische Konsequenzen – Arzneimittel und Transplantatprodukte A B • Ethik-Bewilligung • Vereinfachtes Dossier • Vereinfachtes Safety. Reporting • Reduzierte Sicherstellungspflicht • Ethik- und Behörden. Bewilligung • Vereinfachtes Dossier • Vereinfachtes Safety. Reporting C • Ethik- und Behörden. Bewilligung Risikobasiertes Monitoring 23. Februar 2015 Forschungsanträge erfolgreich planen

Dokumentation: unerwünschte Ereignisse bei klinischen Versuchen mit Arzneimitteln Klin. V Art. 39 § Kategorie C: in standardisierter Weise (in KG und im CRF) § Kategorie B: in standardisierter Weise, wenn in Prüfplan vorgesehen oder von Bewilligungsbehörde gefordert § Kategorie A: keine Dokumentationspflicht 23. Februar 2015 Forschungsanträge erfolgreich planen

Risikokategorisierung – Medizinprodukt A • CE markiert • Zugelassen in der Schweiz • Anwendung gemäss Gebrauchs-anweisung C • Nicht CE markiert in der Schweiz • Anwendung nicht gemäss Gebrauchsanweisung • In der Schweiz verboten 23. Februar 2015 Forschungsanträge erfolgreich planen

Regulatorische Konsequenzen – Medizinprodukt A • Ethik-Bewilligung • Vereinfachtes Dossier • Vereinfachtes Safety. Reporting • Reduzierte Sicherstellungspflicht C • Ethik- und Behörden. Bewilligung Risikobasiertes Monitoring 23. Februar 2015 Forschungsanträge erfolgreich planen

Änderungen zum bisherigen Recht § Risikokategorisierung: Bewilligungsverfahren, Versicherung, Meldepflichten je nach Gefahrenpotential abgestuft § Bewilligungsverfahren bei Ethikkommission und Swissmedic § Multizentrische Forschungsprojekte: Leitkommissionsverfahren § Transparenz: Registrierung der klinischen Versuche 23. Februar 2015 Forschungsanträge erfolgreich planen

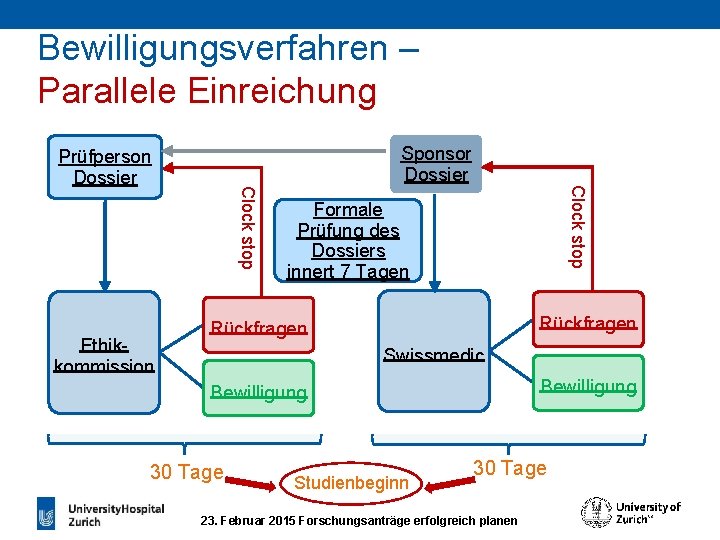
Welche Forschung muss bewilligt werden? § Alle Projekte der Forschung am Menschen § Weiterverwendung von biologischem Material und gesundheitsbezogenen Personendaten Bewilligung durch Ethikkommission und Parallele Einreichung Swissmedic/BAG (je nach Risikokategorie/Strahlenbelastung) 23. Februar 2015 Forschungsanträge erfolgreich planen

Bewilligungsverfahren – Parallele Einreichung Sponsor Dossier Clock stop Ethikkommission Clock stop Prüfperson Dossier Formale Prüfung des Dossiers innert 7 Tagen Rückfragen Swissmedic Bewilligung 30 Tage Studienbeginn 30 Tage 23. Februar 2015 Forschungsanträge erfolgreich planen

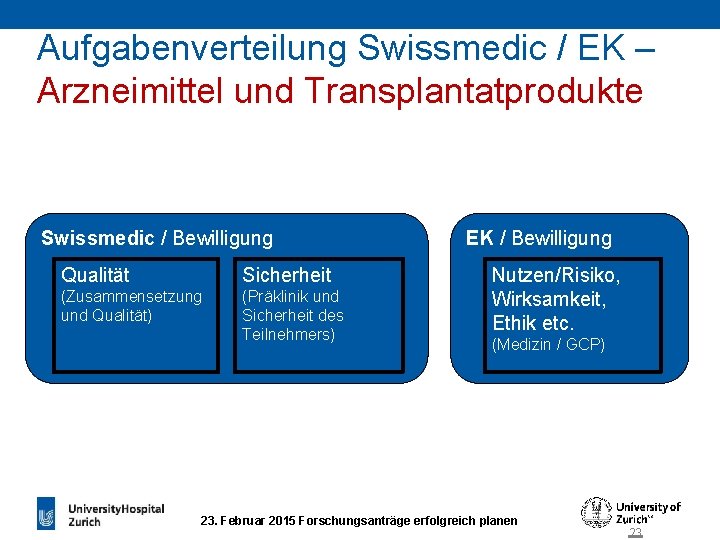
Aufgabenverteilung Swissmedic / EK – Arzneimittel und Transplantatprodukte Swissmedic / Bewilligung Qualität Sicherheit (Zusammensetzung und Qualität) (Präklinikund Sicherheit Patientensicherheit) des Teilnehmers) EK / Bewilligung Nutzen/Risiko, Nutzen / Risiko, Wirksamkeit, Ethik etc. (Medizin / GCP) 23. Februar 2015 Forschungsanträge erfolgreich planen 23

Aufgabenverteilung Swissmedic / EK – Medizinprodukte Swissmedic / Bewilligung Anforderungen gemäss aktuellen Direktiven Risiken „Performance“ des Medizinproduktes EK / Bewilligung Nutzen / Risiko Ethik Patienteninformation und Patientenrecht 23. Februar 2015 Forschungsanträge erfolgreich planen 24

Änderungen zum bisherigen Recht § Risikokategorisierung: Bewilligungsverfahren, Versicherung, Meldepflichten je nach Gefahrenpotential abgestuft § Bewilligungsverfahren bei Ethikkommission und Swissmedic § Multizentrische Forschungsprojekte: Leitkommissionsverfahren § Transparenz: Registrierung der klinischen Versuche 23. Februar 2015 Forschungsanträge erfolgreich planen

Multizentrische Forschungsprojekte: Leitkommissionsverfahren Leitkommission zuständige EK am Tätigkeitsort der koordinierenden Prüfperson Beteiligte EK zuständig für fachliche und betriebliche Voraussetzungen der beteiligten Prüfpersonen/Zentren in den anderen Kantonen 23. Februar 2015 Forschungsanträge erfolgreich planen

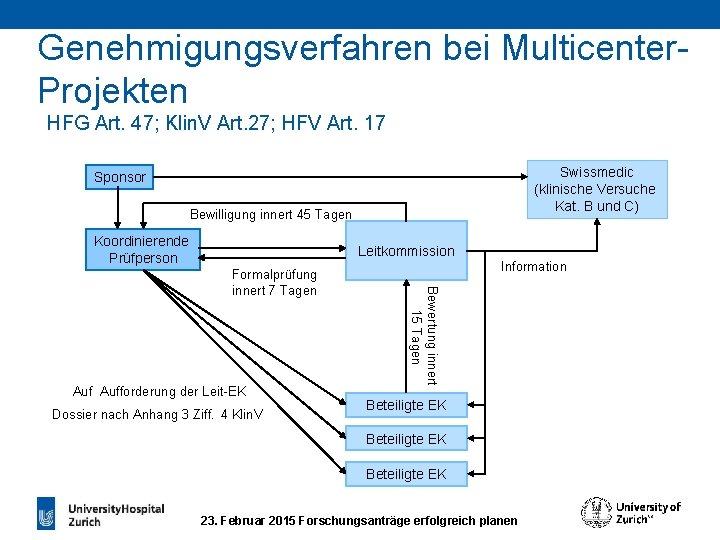
Genehmigungsverfahren bei Multicenter. Projekten HFG Art. 47; Klin. V Art. 27; HFV Art. 17 Swissmedic (klinische Versuche Kat. B und C) Sponsor Bewilligung innert 45 Tagen Koordinierende Prüfperson Leitkommission Aufforderung der Leit-EK Dossier nach Anhang 3 Ziff. 4 Klin. V Information Bewertung innert 15 Tagen Formalprüfung innert 7 Tagen Beteiligte EK 23. Februar 2015 Forschungsanträge erfolgreich planen

Änderungen zum bisherigen Recht § Multizentrische Forschungsprojekte: Leitkommissionsverfahren § Risikokategorisierung: Bewilligungsverfahren, Versicherung, Meldepflichten je nach Gefahrenpotential abgestuft § Bewilligungsverfahren bei Ethikkommission und Swissmedic § Transparenz: Registrierung der klinischen Versuche 23. Februar 2015 Forschungsanträge erfolgreich planen

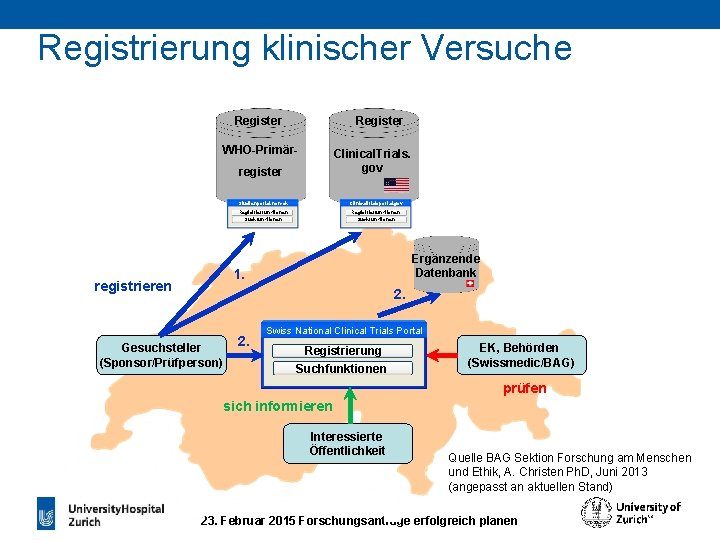
Registrierung klinischer Versuche Register WHO-Primär- Clinical. Trials. gov register Studienportal. non-ch Clinicaltrialsportal. gov Registrierfunktionen Suchfunktionen Ergänzende Datenbank 1. registrieren 2. Gesuchsteller (Sponsor/Prüfperson) 2. Swiss National Clinical Trials Portal Registrierung Suchfunktionen EK, Behörden (Swissmedic/BAG) prüfen sich informieren Interessierte Öffentlichkeit Quelle BAG Sektion Forschung am Menschen und Ethik, A. Christen Ph. D, Juni 2013 (angepasst an aktuellen Stand) 23. Februar 2015 Forschungsanträge erfolgreich planen

Registrierung klinischer Versuche Studienportal 23. Februar 2015 Forschungsanträge erfolgreich planen

Zusammenfassung § Alle Forschung am Menschen geregelt § Erleichterungen durch Risikokategorisierung § Parallele Einreichung Ethik / Swissmedic spart Zeit § Zentrale Registrierung der klinischen Versuche 23. Februar 2015 Forschungsanträge erfolgreich planen

23. Februar 2015 Forschungsanträge erfolgreich planen