KLINIKAI FARMAKOLGIA NPEGSZSGGYI JELENTSGE Dr Kovcs Pter egyetemi


























































- Slides: 75

KLINIKAI FARMAKOLÓGIA NÉPEGÉSZSÉGÜGYI JELENTŐSÉGE Dr. Kovács Péter egyetemi tanár DEOEC Belgy. Int. , I. sz. Belklinika és DEOEC Klinikai Farmakológiai Tanszék

BIZONYÍTÉKON ALAPULÓ ORVOSLÁS (EBM= EVIDENCE BASED MEDICINE) l l Empirikus gyógyítás egyedei felfedezésein túllépő, célirányosan tervezett nagy létszámú és homogén populáción végrehajtott statisztikai érveket felvonultató klinikai vizsgálatok. Minőség, eredmények összehasonlíthatósága, reprodukálhatósága. GCP (Good Clinical Practice= Helyes Klinikai Gyakorlat). Világszerte egységesedő klinikai vizsgálati módszertanok (ICH). EU szabályok és irányelvek

GYÓGYSZERFEJLESZTÉS l l l Koncentrál ipari kutatási-fejlesztési tevékenység. Multinacionális globalizálódó tendenciák, egyre szigorúbb és egységesebb nemzetközi elvárások és ellenőrzések. Gyógyszerfejlesztés: gyógyszerjelölt életciklusa a felfedezéstől a gyógyszertárig 10 -15 éves folyamat.

DRUG DISCOVERY PIPELINE l l l A molekula felfedezése, azonosítása Preklinikai vizsgálatok (in vitro és in vivo toxikológiai és farmakológiai állatkísérletes, ill. humán sejt/szövetkultúra modellek) Humán fázis I-II-III vizsgálatok Törzskönyvi benyújtás és elbírálás Fázis IV. és posztmarketing (PMS) vizsgálatok

PREKLINIKAI FÁZIS (FÁZIS „ 0”) l A vegyület felfedezése (molekulák szintézise vagy kinyerés (extrakció) (extrakció= természetes forrásokból szintézis= mesterséges molekula létrehozási forma) l l l Kombinációs vegyészet Vezérmolekula felfedezés= lead discovery Lead optimatization (molekulaszűrés) Biológiai szűrés (screening) Gyógyszerészeti formuláció és stabilitás vizsgálat (excipiensek) Toxikológiai vizsgálatok (kockázat emberre és környezetére)

GYÓGYSZERFEJLESZTÉS ÜZLETI MUTATÓI l l USA: 25. 000 -50. 000 szűrt molekulából 1. 250 kerül preklinikai vizsgálatra, 25 klinikai kipróbálásra, 5 kerül törzskönyvezésre, 1 lesz profit termelő. Originalitás-innovatív termék Generikum USA: 10 törzskönyvezettből 1 nullszaldós 10 törzskönyvezettből 2 profitot hoz 10 törzskönyvezettből 7 még a fejlesztési költséget sem termeli ki. l Mega blockbuster= 1 milliárd USD

KLINIKAI FARMAKOLÓGIAI VIZSGÁLAT PRE-KLINIKAI FÁZIS I. FÁZIS 24 -36 ÁLLATKÍSÉRLET, TOXIKOLÓGIA új vegyület első humán vizsg. , vitális paraméterek regisztrálása, önkéntesen végzett vizsgálat II. FÁZIS 20 -200 Klinikai vizsg. kisebb beteganyagon hatás vizsg. , dózis, terápiás profil III. FÁZIS 200 -3000 Klinikai vizsg. kisebb beteganyagon hatás vizsg. , placebo v. referencia gyógyszerrel IV. FÁZIS 10 -10000 Regisztrált gyógyszer vizsgálata, „post marketing study”

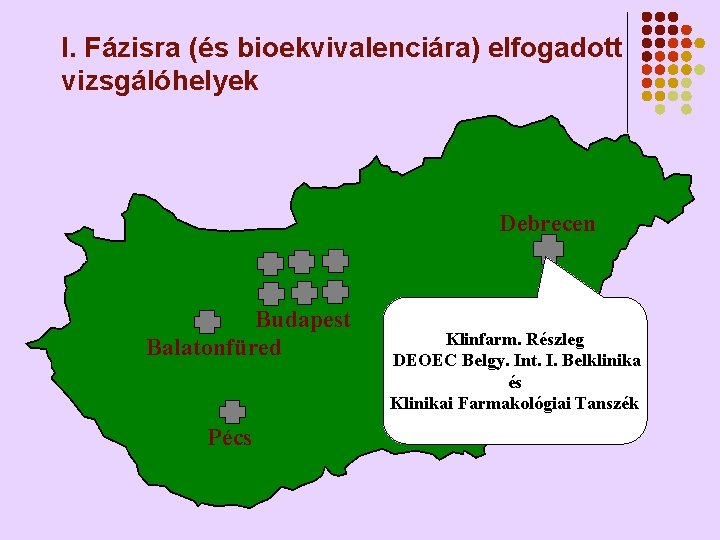
I. Fázisra (és bioekvivalenciára) elfogadott vizsgálóhelyek Debrecen Budapest Balatonfüred Pécs Klinfarm. Részleg DEOEC Belgy. Int. I. Belklinika és Klinikai Farmakológiai Tanszék

I fázisú vizsgálat: a vizsgálati készítmény tűrhetőségének, farmakokinetikájának, farmakodinámiás hatásának vizsgálata egészséges önkénteseken vagy a relatív ártalmatlanság szempontjából kedvezőtlen vizsgálati készítmény esetében a készítményre feltehetőleg jól reagáló betegeken

II. fázisú vizsgálat: a vizsgálati készítménynek a farmakológiai hatás alapján kiválasztott indikációban végzett vizsgálata, melynek célja a vizsgálati készítmény terápiás hatásának igazolása, a dózis-hatás összefüggés megállapítása, az optimálisnak tartható egyszeri és napi dózis meghatározása, a mellékhatások megfigyelése

III. fázisú vizsgálat: a vizsgálati készítmény biztonságos alkalmazhatóságának igazolására, nagyobb számú betegen, kontrollált, randomizált vizsgálati elrendezésében végzett vizsgálat, törzskönyvezett, hasonló indikációban alkalmazott gyógyszerekkel történő összehasonlító vizsgálat

IV. fázisú vizsgálat: a már törzskönyvezett, forgalomba hozatali engedéllyel rendelkező gyógyszert az elfogadott indikációban, az elfogadott dózistartományban, az elfogadott alkalmazási előírásnak megfelelően felhasználó vizsgálat, melynek célja a kockázat/haszon arányának további vizsgálata, az adagolás pontosítása, a ritkábban előforduló mellékhatások felismerése

Egyenértékűségi vizsgálat: a vizsgálati készítmény más gyógyszerrel való bioegyenértékűségének (farmakokinetikai eredmények alapján), farmakodinámiás vagy terápiás egyenértékűségének összehasonlító vizsgálata

Új terápiás indikációban történő vizsgálat: a forgalomba hozatali engedéllyel rendelkező gyógyszerkészítmény olyan klinikai vizsgálata, amely során eltérnek a jóváhagyott alkalmazási előírástól, az abban szereplő indikációtól, ezt II. vagy III. fázisú vizsgálatnak kell tekinteni

(1) Klinikai vizsgálatok célja -annak értékelése, hogy egy gyógyszer hasznos-e adott betegség, vagy állapot kezelésében, megelőzésében? -a kezeléssel járó mellékhatások és kockázat értékelése. A klinikai vizsgálatok végzésére kialakult szabályok (guideline) vannak, melyek részben általános érvényűek (GCP – ICH), részben adott szerekre (gyógyszerosztályokra) a korábbi vizsgálatok tapasztalatait felhasználva individuálisan is rendelkezésre állnak (www. fda. gov/cder/guidance/index. htm).

(2) Klinikai vizsgálatok célja Az új vegyületekre azonban nem feltétlenül alkalmazhatók változtatások nélkül esetleges korábbi vizsgálatok irányelvei, így minden vizsgálatra vonatkozóan individuálisan kell meghatározni a követendő eljárásokat (a gyógyszer adagolásának módja, dozírozása, a szükséges ellenőrző vizsgálatok típusa, rendje, stb. ) minden esetben szem előtt tartva a vizsgálati alany/páciens biztonságát, érdekét.

(3) Klinikai vizsgálatok célja A klinikai vizsgálatok lefolytatásában érdekelt minden fél (sponsor, vizsgáló, hatóság) számára fontos annak felismerése, hogy a gyógyszervizsgálatok végzése kapcsán egyrészt: objektív és helytálló eredményekhez jutva helyes döntés születhessen a vizsgált készítmények alkalmazhatóságáról, másrészt elengedhetetlen annak biztosítása, hogy a vizsgálati személyek/páciensek egészségét, biztonságát, személyiségi jogait károsodás, hátrány ne érje. (Helsinki deklaráció és módosításai)

(4) Klinikai vizsgálatok célja Bár a klinikai (gyógyszer)vizsgálatokra vonatkozó szabályok épp a biztonságosság garantálására (is) irányulnak, bizonyos kockázat fennáll a vizsgálati készítmények alkalmazása kapcsán, 100%-os biztonság nem garantálható. A klinikai vizsgálatok egyes fázisainak elkülönítése (I-IV) és egymást követő sorrendje azért is szükséges, mivel a korábbi (fázisú) vizsgálat(ok) eredménye(i) befolyásolják az újabb vizsgálatok tervezését, lefolytatását is.

(5 a) A klinikai vizsgálatok eredményes lefolytatásának feltételei • A vizsgálat céljának világos megfogalmazása. • Bevonási és kizárási kritériumok. Mi a vizsgált populáció kapcsolata a majdani kezelésben részesülő populációval (target betegpopuláció)? • Randomizációs eljárás. • A vizsgált populáció nagyságának meghatározása, mely függ: a vizsgálni kívánt válasz nagyságától fals pozitív reakciók mértékétől fals negatív reakciók mértékétől.

(5 b) A klinikai vizsgálatok eredményes lefolytatásának feltételei • Kontrollcsoport (placebo-, vagy aktív kontroll). • Ún. „vak” vizsgálat lehetőség szerinti végzése. („Bias” elkerülésére, mely jelentkezhet a vizsgáló, és a páciens részéről és a szelekciónál. ) • Objektív mérőmódszerek alkalmazása (GLP). • Azon paraméterek pontos definiálása, melyek változását követni kívánjuk. A mérés és kvantitálás objektivizálása.

(5 c) A klinikai vizsgálatok eredményes lefolytatásának feltételei • A protokoll szigorú betartása. A protokolltól való esetleges eltérés dokumentálása. (Deviation from protocol. ) • A vizsgálat korlátainak megfogalmazása. • A vizsgálat időtartamának meghatározása. • Compliance, dozírozás, farmakodinámia, farmako-kinetika, metabolizmus, mellékhatások, biztonság. • Adekvát statisztikai módszerek (a tervezéstől a végső jelentésig. )

(6 a) I. Fázis vizsgálatok Definíció: • Klinikai farmakológia • Az első humán alkalmazás vizsgálata. • Biztonságossági és tolerabilitás vizsgálat. • Másodlagos cél: farmakológiai/biológiai hatások, metabolizmus, kinetikai értékelés.

(6 b) I. Fázis vizsgálatok Vizsgálati személyek: • egészséges önkéntesek (normal volunteers) • n = 12 - 30 • többnyire férfiak, ritkán nők (pl. oralis antikoncipiens) • esetleg betegek (pl. ha etikai okok miatt a készítmény egészséges önkéntesnek nem adható: cytostaticumok, neuromusculáris blockerek, anesztetikumok) Vizsgáló: • klinikai farmakológus szakorvos Vizsgálati hely: • Fázis I. vizsgálat lefolytatására akkreditált vizsgálóhely

(7 a) Mit kell a vizsgálónak tudnia I. fázis vizsgálat előtt? • Preklinikai vizsgálatok eredményei: A vizsgálati készítmény fiziko-kémiai tulajdonságai, a használni kívánt formuláció, Primer és szekunder farmakológiai aktivitás állatokban Toxikológia és mutagenitás, ez alapján az alkalmazni kívánt dózis(ok) megalapozottsága, Farmakokinetika és metabolizmus állatokban, Az anyavegyület és a metabolitok elemzésére szolgáló módszerek szenzitivitására és specificitására vonatkozó adatok.

(7 b) Mit kell a vizsgálónak tudnia I. fázis vizsgálat előtt? • Klinikai vizsgálatok (ha van) Tolerabilitás (minden adverz reakció felsorolásával,

(8 a) Az első humán dózis meghatározásának nehézségei A fázis I. vizsgálatok elsődleges célja tolerabilitás vizsgálat, melyet bizonyos dózistartományon belül végzünk, dóziseszkalációs vizsgálatokban. A vizsgált dózistartomány feleljen meg a várható terápiás tartománynak – mely a farmakodinámiás hatás mértékét jelző biomarkerek/másodlagos változók módosulását eredményezi.

(8 b) Az első humán dózis meghatározásának nehézségei Első humán alkalmazás dózisa: Törtrésze a preklinikai toxicologiai vizsgálatokban meghatározott Maximum No Effect Dose-nak. Dózis-eszkaláció: Dózis duplázás: pl. 2 – 4 – 8 – 16 mg Lineáris dózis növelés: pl. 100– 200– 300– 400 mg (különösen a dózistartomány felső értékeinél). Praktikus korlátozó szempontok: hány alkalommal szükséges az önkéntesek bennfekvése, a vizsgálat időtartama, a szükséges vérmennyiség, kimosási periódus hossza, a dózislépcsők száma, stb.

(8 c) Az első humán dózis meghatározásának nehézségei Maximális tolerálható dózis (MTD) meghatározása: Szűk terápiás indexű szereknél

(8 d) Az első humán dózis meghatározásának nehézségei Vizsgálati elrendezés: Paralell (hátránya: hamar nyilvánvalóvá válik a placebo-csoport, így a vizsgálat unblind-dá válik. ) Cross-over Placebo-kontrollos (bizonyos esetekben elhagyható, nyílt vizsgálat) Lényeg: hogy minden vizsgálati személy minden dózist ill. a placebot megkapja legalább egyszer.

(9 a) A humán vizsgálatokat vezérlő legfőbb elv: a kockázatok minimalizálása! Ezt biztosíthatjuk, ha: • az egészséges önkéntesek valóban megfelelnek a vizsgálatban való részvétel kritériumainak, • az orvosi/nővéri felügyelet folyamatosan biztosított, • a személyzet létszáma és ismeretei/informáltsága megfelelő, • a gyógyszer adagolása ellenőrzött,

(9 b) A humán vizsgálatokat vezérlő legfőbb elv: a kockázatok minimalizálása! • a preklinikai és klinikai adatok alapján az induló dózis és a dózis-eszkaláció megválasztása megfelelő, • megfelelő a vitális paraméterek ellenőrzésének gyakorisága, az adverz események felismerése és a biztonsági rendszabályok alkalmazása, • az adverz események elhárítása és az újabbak felléptének elkerülése biztosított, • lehetőség van a vizsgálat során nyert adatok időközi elemzésére, • az utánkövetési periódusban az ellenőrző orvosi és laboratóriumi vizsgálatok adottak.

(10 a) II. Fázis klinikai vizsgálatok Definíció: Klinikai vizsgálat (Clinical Investigation) Kontrollált (többnyire placeboval) vizsgálat a farmakológiai hatékonyság és relatív biztonságosság igazolására.

(10 b) II. Fázis klinikai vizsgálatok Vizsgálati személyek: A befolyásolni kívánt betegségben szenvedő pontosan definiált, szorosan monitorozott betegpopuláció. n = 100 – 200 Lehetőség szerint ne szenvedjenek súlyos hematológiai, cardiovasculáris, idegrendszeri betegségben, máj-, és veseelégtelenségben és ne részesüljenek egyidejűleg más gyógyszeres kezelésben.

(10 c) II. Fázis klinikai vizsgálatok Vizsgáló: az adott betegség kezelésében jártas szakember, lehetőleg klinikai farmakológiai jártassággal/képesítéssel. Vizsgálóhely: az adott betegség kezelésében elismert centrum.

(10 d) II. Fázis klinikai vizsgálatok Fázis II vizsgálatban az ellenőrző vizitek, ill. laboratóriumi kontrollok gyakorisága a vizsgálati készítmény, ill. az adott betegség (acut, subacut, vagy chronikus) függvénye. Chronicus betegség esetén az ellenőrző vizitek gyakorisága kezdetben lehetőség szerint hetente, 6 -8 héten át kéthetente, majd három hónapon át havonta, azt követően kéthavonta elégséges.

(10 e) II. Fázis klinikai vizsgálatok A biztonságosság ellenőrző vizsgálatai: • vitális paraméterek: RR, pulzus, EKG • laboratórium: vérkép (quantitativ, qualitativ), Thrc. szám, alvadási paraméterek, elektrolitek, máj- és vesefunkciós paraméterek. Amennyiben egyes fázis vizsgálatok között a formulációban érdemleges változtatás történik a gyártó részéről, akkor elengedhetetlen a biológiai hozzáférhetőség (bioavailability, absorbció, exkréció) vizsgálata.

(11 a) Fogamzóképes korú nők bevonása klinikai vizsgálatokba I. , ill. korai II. fázisban lehetőleg kerülendő. Ha már rendelkezésre állnak a reproduktív toxicitási vizsgálatok (mutagenitás, genotoxicitás, foetotoxicitás, teratogenitás) akkor körültekintéssel lehetséges. Amennyiben fogamzóképes korú női betegek is bevonásra kerülnek, terhességi teszt végzése javasolt a gyógyszer adagolásának megkezdése előtt, ill. felvilágosítás a nemkívánatos terhesség elkerülésének módjairól.

(11 b) Fogamzóképes korú nők bevonása klinikai vizsgálatokba A szisztémásan felszívódó szerek esetében feltételezni kell a placentán történő átjutást, ill. az anyatejjel történő kiválasztódást mindaddig, míg az ellenkezője nem bizonyított.

(11 c) Gyermekek bevonása klinikai vizsgálatokba Gyermekeken végzett vizsgálatokra külön szabályok vonatkoznak. A szülői (törvényes képviselő) beleegyezése elengedhetetlen. Gyermekeken akkor végeznek vizsgálatokat többnyire, ha felnőtt fázis II. , III. vizsgálatokban kellő mennyiségű adat áll rendelkezésre. A vizsgálatok előbb inkább idősebb gyermekeken végzendők, csak azt követően a fiatalabb életkorúakon, csecsemőkön, esetleg koraszülötteken.

(12 a) III. fázisú vizsgálat Igazi klinikai vizsgálat. Célja: az adott betegcsoport kezelése (összehasonlítás másik elfogadott kezeléssel).

(12 b) IV. fázisú vizsgálat • Post market vizsgálat • Ritkább mellékhatások vizsgálata • Tényleges hatásosság vizsgálatok

KLINIKAI VIZSGÁLATOK MÓDSZERTANA l l Exact körülmények, kontrollált vizsgálatok Randomizálás Pivotal vizsgálat Kontrollált, randomizált, kettősvak vizsgálat

BETEGTÁJÉKOZTATÁS ÉS BELEEGYEZÉS l l l Gyógyszervizsgálat csak megfelelő tájékoztatás és beleegyezés után Vizsgálat célja, módszerei, időtartama, technikája, alternatív kezelési lehetőségek, felelősség, biztonság, mellékhatások, szövegkörnyezet, idő Beleegyező nyilatkozat (IC) Hatósági jóváhagyás, egységes tartalom, kötelezettség Várható előny maximalizálása, veszélyek minimalizálása Vulnerabilis betegcsoportok: mentálisan érintett eszméletlen beteg, gyermekek, terhes nők, szoptató anyák

ETIKAI BIZOTTSÁGOK l l l Orvosbiológiai kutatást csak független etikai bizottságok jóváhagyásával Hazai törvényes háttér 35/2005 EüM rendelet részletesen szabályozza a klinikai vizsgálatok minden kérdését Az EU irányelveire épül

KLINIKAI VIZSGÁLAT l l l l Vizsgálati terv (Protokoll) CRF (Egyedi Adatlap) Biztosítás Randomizáció Klinikai vizsgálóhelyek követelményei (GCP) Klinikai vizsgálók követelményei Adatkezelés, statisztika, klinikai jelentés

A KLINIKAI FARMAKOLÓGIA TÖRTÉNETE A DEOEC-EN Hálózat: - I. Belklinika - Nőgyógyászati Klinika CPRC: - 1993 (DOTE Gyógyszertan) CPU: - 1979, 1995 (DOTE I. Belklinika) PRS - 1995 CRO DEOEC GYTK Klinikai Farmakológiai Tanszék - 2001

Nitroglicerin/Placebo tapasz – OGTT („Proof of concept” vizsgálat) n=20 Placebo tapasz Nitroglicerin tapasz * * n=20 * * * P<0, 05 Kovács P. et al: Eur. J. Clin. Invest. ; 30: 41 -44, 1999

KLINIKAI FARMAKOLÓGIAI VIZSGÁLATOK l l Az EVB-megköveteli a nagy létszámú, homogén populáción végzett, statisztikailag bizonyítékot jelentő klinikai vizsgálatokat Nemzetközi egységes szabályok (ICH-GCP) Bizonyító vizsgálatok a gyógyszerfejlesztési ciklusok végpontjain (preklinikai és humán) Törzskönyvezés, hatósági engedélyezés csak megfelelő bizonyítékok alapján

„MEGA TRIAL” VIZSGÁLATOK JELENTŐSÉGE l Bizonyítékon alapuló orvoslás (EVB) – igazi bizonyíték csak nagy számú esettel (Jellegzetes példa: ISIS-4 vizsgálat) ISIS-4: (Fourth International Study of Infarct Survival) Collaborative Group: ISIS-4: A randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58 050 patients with suspected acute myocardial infarction Lancet: 1995, 345: 669 -685

ISIS-4 Betegszám: Dg: Vizsgálóhely: 58 500 AMI (24 órán belül) 1086 R. Th. : 30 napos p. o. captopril v. plac. R. Th. : 30 napos p. o. mononitrát v. plac. R. Th. : 24 órás iv Mg. S 04 infuzió

EFFECTS ON SHORT-TERM MORTALITY OF STARTING IV MAGNESIUM EARLY IN AMI LANCET, 345, 669 -685, 1995 Randomised comparison Deaths/patients Magnesium (% dead) Control 9 small trials 42/754 (5. 6%) 86/740 (11. 6%) LIMIT-2 90/1159 (7. 8%) 118/1157 (10. 2%) ISIS-4 2216/29011 (7. 6%) 2103/29039 (7. 2%) ALL TRIALS 2348/30924 (7. 59%) Odds ratio & Cl Magnesium better 2. 0% (SD 3. 1) odds increase; N. S. 2307/30936 (7. 46%) 1. 4 (SD 2. 1) extra deaths per 1000 treated Control better 0. 5 0. 75 1. 0 1. 25

EFFECTS ON SHORT-TERM MORTALITY OF STARTING NITRATES EARLY IN AMI LANCET, 345, 669 -685, 1995 Randomised comparison Deaths/patients Nitrates (% dead) Control 11 small iv trials 190/1505 (12. 6%) 232/1500 (15. 5%) 9 small oral trials 76/998 (7. 6%) 91/960 (9. 5%) GISSI-3 -N vs nll 332/4731 (7. 0%) 341/4729 (7. 2%) -N+CEI vs CEI 285/4722 (6. 0%) 312/4713 (6. 6%) ISIS-4 -N vs nll 1085/14519 (7. 5%) 1044/14499 (7. 2%) 1146/14503 (7. 9%) 1044/14529 (7. 2%) 3012/40974 (7. 35%) 3166/40934 (7. 73%) -N+CEI vs CEI ALL TRIALS 3. 8 (SD 1. 8) fewer deaths per 1000 treated Odds ratio & Cl Control better Nitrates better 5. 5% (SD 2. 6) odds reduction; 2 p=0. 03 0. 5 0. 75 1. 0 1. 25

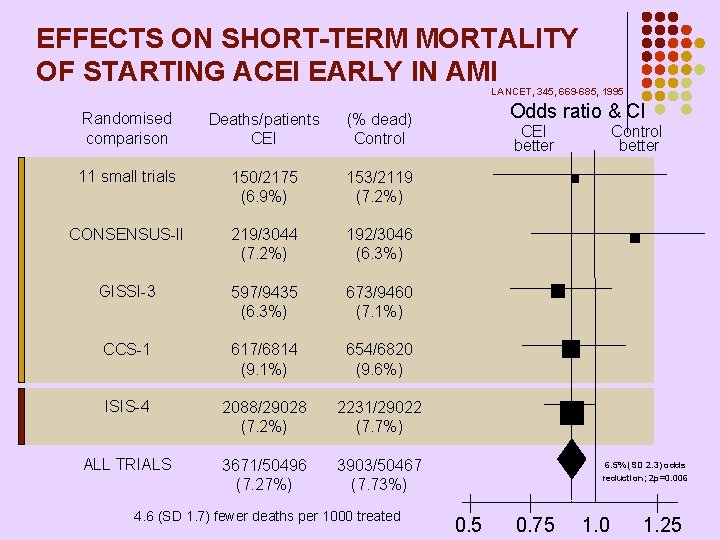
EFFECTS ON SHORT-TERM MORTALITY OF STARTING ACEI EARLY IN AMI LANCET, 345, 669 -685, 1995 Odds ratio & Cl Randomised comparison Deaths/patients CEI (% dead) Control 11 small trials 150/2175 (6. 9%) 153/2119 (7. 2%) CONSENSUS-II 219/3044 (7. 2%) 192/3046 (6. 3%) GISSI-3 597/9435 (6. 3%) 673/9460 (7. 1%) CCS-1 617/6814 (9. 1%) 654/6820 (9. 6%) ISIS-4 2088/29028 (7. 2%) 2231/29022 (7. 7%) ALL TRIALS 3671/50496 (7. 27%) 3903/50467 (7. 73%) 4. 6 (SD 1. 7) fewer deaths per 1000 treated CEI better Control better 6. 5% (SD 2. 3) odds reduction; 2 p=0. 006 0. 5 0. 75 1. 0 1. 25

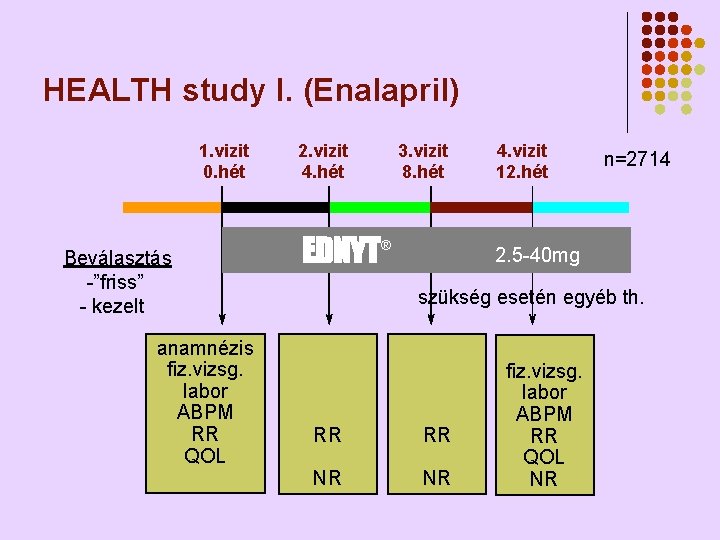
HEALTH study I. (Enalapril) 1. vizit 0. hét Beválasztás -”friss” - kezelt anamnézis fiz. vizsg. labor ABPM RR QOL 2. vizit 4. hét 3. vizit 8. hét EDNYT® 4. vizit 12. hét n=2714 2. 5 -40 mg szükség esetén egyéb th. RR RR NR NR fiz. vizsg. labor ABPM RR QOL NR

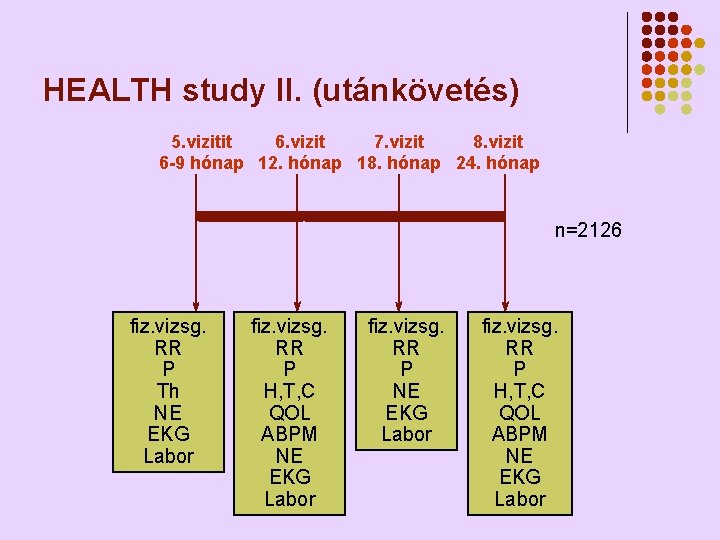
HEALTH study II. (utánkövetés) 5. vizitit 6. vizit 7. vizit 8. vizit 6 -9 hónap 12. hónap 18. hónap 24. hónap n=2126 fiz. vizsg. RR P Th NE EKG Labor fiz. vizsg. RR P H, T, C QOL ABPM NE EKG Labor

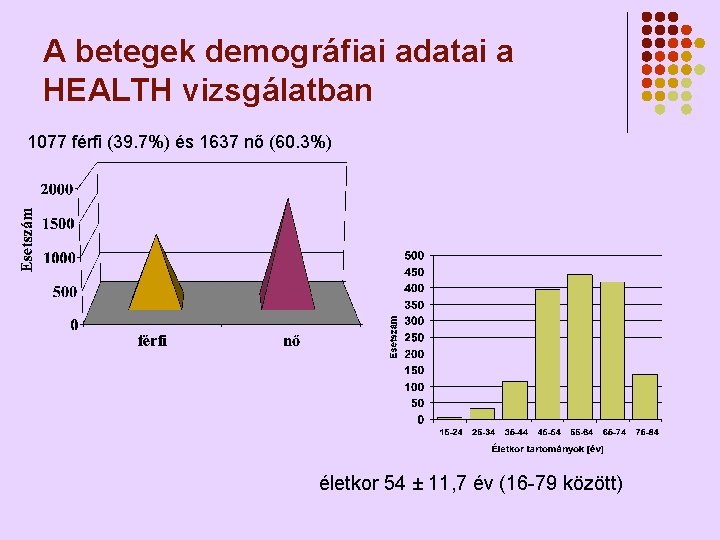
A betegek demográfiai adatai a HEALTH vizsgálatban 1077 férfi (39. 7%) és 1637 nő (60. 3%) életkor 54 ± 11, 7 év (16 -79 között)

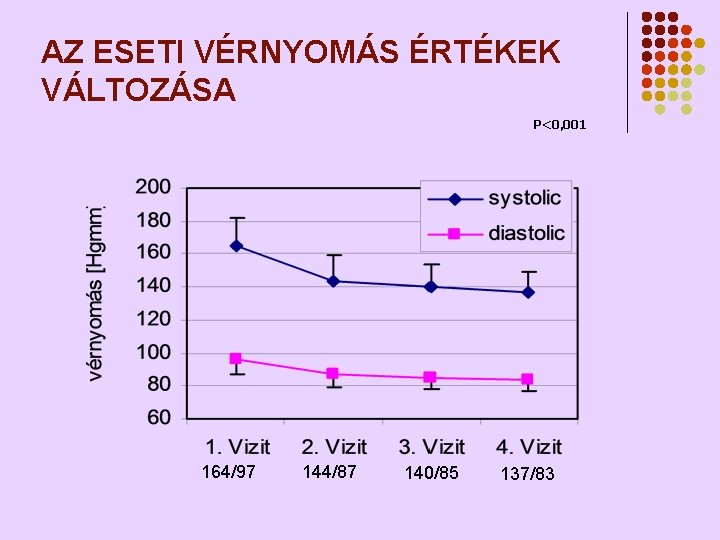
AZ ESETI VÉRNYOMÁS ÉRTÉKEK VÁLTOZÁSA P<0, 001 164/97 144/87 140/85 137/83

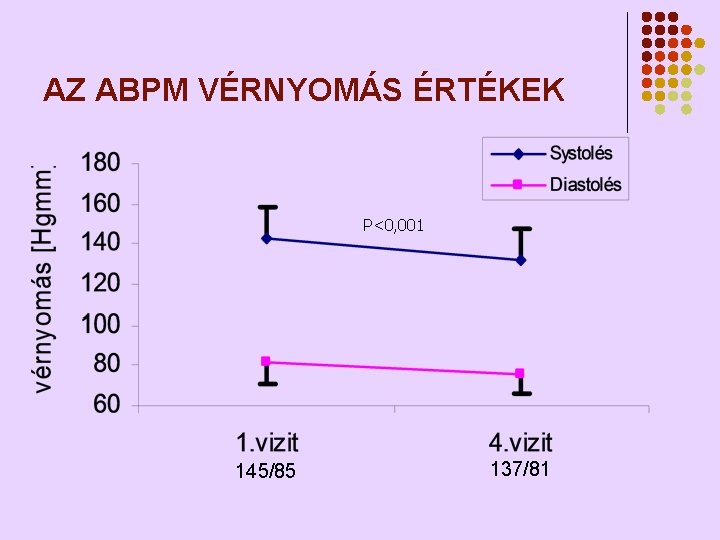
AZ ABPM VÉRNYOMÁS ÉRTÉKEK P<0, 001 145/85 137/81

pontérték ÉLETMINŐSÉG (QL) JAVULÁSA AZ ENALAPRIL KEZELÉS SORÁN

Ednyt kezelés naponta 1× vagy 2× (1× 10 mg vs. 2× 5 mg vagy 1× 20 mg vs. 2× 10 mg) 1. vizit 4. vizit Napi 1 x n=1434 NS 1. vizit 4. vizit Napi 2 x n=1098

Az eseti vérnyomásátlagok a „crossover” során a két (n=190) kezelési csoportban (azonos napi enalapril dózisok 1×-i vagy 2×-i alkalmazása)

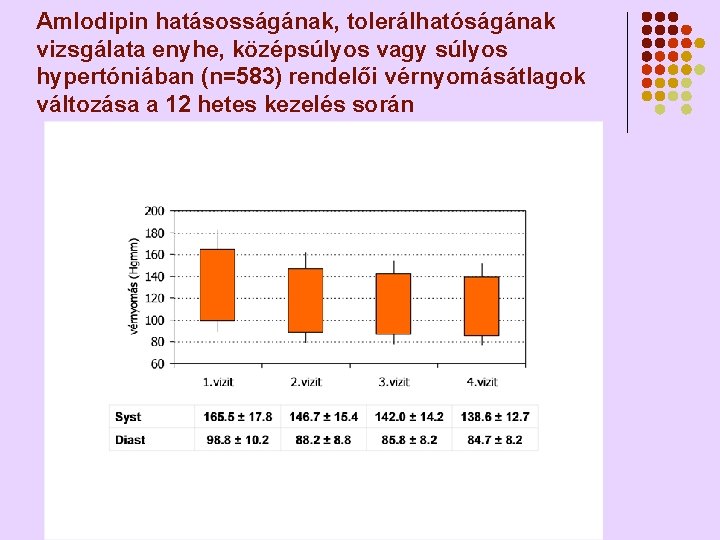
Amlodipin hatásosságának, tolerálhatóságának vizsgálata enyhe, középsúlyos vagy súlyos hypertóniában (n=583) rendelői vérnyomásátlagok változása a 12 hetes kezelés során

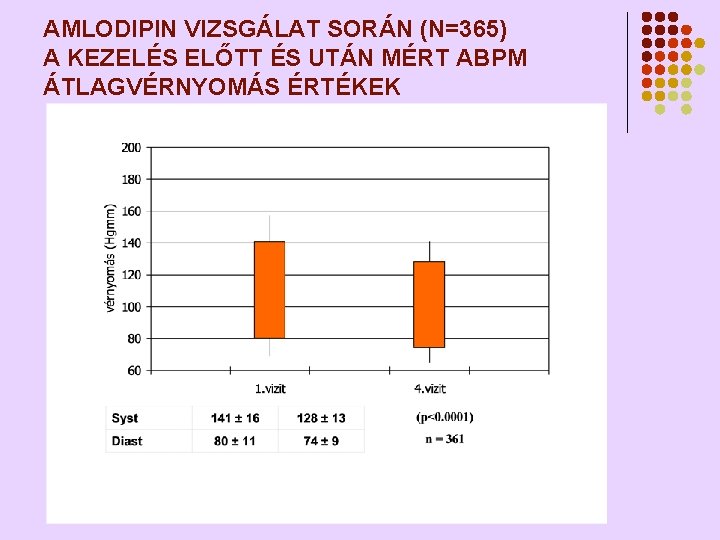
AMLODIPIN VIZSGÁLAT SORÁN (N=365) A KEZELÉS ELŐTT ÉS UTÁN MÉRT ABPM ÁTLAGVÉRNYOMÁS ÉRTÉKEK

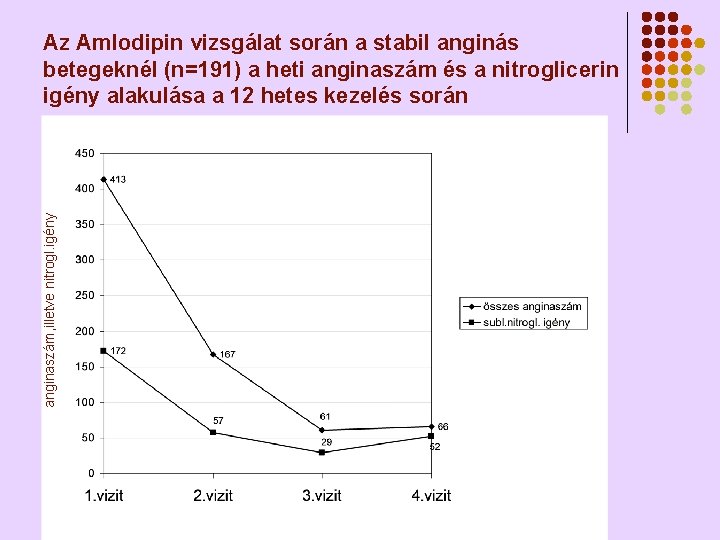
anginaszám, illetve nitrogl. igény Az Amlodipin vizsgálat során a stabil anginás betegeknél (n=191) a heti anginaszám és a nitroglicerin igény alakulása a 12 hetes kezelés során

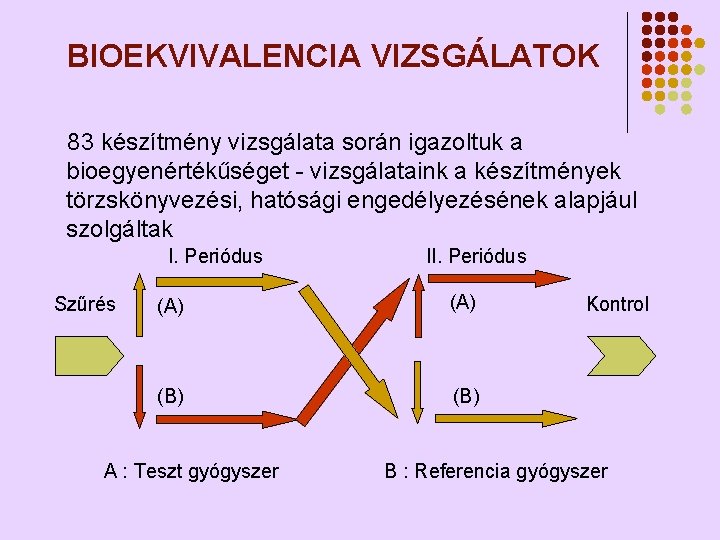
BIOEKVIVALENCIA VIZSGÁLATOK 83 készítmény vizsgálata során igazoltuk a bioegyenértékűséget - vizsgálataink a készítmények törzskönyvezési, hatósági engedélyezésének alapjául szolgáltak I. Periódus Szűrés II. Periódus (A) (B) A : Teszt gyógyszer Kontrol B : Referencia gyógyszer

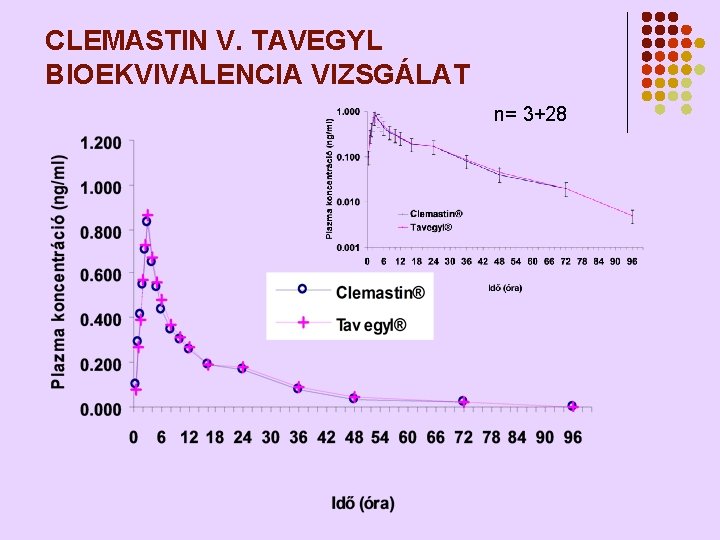
CLEMASTIN V. TAVEGYL BIOEKVIVALENCIA VIZSGÁLAT n= 3+28

MEFLOQUIN (M) BIOEKVIVALENCIA VIZSGÁLAT (1. ) 1. Közlemények a generikus mefloquin rosszabb hatásáról a Lariam -mal szemben egyes súlyosabb maláriás esetekben (Thaiföld) 2. Egészséges önkénteseken bioekvivalencia nem igazolódott (Eur J. Clin. Pharmacol. )

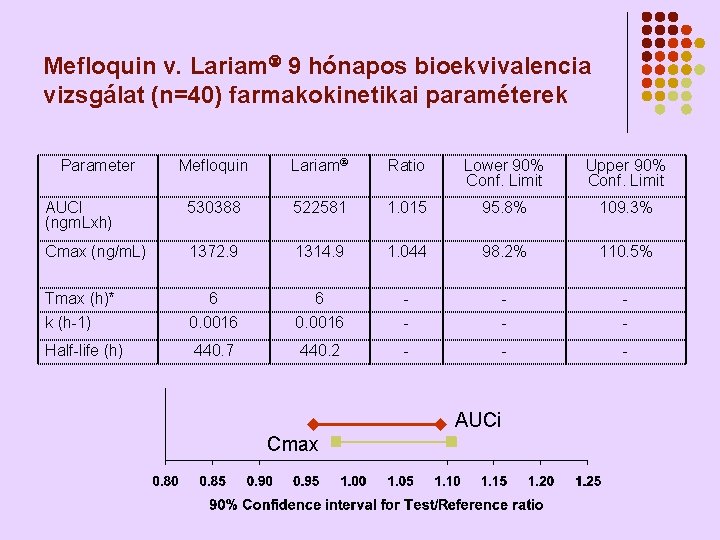
MEFLOQUIN (M) BIOEKVIVALENCIA VIZSGÁLAT (2. ) l l l „Bioavailability” vizsgálatunk (éhgyomorra és zsíros étkezés után) Javaslatunkra formuláció változtatás. 4 különböző formulációból bioavailability vizsgálattal (pilot study) kiválasztottuk a legideálisabbat. 40 önkéntessel végzett 9 hónapos (3 hónap első periódus, 3 hónap wash-out, 3 hónap második periódus) igazoltuk az új formuláció bioegyenértékűségét

Mefloquin v. Lariam 9 hónapos bioekvivalencia vizsgálat (n=40) farmakokinetikai paraméterek Mefloquin Lariam Ratio Lower 90% Conf. Limit Upper 90% Conf. Limit AUCI (ngm. Lxh) 530388 522581 1. 015 95. 8% 109. 3% Cmax (ng/m. L) 1372. 9 1314. 9 1. 044 98. 2% 110. 5% Tmax (h)* k (h-1) 6 0. 0016 - - - Half-life (h) 440. 7 440. 2 - - - Parameter AUCi Cmax

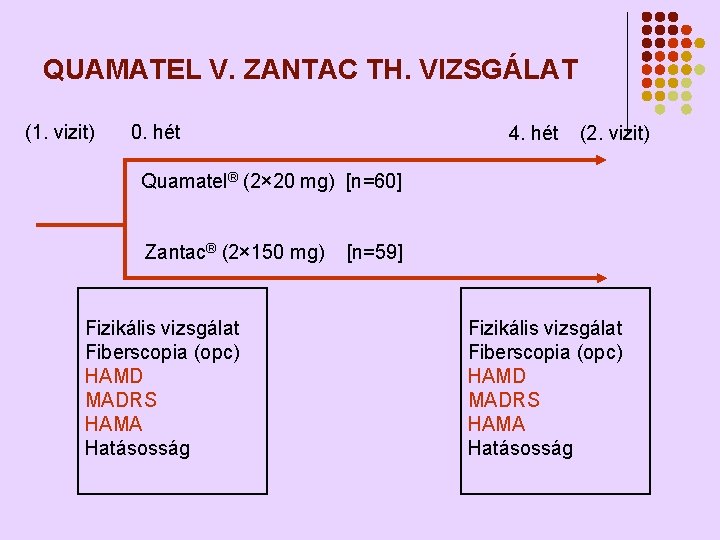
KLINIKAI FARMAKOLÓGIAI VIZSGÁLATTAL FELTÁRT ÚJ INDIKÁCIÓS TERÜLET Famotidin (Quamatel®) th. antidepresszív hatása l l A 4 hetes Quamatel® és Zantac® th. összehasonlítása a depressziót mérő (HAMD és MADRS) skálán elért változásokat illetően dyspepsiás betegeken. A szorongás megítélése Hamilton skálán (HAMA) 119 (60 -59) kezelt beteg (Nő: Férfi = 63: 56)

QUAMATEL V. ZANTAC TH. VIZSGÁLAT (1. vizit) 0. hét 4. hét (2. vizit) Quamatel® (2× 20 mg) [n=60] Zantac® (2× 150 mg) Fizikális vizsgálat Fiberscopia (opc) HAMD MADRS HAMA Hatásosság [n=59] Fizikális vizsgálat Fiberscopia (opc) HAMD MADRS HAMA Hatásosság

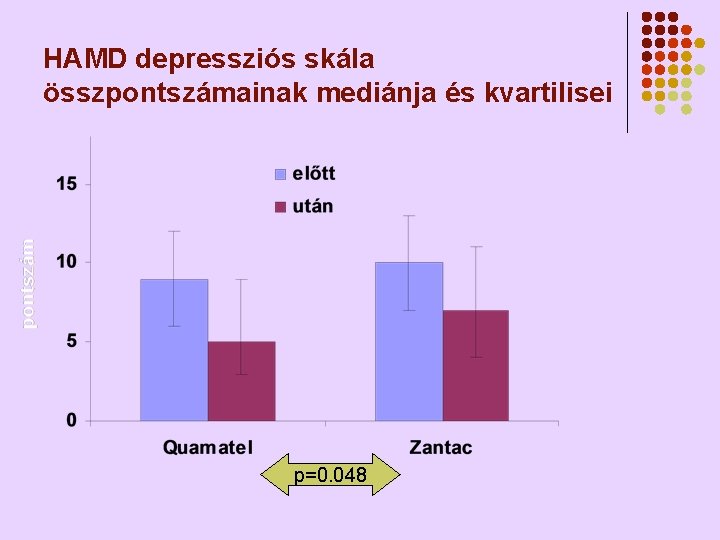
HAMD depressziós skála összpontszámainak mediánja és kvartilisei p=0. 048

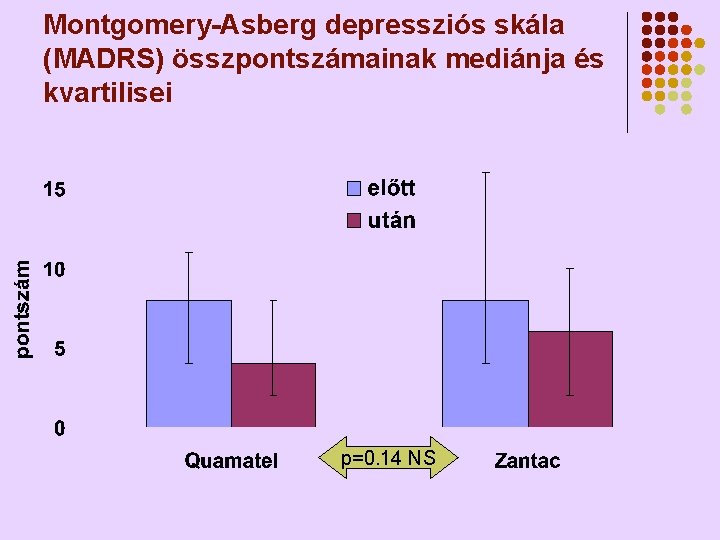
Montgomery-Asberg depressziós skála (MADRS) összpontszámainak mediánja és kvartilisei p=0. 14 NS

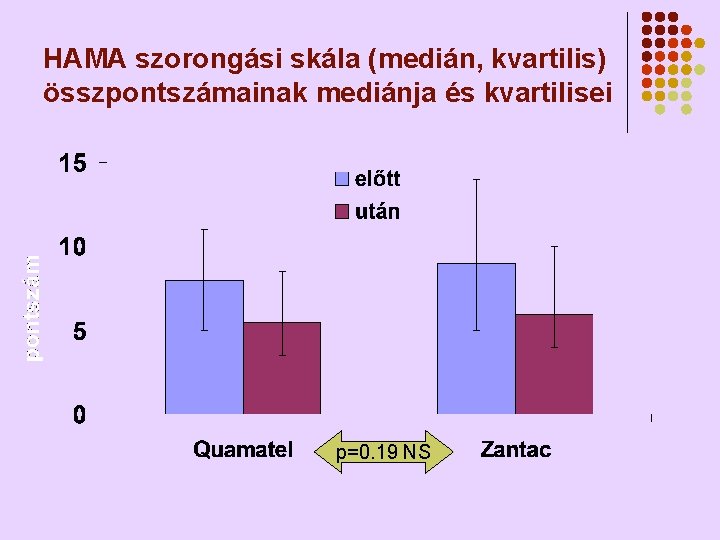
HAMA szorongási skála (medián, kvartilis) összpontszámainak mediánja és kvartilisei p=0. 19 NS

Quamatel v. Zantac th. hatása a depressziót mérő skálákra l l l Szignifikánsan csökkentek a HAMD, MADRS és a HAMA skálákon mért értékek (p<0. 001) Mindkét depressziós skálán az összpontszámok csökkenése (javulás) a Quamatel® th. mellett nagyobb volt mint Zantac® th. -nál (HAMD p=0. 048, MADRS p=0. 14) Egyértelműen igazolódott a famotidin inherens antidepresszív hatása - szabadalom






























