Klinik adan lsemi genetii ve kemik ilii yetmezlii























































- Slides: 81

Klinik açıdan lösemi genetiği ve kemik iliği yetmezliği sendromları Dr. Nüket Yürür Kutlay Bu sunumda Prof. Dr. Ajlan Tükün’ün görselllerinden de yararlanılmıştır

ANEMİLER • Hemoglobinopailer – Orak hücreli – Talasemi • Kemik iliği Yetmezliği (BMF) – Miyelodisplastik Sendrom (MDS) – Aplastik anemi (AA)

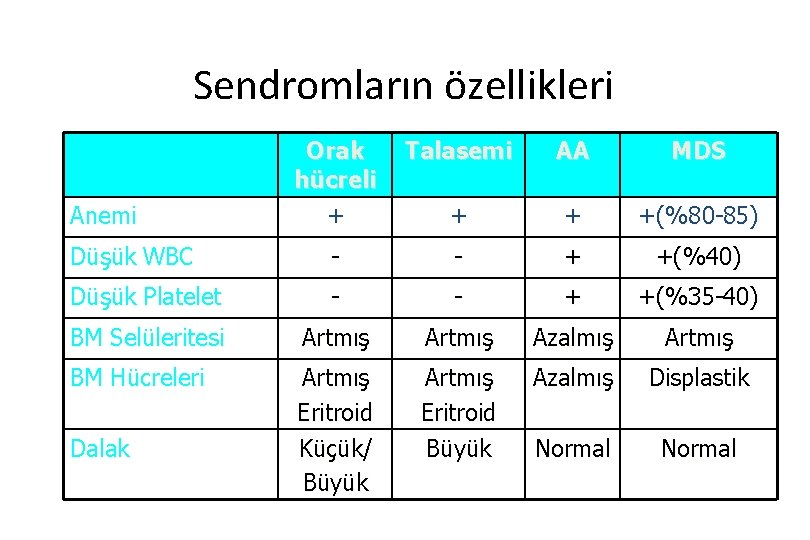
Sendromların özellikleri Orak hücreli + Talasemi AA MDS + + +(%80 -85) Düşük WBC - - + +(%40) Düşük Platelet - - + +(%35 -40) BM Selüleritesi Artmış Azalmış Artmış BM Hücreleri Artmış Eritroid Küçük/ Büyük Artmış Eritroid Büyük Azalmış Displastik Normal Anemi Dalak

Tanımlar • Aplastik Anemi (AA) – Pansitopeni – Hiposelülar Kİ • Miyelodisplastik Syendrom (MDS) – Hiperselülar Kİ ile birlikte sitopeni • Akut Lösemi (AL) – İmmatur hücrelerin malign proliferasyonu

Kemik iliği yetmezlik hastalıkları • Miyelodisplastik Sendrom • Aplastik anemi

Myelodisplastik Sendrom (MDS) • • Klonal hastalık grubu Neoplastik Refraktor anemi(Makrositer) AML potansiyeli

MDS etyolojisi Kalıtılabilir Kazanılmış • Yapısal genetik bozukluklar (tri 21, tri 8 mozaikliği, ailesel monozomi 7) • Nörofibromatosis • Germ hücre tümörleri • Kongenital nötropeni (Kostmann sendromu, Shwachman. Diamond sendromu) • DNA tamir bozuklukları (Fanconi anemisi…) • Detoks. enzim mutasyonu • Yaş • Kemoterapi(alkilleyici ajanlar, topoizomeraz inhibitörleri, nükleosid analogları) ve HSCT • G-CSF • Radyoterapi • Çevresel/mesleki toksin • Tütün • Alkol • AA ve Paroksismal nokturnal hemoglobinüri

Geçmiş FAB sınıflaması RA: refraktor anemi, < % 5 blast RARS: RA ve > % 15 “ringed” sideroblast RAEB: RA ve “excess” blasts, % 5 -20 blast RAEBi. T: Transformasyonda RAEB, % 21 -30 blast CMML: kronik myelomonositik lösemi, PB monosit >1000/m. L • AML: > %30 blast • • •

Günümüzde WHO sınıflaması • RA: eritroid displasi, < % 5 blasts • RCMD: refraktor sitopeni ve “multilineage” displasi, < % 5 blasts • MDS-U: sınıflandırılamayan • 5 q- sendromu MDS • RARS: RA ve > % 15 “ringed” sideroblast • RSCMD: RCMD ve “ringed” sideroblast • RAEB-1: % 5 -9 blast • RAEB-2: % 10 -19 blast • AML: > % 20 blast

Günümüzde IPSS Sınıflaması ( Uluslararası Prognostik Skorlama Sistemi) Skor Prognostik Değişken 0 0. 5 1. 0 1. 5 2. 0 BM blast % <5 5 -10 - 11 -20 21 -30 Karyotip* İyi Ara form Kötü - - Sitopeni** 0 -1 2 -3 - - - *İyi: normal, -Y, 5 q-, 20 q- Araform: Diğer Kötü: 7 anomalisi ya da anomali sayısı >3 **Hb <10 g/d. L ANC(=Absolut Nötrofil Sayısı) <1800/u. L Plat <100, 000/u. L 0=>iyi risk grubu 0, 5 -1=> ara risk grubu-1 1, 5 -2=> ara risk grubu-2 ≥ 2, 5=> yüksek risk grubu

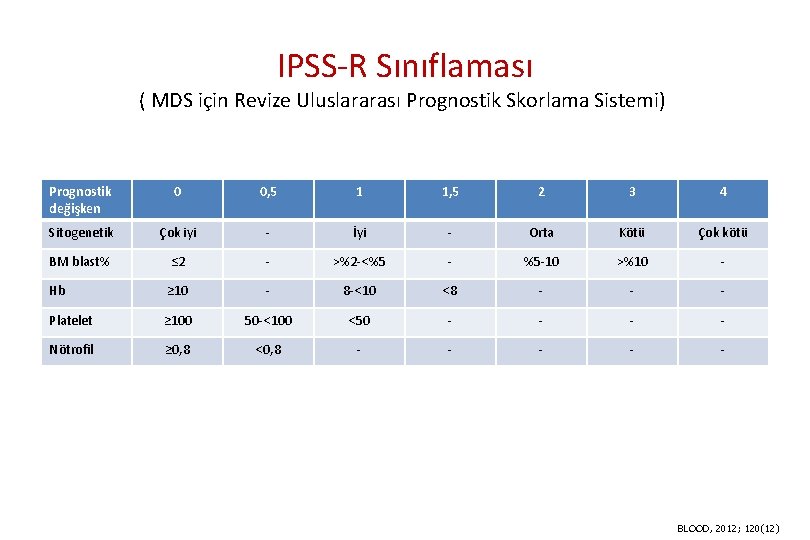
IPSS-R Sınıflaması ( MDS için Revize Uluslararası Prognostik Skorlama Sistemi) Prognostik değişken 0 0, 5 1 1, 5 2 3 4 Sitogenetik Çok iyi - İyi - Orta Kötü Çok kötü BM blast% ≤ 2 - >%2 -<%5 - %5 -10 >%10 - Hb ≥ 10 - 8 -<10 <8 - - - Platelet ≥ 100 50 -<100 <50 - - Nötrofil ≥ 0, 8 <0, 8 - - - BLOOD, 2012; 120(12)

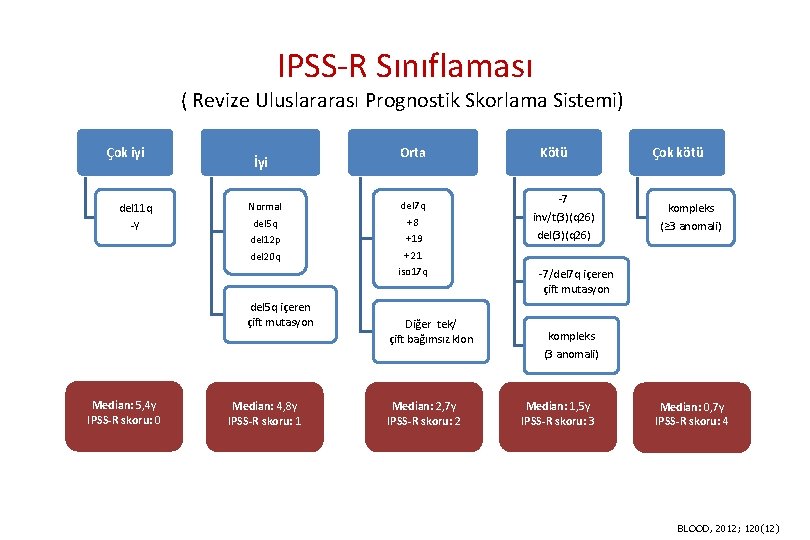
IPSS-R Sınıflaması ( Revize Uluslararası Prognostik Skorlama Sistemi) Çok iyi del 11 q -Y İyi Normal del 5 q del 12 p del 20 q del 5 q içeren çift mutasyon Median: 5, 4 y IPSS-R skoru: 0 Median: 4, 8 y IPSS-R skoru: 1 Orta del 7 q +8 +19 +21 iso 17 q Diğer tek/ çift bağımsız klon Median: 2, 7 y IPSS-R skoru: 2 Kötü -7 inv/t(3)(q 26) del(3)(q 26) Çok kötü kompleks (≥ 3 anomali) -7/del 7 q içeren çift mutasyon kompleks (3 anomali) Median: 1, 5 y IPSS-R skoru: 3 Median: 0, 7 y IPSS-R skoru: 4 BLOOD, 2012; 120(12)

MDS tedavisi – Radikal: Kök hücre transplantasyonu – Destekleyici: Transfüzyonlar, Eritropoetin, G-CSF – Immün-supresyon: steroid, antitimosit globulin, siklosporin – Kemoterapi: Cytarbine, Mylotarg – Metil transferaz inhibitorleri: 5 -Azacitidine

Aplastik Anemi • Anemi (düşük Hb, Hct) – yorgunluk, güçsüzlük, dispne • Trombositopeni (düşük platelet) – morarma, peteşi – kanama • Nötropenia (düşük nötrofil) – enfeksiyon

Aplastik Anemi • Ağır – Aşağıdakilerden ikisi + nötrofil <500 platelet <20. 000 retikülosit <20. 000 – BM selüleritesi <25% hematopoetik hücreler < 30% • Çok ağır – nötrofil <200 • Ilımlı

Aplastik Anemi • Edinsel – İlaç, toksin ve hepatit gibi çevresel ajanlar sorumlu tutulurdu. – Günümüzde olası genetik yatkınlıklar tartışılıyor – Kimyasallar ve ilaç detoksifikasyonunda rol oynayan proteinleri kodlayan genlerdeki polimorfizmlerin aydınlatılması bekleniyor. • Kalıtsal – Geçmişte iyi huylu hematolojik hastalıklar olarak bilinirlerdi – Bugün kanser için yüksek risk taşıdıkları biliniyor – Gelecekte genotip/fenotip/kanser ilişkisinin aydınlatılması bekleniyor

Edinsel Aplastik Anemi • • İlaçlar Kimyasallar Viruslar İmmün hastalıklar Paroksismal nokturnal hemoglobinuri (PNH) Gebelik İDİOPATİK

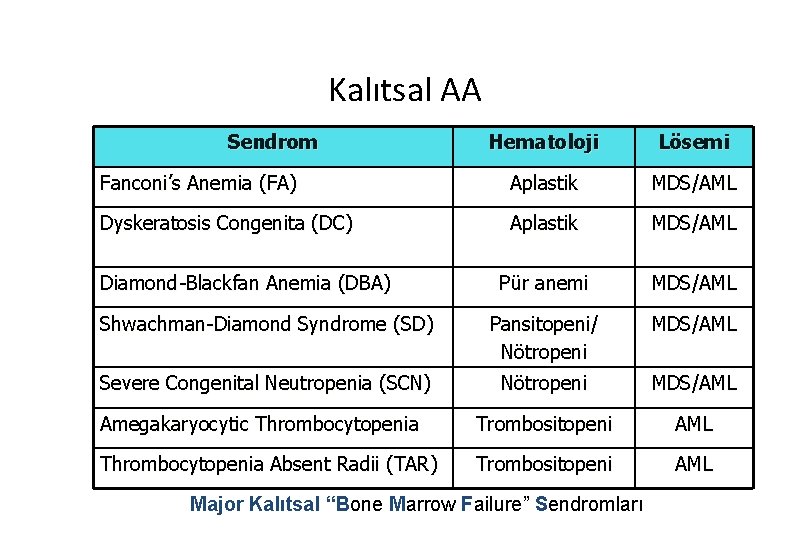
Kalıtsal AA Sendrom Hematoloji Lösemi Fanconi’s Anemia (FA) Aplastik MDS/AML Dyskeratosis Congenita (DC) Aplastik MDS/AML Pür anemi MDS/AML Shwachman-Diamond Syndrome (SD) Pansitopeni/ Nötropeni MDS/AML Severe Congenital Neutropenia (SCN) Nötropeni MDS/AML Amegakaryocytic Thrombocytopenia Trombositopeni AML Thrombocytopenia Absent Radii (TAR) Trombositopeni AML Diamond-Blackfan Anemia (DBA) Major Kalıtsal “Bone Marrow Failure” Sendromları

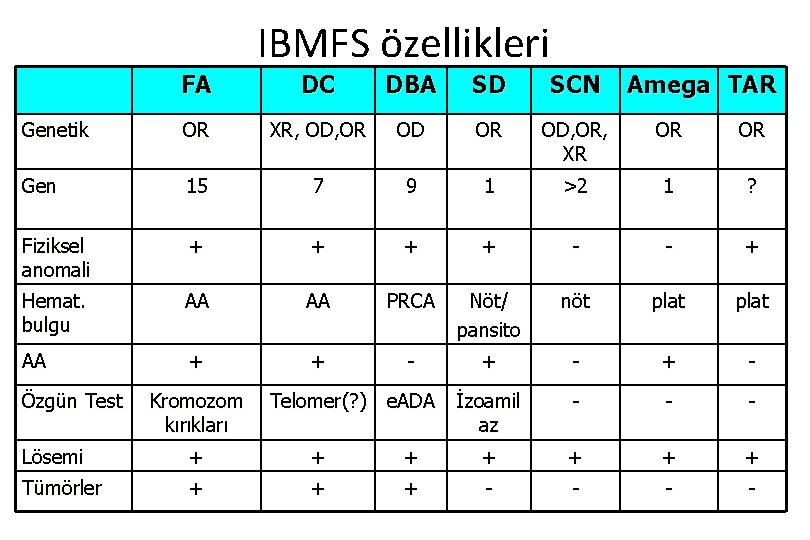
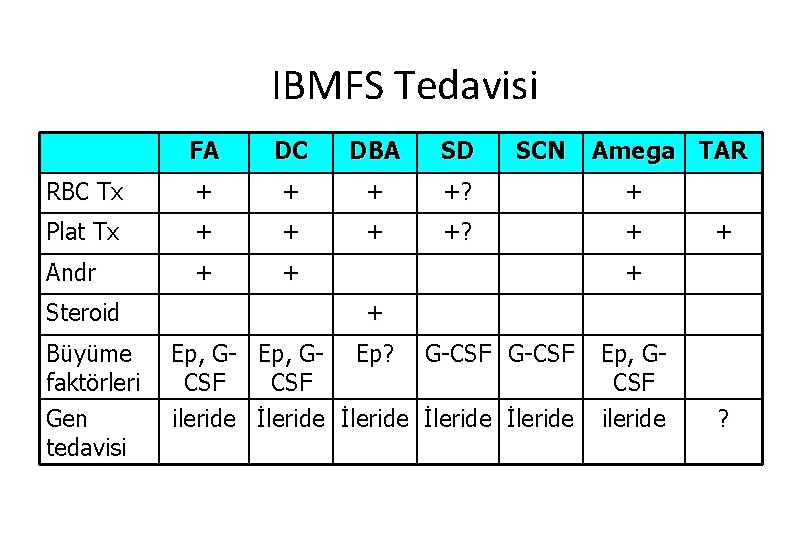
IBMFS özellikleri FA DC DBA SD SCN Genetik OR XR, OD, OR, XR OR OR Gen 15 7 9 1 >2 1 ? Fiziksel anomali + + - - + Hemat. bulgu AA AA PRCA Nö t/ pansito nö t plat AA + + - + - İzoamil az - - - Özgün Test Kromozom kırıkları Telomer(? ) e. ADA Amega TAR Lösemi + + + + Tümörler + + + - -

Diskeratozis konjenita -Deri pigmentasyon değişikliği -Lökoplaki -Tırnak distrofisi -<20 y %80 Kİ yetm. Telomer bütünlüğünün korunması ile ilişkili genler MDS %30 AML %10 Solid tümör %20 -30

IBMFS Tedavisi FA DC DBA SD RBC Tx + +? + Plat Tx + +? + Andr + + Steroid Büyüme faktörleri Gen tedavisi SCN Amega TAR + + + Ep, G- Ep? G-CSF CSF ileride İleride Ep, GCSF ileride ?

FANCONİ APLASTİK ANEMİSİ İlk kez 1927’de Fanconi tarafından aplastik anemi ve konjenital fiziksel anomalilere sahip 3 erkek hastada tanımlanmıştır. Aplastik anemilerin en yaygın formu • İlerleyici pansitopeni • kromozomal instabilite • kansere yatkınlık • otozomal resesif : taşıyıcı sıklığı 1/200 -1/300, hastalık sıklığı Avrupa ve Amerika’da 1/300, 000 • çeşitli konjenital anomaliler: sıklıkla prenatal başlangıçlı gelişme geriliği, kısa yapı, mikrosefali, mental retardasyon, mikroftalmi, şaşılık, kulak malformasyonları, sağırlık, deride hipo-hiper pigmente lekeler, radiyal aks ve baş parmak malformasyonları, skolyoz, kardiyak, gastrointestinal ve ürogenital anomaliler • klinik heterojenite

FANCONİ APLASTİK ANEMİSİ • Hastalıkta gözlenen hematolojik problemler mortalite ve morbiditenin başlıca nedenidir ve genellikle 5 -10 yaşları arasında başlamaktadır. • Kanser gelişme yaşı populasyona göre ERKEN olup, ortalama 16 yaş olarak verilmektedir • Hastalıkta en sık MDS(%40), lösemi(AML%10), lenfoma ve karaciğer tümörleri gözlenmektedir.

FANCONİ APLASTİK ANEMİSİ • • spontan ve DNA “crosslink” ajanları olarak bilinen mitomycin C (MMC) ve diepoxybutane (DEB) ile uyarılmış kromozomal kırık yüzdesinde artış Kromatid-kromozom kırıkları, homolog olmayan kromozomlar arasında oluşan “exchange” figürler Bu sitogenetik bulguların varlığının araştırılması tanı amaçlı kullanılmaktadır. Klonal kromozomal değişimler hematolojik malignite gelişiminin habercisi olabilir

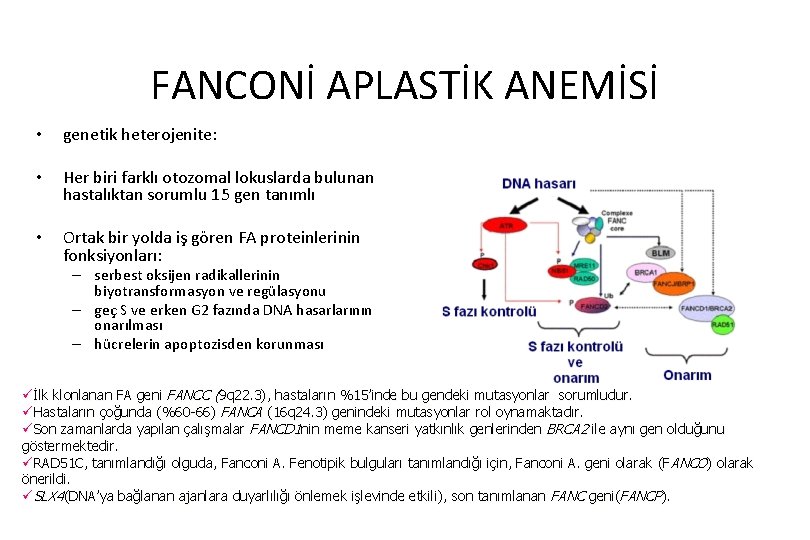
FANCONİ APLASTİK ANEMİSİ • genetik heterojenite: • Her biri farklı otozomal lokuslarda bulunan hastalıktan sorumlu 15 gen tanımlı • Ortak bir yolda iş gören FA proteinlerinin fonksiyonları: – serbest oksijen radikallerinin biyotransformasyon ve regülasyonu – geç S ve erken G 2 fazında DNA hasarlarının onarılması – hücrelerin apoptozisden korunması üİlk klonlanan FA geni FANCC (9 q 22. 3), hastaların %15’inde bu gendeki mutasyonlar sorumludur. üHastaların çoğunda (%60 -66) FANCA (16 q 24. 3) genindeki mutasyonlar rol oynamaktadır. üSon zamanlarda yapılan çalışmalar FANCD 1 nin meme kanseri yatkınlık genlerinden BRCA 2 ile aynı gen olduğunu göstermektedir. üRAD 51 C, tanımlandığı olguda, Fanconi A. Fenotipik bulguları tanımlandığı için, Fanconi A. geni olarak (F ANCO) olarak önerildi. üSLX 4(DNA’ya bağlanan ajanlara duyarlılığı önlemek işlevinde etkili), son tanımlanan FANC geni(FANCP).

• Fanconi Anemi yolağı homolog rekombinasyon onarımını desteklerken non-homolog onarımı (NHEJ/ non-homolog end joining)engeller. • Fanconi A. ’de non-homolog onarım artar • Hücre serilerinde NHEJ inhibisyonu, DNA’ya bağlanan ajan toksisitesini azaltmış hedef ilaç olabilir

Fanconi Anemisi MDS gelişimi : Kötü prognoz – – – Monozomi 7 Del 7 q +3 q +1 q RUNX 1 mutasyonu • Kromozom 7 anomalisi • Kromozom 3 anomalisi

Kromozomal Kırık Sendromları “Lösemi Yatkınlığı”

Kromozomal Kırık Sendromları Metafaz kromozomlarında izlenebilen kromozomal instabilite gösteren bir grup otozomal resesif hastalık, kromozomal kırık sendromları olarak bilinmektedir.

Kromozomal Kırık Sendromlarında Ortak Bulgular übüyüme-gelişme geriliği ükemik iliği ve immün sistem işlevsel yetersizlikleri ütümör gelişimine yatkınlık üsorumlu genlerin protein ürünleri DNA onarımında ve genom bütünlüğünün korunmasında rol oynar

Kromozomal Kırık Sendromları Bu genlerde fonksiyon kaybına yol açan mutasyonların, genomda; üdoğal olarak üçevresel ajanların etkisi ile oluşan hasarların onarılamaması ve genomik instabilite ile sonlandığı bilinmektedir.

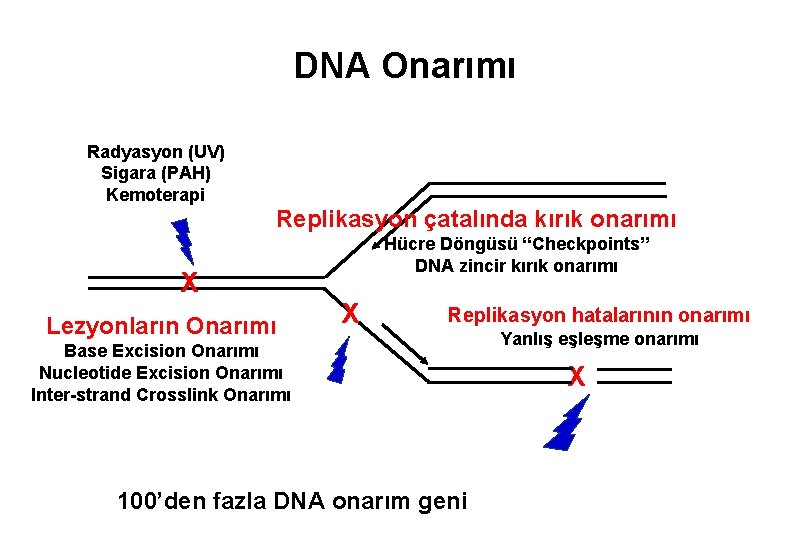
DNA Onarımı Radyasyon (UV) Sigara (PAH) Kemoterapi Replikasyon çatalında kırık onarımı Hücre Döngüsü “Checkpoints” DNA zincir kırık onarımı X Lezyonların Onarımı X Replikasyon hatalarının onarımı Base Excision Onarımı Nucleotide Excision Onarımı Inter-strand Crosslink Onarımı 100’den fazla DNA onarım geni Yanlış eşleşme onarımı X

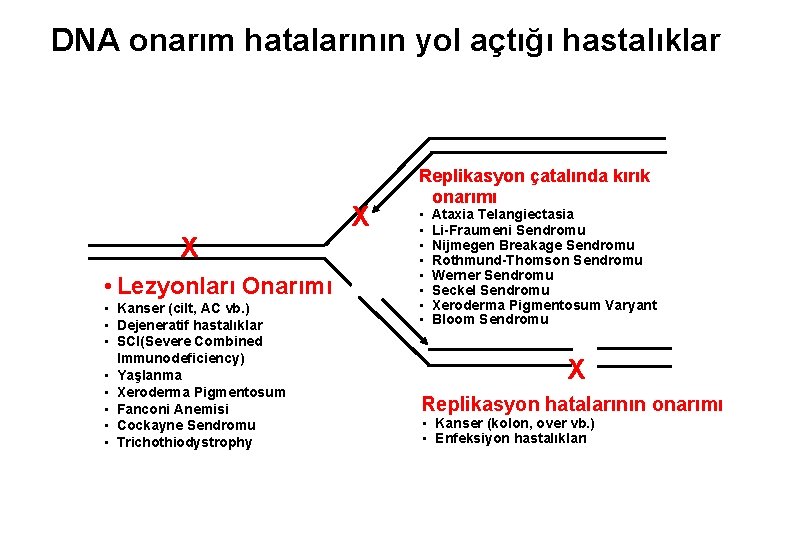
DNA onarım hatalarının yol açtığı hastalıklar X X • Lezyonları Onarımı • Kanser (cilt, AC vb. ) • Dejeneratif hastalıklar • SCI(Severe Combined Immunodeficiency) • Yaşlanma • Xeroderma Pigmentosum • Fanconi Anemisi • Cockayne Sendromu • Trichothiodystrophy Replikasyon çatalında kırık onarımı • • Ataxia Telangiectasia Li-Fraumeni Sendromu Nijmegen Breakage Sendromu Rothmund-Thomson Sendromu Werner Sendromu Seckel Sendromu Xeroderma Pigmentosum Varyant Bloom Sendromu X Replikasyon hatalarının onarımı • Kanser (kolon, over vb. ) • Enfeksiyon hastalıkları

Kromozomal Kırık Sendromları Otozomal resesif kalıtım kalıbının izlendiği bu hastalıklarda, hastalık bulgularının ancak homozigot bireylerde ortaya çıkabileceği beklenebilir. Ancak, heterozigotlarda da tümör gelişme riskinin yüksek olduğundan bahsedilmektedir. Örnek olarak Ataksi Telenjiektazi için taşıyıcı olan kadınlarda popülasyona göre yüksek meme kanseri riski söz konusudur. Bu durum hastalık insidansına göre daha yüksek bulunan taşıyıcı insidansı nedeniyle önem kazanmaktadır.

Kırık Sendromları • Fanconi • Cross-Link onarım defekti • • • Ataxia Telangiectasia(ATM) Ataxia Telangiectasia Benzeri Hastalıklar (ATLD) Bloom Nijmegen (NBS) Xeroderma Pigmentosum • UV hasarı onarım defekti • Cockayne Sendromu • Transkripsiyona eşlik eden onarım defekti

Ataxia Telangiectasia q. Otozomal resesif bir grup hastalığı tanımlamaktadır. q. Hastalık sıklığı: 1/40, 000 q. AT tüm ırklarda gözlenmekle birlikte, akraba evliliğinin yüksek sıklıkla yapıldığı etnik gruplarda daha sık karşılaşılmaktadır.

Ataxia Telangiectasia • • gelişme geriliği serebellar ataksi(progresif serebeller degenerasyon) – ilk bir yıl içinde başlayabilir – genellikle başlangıçta ilerleyici, daha sonra durağan hale gelir • • • mental retardasyon disartri, gözlerini fikse edememe Telenjiektaziler – konjonktiva ve kulak kepçelerinde – konjonktivada hayatın ilk yılı içinde • • seksüel immatürite İmmün yetmezlik – pulmoner ve bronşial enfeksiyonlar sık olarak görülmektedir. Bronşiektazi gelişebilir. – Timik hipoplazi ile birlikte hücresel immünite eksikliği – tonsil ve adenoid-lenfoid doku hipoplazisi – lenfopeni, düşük serum Ig. A ve Ig. E düzeyleri ile düşük moleküler ağırlıklı Ig. M varlığı ve yüksek AFP söz konusudur. • radyasyona duyarlılık

Ataxia Telangiectasia • tümör oluşumuna yatkınlık: – Hastalığın seyri sırasında %10 -20 lösemi ya da lenfomaya yakalanma riski vardır. – Onaltı yaşından sonra karsinoma riski artmaktadır. – Heterozigot kadınlarda meme kanseri riskinin yüksek olduğu bildirilmektedir

Ataxia Telangiectasia • kromatid “gap” ve kırıklarda artış • değişiklikler radyasyonla artar • klonal t(7; 14) Thücre reseptör genleri

ATM geni • 11 q 22. 3’te Protein ürünü • kontrol-noktası serin/treonin kinaz • Tp 53 ve BRCA 1 gen ürünleriyle etkileşime girer • S öncesi bölünmeyi durdurur • özellikle radyasyon etkisiyle oluşan kromozomal kırıkların onarımına olanak tanır Mutasyonlar • genellikle “truncating” veya “splicing” • yaklaşık %10’unda yanlış anlamlı • tüm gene yayılmış Hastalarda radyasyonla uyarılan tamir süreci yetersizdir. Radyoterpi endikasyonu olan durumlarda verilecek normal dozlar bu hastalar için ölümcül!!!!!!!

Nijmegen Breakage Sendromu (NBS) otozomal resesif sıklık 1: 100 000 mikrosefali gelişme geriliği kanser oluşumuna yatkınlık (özellikle lenfoid orjinli) • dismorfik özellikler • immün sistemde yetersizlik • • •

Nijmegen Breakage Sendromu (NBS) Tanı ionize radyasyon ve DNA’da “crosslink” yapan kimyasallara karşı artan kromozomal instabilite

Nijmegen Breakage Sendromu (NBS) • • hastalıktan sorumlu gen: NBS 1 8 q 21’de Protein ürünü: nibrin DNA çift sarmal kırıklarının onarımı Hücresel özelliklerin AT ile örtüşmesi nedeniyle de AT klinik varyantı olarak düşünülmüştür NBS 1 MRE 11/RAD 50 çift zincir kırığı onarım kompleksinin bir üyesidir. NBS 1’in hasarlı bölgelerde MRN (MRE 11/RAD 50/NBS 1) protein kompleksinin birikmesiyle ATM aktivasyonunu arttırdığını göstermiştir.

BLOOM SENDROMU İlk kez 1954 yılında Bloom tarafından tanımlanmış • Otozomal resesif kalıtım. Askenazi Yahudilerinde taşıyıcı sıklığı 1: 100, hastalık sıklığı 1: 100 000 • doğum öncesi/sonrası belirgin gelişme geriliği – düşük doğum ağırlığı, ortalama 2000 gr – 40 cm – Erişkin boyu erkekte 151 cm, kadında 144 cm’e ulaşmaktadır. • tüm hastalarda bulunmasa da hafif mental retardasyon, özellikle çocukluk yaşlarında ortaya çıkan öğrenme güçlüğü, • immun defekt: mitojenlere karşı lenfosit proliferasyon yanıtının yetersiz ve immünglobulin serum düzeyleri (özellikle Ig. A ve Ig. M ) düşük • yanaklarda, göz kapaklarında, ağız, kulak ve el sırtında güneş ışığı ile eritem oluşması(kelebek tarzı) • Erkeklerde yetersiz spermatogenezis nedeniyle infertilite, kadınlarda fertilite azlığı

BLOOM SENDROMU • • • dolikosefali ılımlı mikrosefali dar yüz malar hipoplazi üst lateral kesici dişlerin yokluğu belirgin kulaklar iktiyotik deri Hipertrikozis sindaktili, polidaktili 5. parmakta klinodaktili “cafe au lait” lekeleri ince ses

BLOOM SENDROMU • kromozomal instabilite: – kromozomal kırık oranlarında artış – Özellikle kardeş kromatid değişim (SCE) oranı normalin 10 katına kadar yükselmektedir • lösemi, lenfoma ve diğer tümörlere yatkınlık

BLOOM SENDROMU • • • Bloom sendromunda malign tümörler beklenenden daha erken yaşlarda ortaya çıkmaktadır. hastaların ¼’ünde kanser gelişimi bazı hastalarda birden fazla primer tümör gelişimi en yaygın olarak gözlenen kanser grubu lösemi 30 yaşından sonra gastrointestinal malign tümör gelişimi artar. tümör gelişimine yatkınlık nedeni: ü somatik hücrelerdeki (homolog kromozomlar arasında) yüksek rekombinasyon ü artmış mutasyon oranı Böylece, hastalar bir tümör baskılayıcı genin her iki alelinde fonksiyon kaybına yol açan herhangi bir gen lokusu için homozigot hale gelebilirler

BLOOM SENDROMU • sorumlu gen: BLM • 15 q 26. 1 • Protein ürünü Rec. Q helikazlarından birisi DNA replikasyonu, tamir ve rekombinasyonundan önce DNA çift sarmalının açılmasından sorumlu

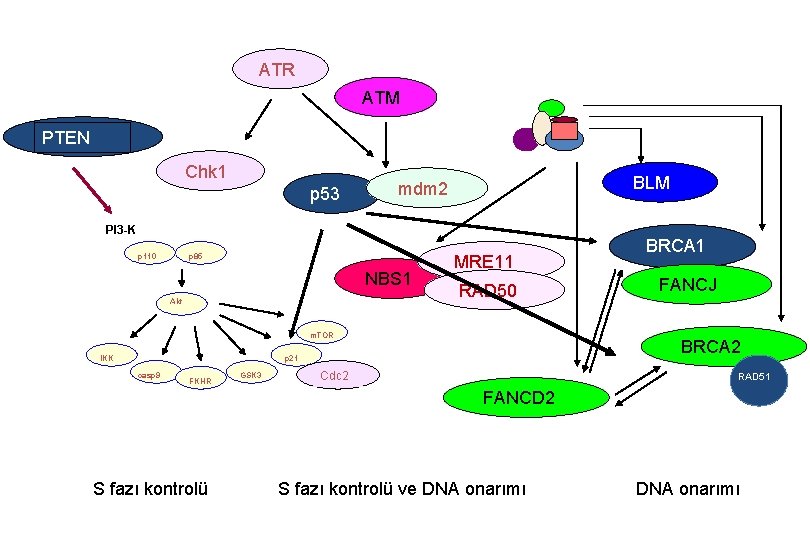
ATR ATM PTEN Chk 1 p 53 BLM mdm 2 PI 3 -K p 110 p 85 NBS 1 Akt MRE 11 RAD 50 m. TOR IKK FKHR GSK 3 FANCJ BRCA 2 p 21 casp 9 BRCA 1 Cdc 2 RAD 51 FANCD 2 S fazı kontrolü ve DNA onarımı

Lösemi Genetik değişikliklerin klinik ile korelasyonu Tanı, izlem ve tedavinin belirlenmesinde genetik algoritmalar

ONKOGEN / TüMöR SUPRESOR GEN Onkogenik aktivasyon Lösemi olgularının %50’sinden fazlası Folliküler, Burkitt, Large Cell lenfoma

ONKOGENLER Büyüme faktörleri IL-2 BCM, IL 3, TAN 1 GF reseptörü tirozin kinazlar PDGFR , NPM/ALK Tirozin kinazlar ABL, LCK Membrane associated G-proteinler Serin-treonin kinazlar Sitoplazmik regülatörler Nüklear proteinler MYC, AML 1, TAL 2, BCL 3, BCL 6, TEL, RAR , CBF , MLL, LMO 1, LMO 2 E 2 A, PAX 5

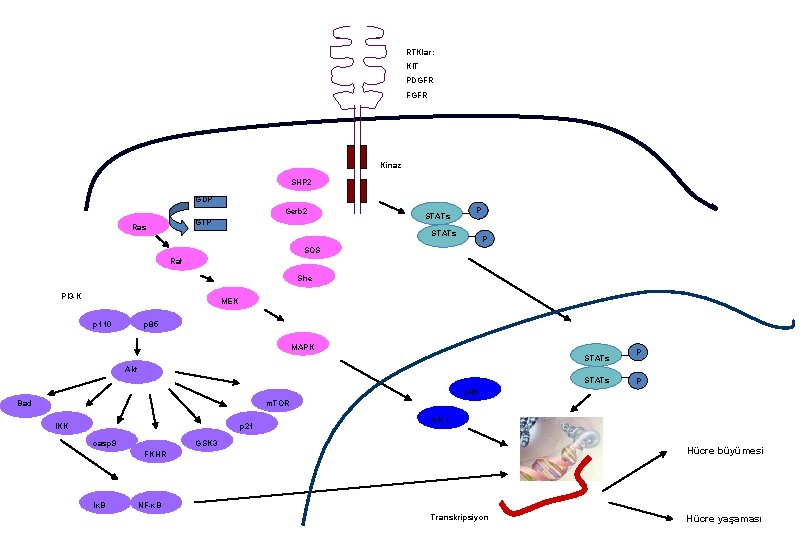
RTKlar: KIT PDGFR FGFR Kinaz SHP 2 GDP Gerb 2 GTP Ras STATs P SOS Raf She PI 3 -K MEK p 110 p 85 MAPK STATs P Akt STATs P JNK m. TOR Bad IKK p 21 casp 9 AP-1 GSK 3 Hücre büyümesi FKHR IκB NF-κB Transkripsiyon Hücre yaşaması

ONKOGEN AKTİVASYONU • • • Proviral insersiyon Nokta mutasyonu Amplifikasyon Kromozomal yeni düzenlenme sonucu kimerik gen oluşumu Kromozomal yeni düzenlenme sonucu onkogenin transkripsiyonel aktif bölgeye taşınımı

Aktivasyonun moleküler patolojisi üTF’lerinin hızlı promotor/enhancer önüne taşınması (Ig ya da TCR promotorları gibi) üTF ya da TK’ların başka bir genle füzyonu

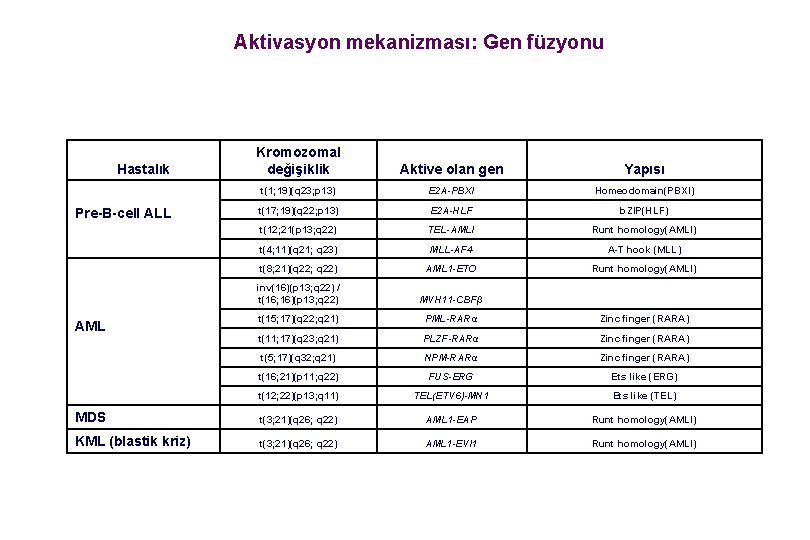
Aktivasyon mekanizması: Gen füzyonu Kromozomal değişiklik Aktive olan gen Yapısı t(1; 19)(q 23; p 13) E 2 A-PBXI Homeodomain(PBXI) t(17; 19)(q 22; p 13) E 2 A-HLF b. ZIP(HLF) t(12; 21(p 13; q 22) TEL-AMLI Runt homology(AMLI) t(4; 11)(q 21; q 23) MLL-AF 4 A-T hook (MLL) t(8; 21)(q 22; q 22) AML 1 -ETO Runt homology(AMLI) inv(16)(p 13; q 22) / t(16; 16)(p 13; q 22) MVH 11 -CBFβ t(15; 17)(q 22; q 21) PML-RARα Zinc finger (RARA) t(11; 17)(q 23; q 21) PLZF-RARα Zinc finger (RARA) t(5; 17)(q 32; q 21) NPM-RARα Zinc finger (RARA) t(16; 21)(p 11; q 22) FUS-ERG Ets like (ERG) t(12; 22)(p 13; q 11) TEL(ETV 6)-MN 1 Ets like (TEL) MDS t(3; 21)(q 26; q 22) AML 1 -EAP Runt homology(AMLI) KML (blastik kriz) t(3; 21)(q 26; q 22) AML 1 -EVI 1 Runt homology(AMLI) Hastalık Pre-B-cell ALL AML

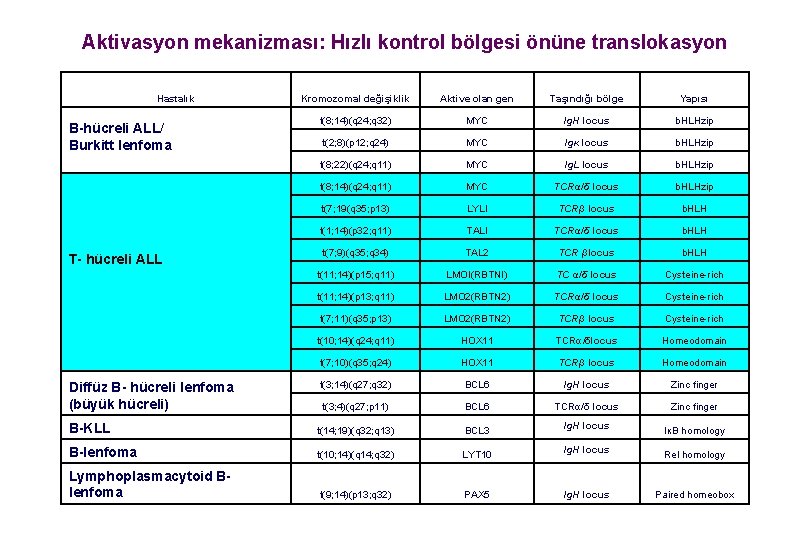
Aktivasyon mekanizması: Hızlı kontrol bölgesi önüne translokasyon Hastalık Kromozomal değişiklik Aktive olan gen Taşındığı bölge Yapısı t(8; 14)(q 24; q 32) MYC Ig. H locus b. HLHzip t(2; 8)(p 12; q 24) MYC Igκ locus b. HLHzip t(8; 22)(q 24; q 11) MYC Ig. L locus b. HLHzip t(8; 14)(q 24; q 11) MYC TCRα/δ locus b. HLHzip t(7; 19(q 35; p 13) LYLI TCRβ locus b. HLH t(1; 14)(p 32; q 11) TALI TCRα/δ locus b. HLH t(7; 9)(q 35; q 34) TAL 2 TCR βlocus b. HLH t(11; 14)(p 15; q 11) LMOI(RBTNI) TC α/δ locus Cysteine-rich t(11; 14)(p 13; q 11) LMO 2(RBTN 2) TCRα/δ locus Cysteine-rich t(7; 11)(q 35; p 13) LMO 2(RBTN 2) TCRβ locus Cysteine-rich t(10; 14)(q 24; q 11) HOX 11 TCRα/δlocus Homeodomain t(7; 10)(q 35; q 24) HOX 11 TCRβ locus Homeodomain Diffüz B- hücreli lenfoma (büyük hücreli) t(3; 14)(q 27; q 32) BCL 6 Ig. H locus Zinc finger t(3; 4)(q 27; p 11) BCL 6 TCRα/δ locus Zinc finger B-KLL t(14; 19)(q 32; q 13) BCL 3 Ig. H locus IκB homology B-lenfoma t(10; 14)(q 14; q 32) LYT 10 Ig. H locus Rel homology Lymphoplasmacytoid Blenfoma t(9; 14)(p 13; q 32) PAX 5 Ig. H locus Paired homeobox B-hücreli ALL/ Burkitt lenfoma T- hücreli ALL

Hematolojik malignitelerin tanı ve izleminde genetik yöntemlerin yeri üTanı/izlem değeri olan genetik değişikliklerin saptanması BCR/ABL, PML/RARA +8, del 5 q 31, del 7 q 31, TEL/AML 1

Sitogenetik ü Normal karyotip ü Yetersiz hücre ü Özgün bulgu yok FISH ve/veya PCR 24, 48 saat, 72 saat indüklenmiş ü Normal ise min 20 hücre ü Anormal ise min 10 hücre Patolojik Karyotip ISCN’e uygun RAPOR

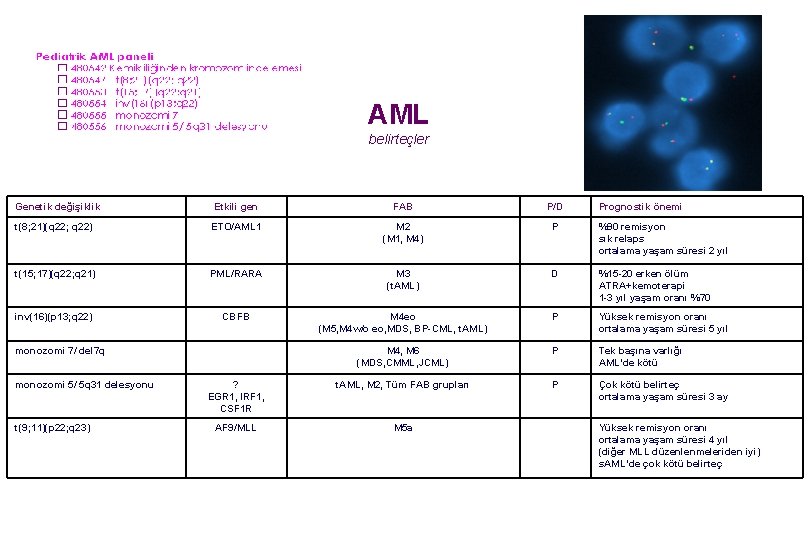
AML belirteçler Genetik değişiklik Etkili gen FAB P/D t(8; 21)(q 22; q 22) ETO/AML 1 M 2 (M 1, M 4) P %90 remisyon sık relaps ortalama yaşam süresi 2 yıl t(15; 17)(q 22; q 21) PML/RARA M 3 (t. AML) D %15 -20 erken ölüm ATRA+kemoterapi 1 -3 yıl yaşam oranı %70 inv(16)(p 13; q 22) CBFB M 4 eo (M 5, M 4 w/o eo, MDS, BP-CML, t. AML) P Yüksek remisyon oranı ortalama yaşam süresi 5 yıl M 4, M 6 (MDS, CMML, JCML) P Tek başına varlığı AML’de kötü ? EGR 1, IRF 1, CSF 1 R t. AML, M 2, Tüm FAB grupları P Çok kötü belirteç ortalama yaşam süresi 3 ay AF 9/MLL M 5 a monozomi 7/ del 7 q monozomi 5/ 5 q 31 delesyonu t(9; 11)(p 22; q 23) Prognostik önemi Yüksek remisyon oranı ortalama yaşam süresi 4 yıl (diğer MLL düzenlenmeleriden iyi) s. AML’de çok kötü belirteç

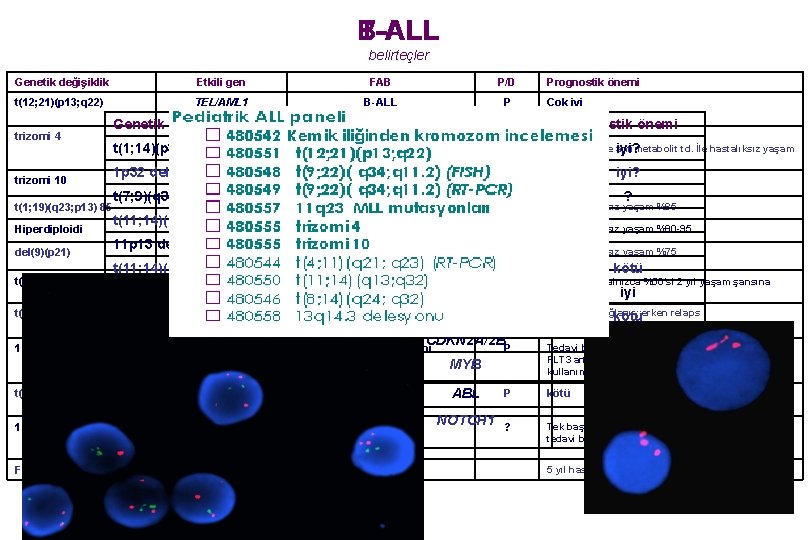
B-ALL T-ALL belirteçler Genetik değişiklik Etkili gen FAB P/D t(12; 21)(p 13; q 22) TEL/AML 1 B-ALL L 1, L 2 P Çok iyi P İyi P 5 yıl hastalıksız yaşam %85 P 5 yıl hastalıksız yaşam %90 -95 P 5 yıl hastalıksız yaşam %75 trizomi 4 trizomi 10 t(1; 19)(q 23; p 13) 85 Hiperdiploidi del(9)(p 21) t(8; 14)(q 11; q 32) t(4; 11)(q 21; q 23) Genetik değişiklik B progenitör ALL t(1; 14)(p 32; q 11)/t(1; 7)(p 32; q 34) 1 p 32 delesyon TAL 1 SIL/TAL 1 pre. B ALL t(7; 9)(q 34; q 32) TAL 2 t(11; 14)(p 15; q 11)/t(7; 11)(q 34; p 15) LMO 1 11 p 13 delesyon CDKN 2 A/B LMO 2 E 2 A-PBX 1 t(11; 14)(p 13; q 11) ? /IGH t(10; 14)(q 24; q 11)/t(7; 10)(q 34; q 24) CD 10+ ALL AF 4/MLL t(5; 14)(q 35; q 32) 9 p 21 delesyon /HİPERMETİLASYON 11 q 23 düzenlenmeleri MLL mutasyonları B-ALL L 1, L 2 t(9; 22)( q 34; q 11. 2) BCR/ABL 1 9 q 34 amplifikasyonu 13 q 14. 3 delesyonu t(7; 9)(q 34; q 34) RB 1 NOTCH 1 mutasyonları LMO 2/TCRd HOX 11 L 2 ? P ALL +10 ile birlikte antimetabolit td. İle hastalıksız yaşam iyi? süresi 4 yıl iyi? ? kötü ? olguların yalnızca %50’si 2 yıl yaşam şansına iyi Remisyon sağlanır, erken relaps kötü ortalama yaşam süresi 9 ay P Tedavi başarısızlığı riski (özellikle infantlarda) FLT 3 artışı ile birlikte ->FLT 3 inhibitörlerinin kullanımı ABL P kötü NOTCH 1 ? Tek başına belirteç değeri taşımamakla birlikte tedavi başarısızlığı riskini arttırır MYB L 1, L 2 B-ALL (T-ALL) Prognostik önemi ulaşmış CDKN 2 A/2 B Erken pre. B fenotipi 6 q 23 duplikasyonu FLT 3 Etkili gen Prognostik önemi kötü iyi 5 yıl hastalıksız yaşam <%20

Hematolojik malignitelerin tanı ve izleminde genetik yöntemlerin yeri üTanı/izlem değeri olan genetik değişikliklerin saptanması üTedaviyi belirleyen genetik değişikliklerin saptanması

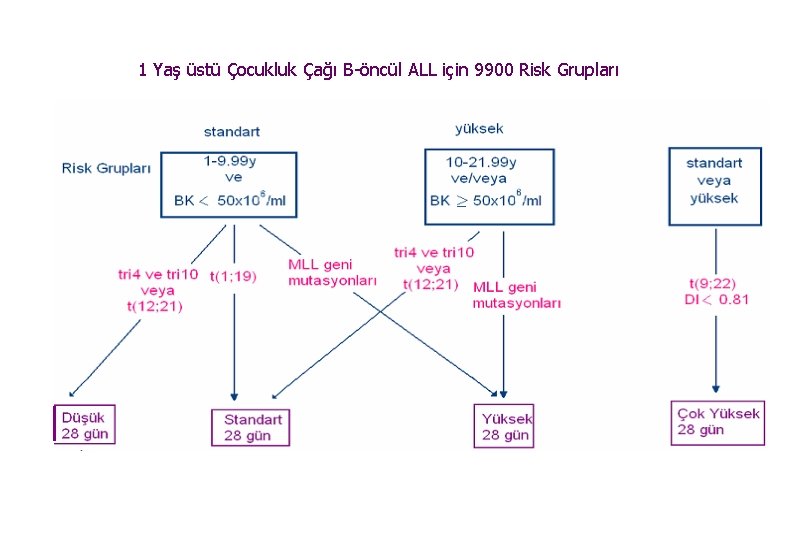
1 Yaş üstü Çocukluk Çağı B-öncül ALL için 9900 Risk Grupları

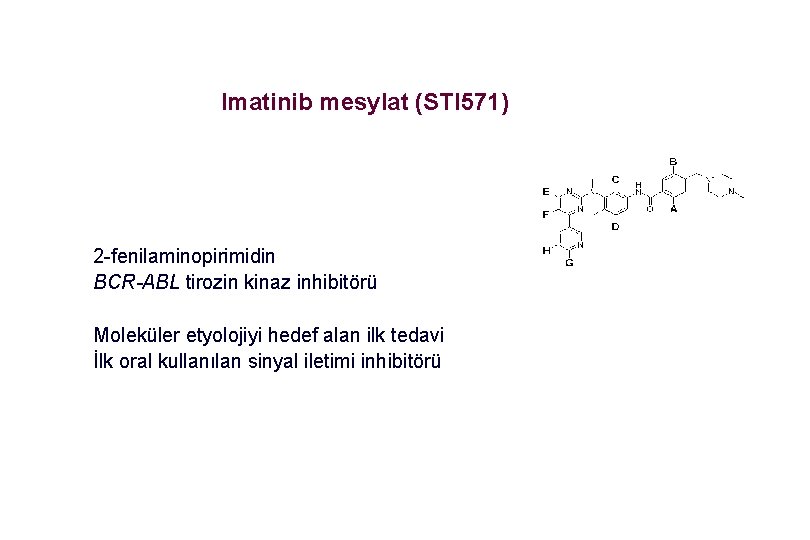
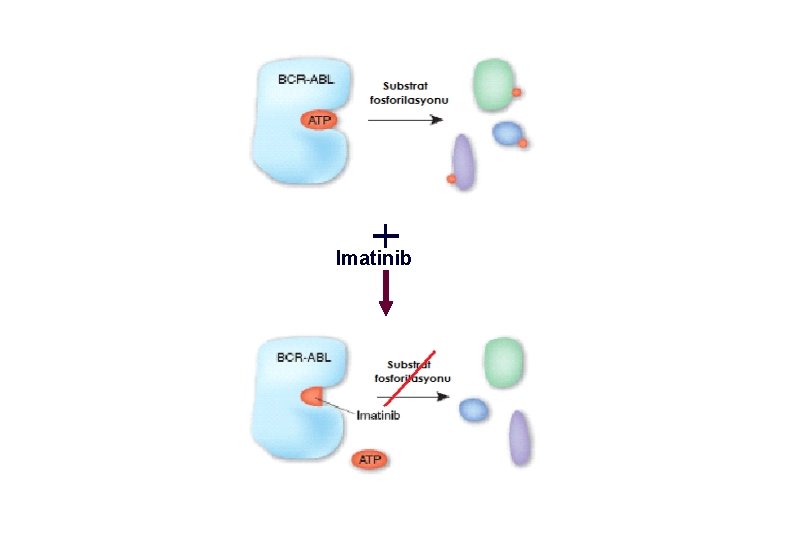
Imatinib mesylat (STI 571) 2 -fenilaminopirimidin BCR-ABL tirozin kinaz inhibitörü Moleküler etyolojiyi hedef alan ilk tedavi İlk oral kullanılan sinyal iletimi inhibitörü

Imatinib

Imatinib mesylat (Glivec) endikasyonları FIP 1 L 1/PDGFRA- HES BCR/PDGFRA-a. KML PDGFRB-CML, CMML, AML, CEL, MPD (T 681 I) KIT- Mast hücreli, (D 816 X) AML (CBFB mutasyonları taşıyanlarda sık ve dirençli) CSF 1 R/FMS- MDS, AML ABL 2

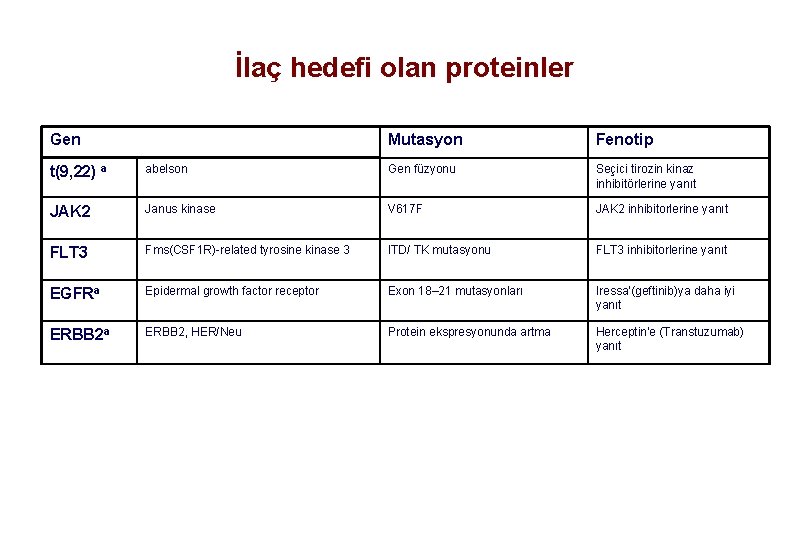
İlaç hedefi olan proteinler Gen Mutasyon Fenotip abelson Gen füzyonu Seçici tirozin kinaz inhibitörlerine yanıt Janus kinase V 617 F JAK 2 inhibitorlerine yanıt FLT 3 Fms(CSF 1 R)-related tyrosine kinase 3 ITD/ TK mutasyonu FLT 3 inhibitorlerine yanıt EGFRa Epidermal growth factor receptor Exon 18– 21 mutasyonları Iressa’(geftinib)ya daha iyi yanıt ERBB 2 a ERBB 2, HER/Neu Protein ekspresyonunda artma Herceptin’e (Transtuzumab) yanıt t(9, 22) a JAK 2

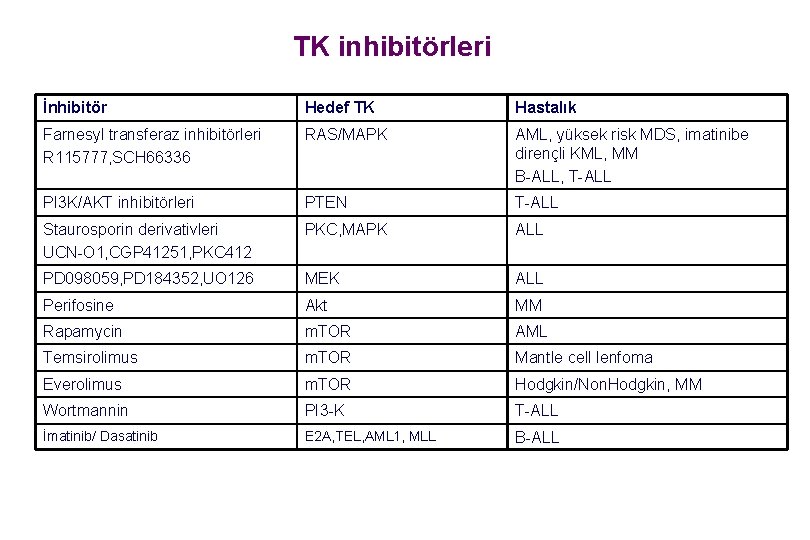
TK inhibitörleri İnhibitör Hedef TK Hastalık Farnesyl transferaz inhibitörleri R 115777, SCH 66336 RAS/MAPK AML, yüksek risk MDS, imatinibe dirençli KML, MM B-ALL, T-ALL PI 3 K/AKT inhibitörleri PTEN T-ALL Staurosporin derivativleri UCN-O 1, CGP 41251, PKC 412 PKC, MAPK ALL PD 098059, PD 184352, UO 126 MEK ALL Perifosine Akt MM Rapamycin m. TOR AML Temsirolimus m. TOR Mantle cell lenfoma Everolimus m. TOR Hodgkin/Non. Hodgkin, MM Wortmannin PI 3 -K T-ALL İmatinib/ Dasatinib E 2 A, TEL, AML 1, MLL B-ALL

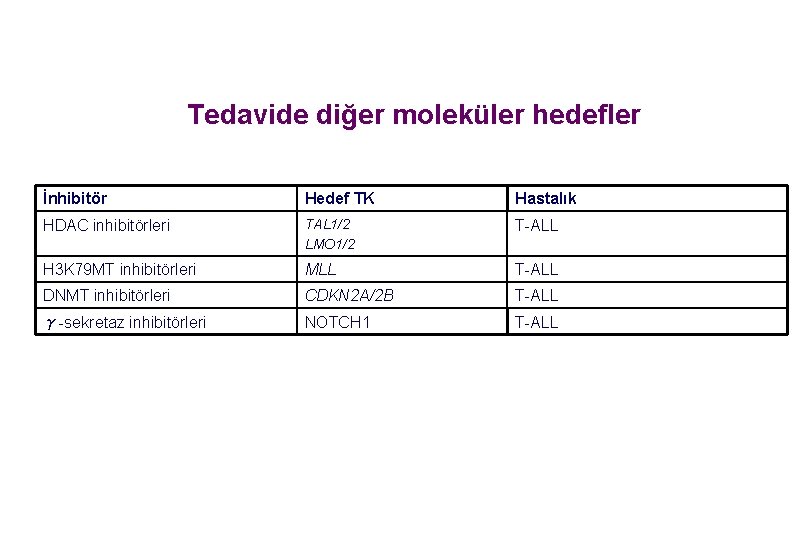
Tedavide diğer moleküler hedefler İnhibitör Hedef TK Hastalık HDAC inhibitörleri TAL 1/2 LMO 1/2 T-ALL H 3 K 79 MT inhibitörleri MLL T-ALL DNMT inhibitörleri CDKN 2 A/2 B T-ALL γ-sekretaz inhibitörleri NOTCH 1 T-ALL

Hematolojik malignitelerin tanı ve izleminde genetik yöntemlerin yeri üTanı/izlem değeri olan genetik değişikliklerin saptanması üTedaviyi belirleyen genetik değişikliklerin saptanması üMRD izleminde genetik yaklaşım

MRD • Saptanmış klonal genetik değişikliğin izlemi • Hastalıktan bağımsız belirteçlerle izlem Ig/TCR lokus düzenlenmeleri X inaktivasyon patterni FLOW CYTOMETRY REAL TIME-PCR

Değerlendirmede güvenirlik: 1. Duyarlılık en az 1/1000 (1/10 000 - 1/1 000) 2. Malign hücreleri normalden ayırt etme gücü (yanlış pozitif sonuç olmaması) 3. Lösemiye özgü işaretlerin kararlılığı (yanlış negatif sonuç olmaması) 4. Değişik merkezlerde uygulanabilir olması ve standardizasyonu 5. Hızlı sonuç 6. MRD’yi nicel olarak ölçebilme

Hematolojik malignitelerin tanı ve izleminde genetik yöntemlerin yeri üTanı/izlem değeri olan genetik değişikliklerin saptanması üTedaviyi belirleyen genetik değişikliklerin saptanması üMRD izleminde genetik yaklaşım üFarmakogenetik uygulamalar

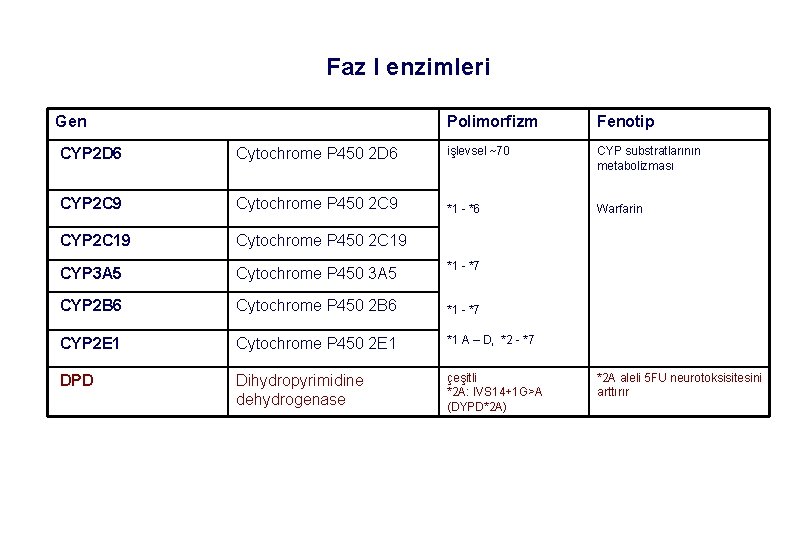
Faz I enzimleri Gen Polimorfizm Fenotip CYP 2 D 6 Cytochrome P 450 2 D 6 işlevsel ~70 CYP substratlarının metabolizması CYP 2 C 9 Cytochrome P 450 2 C 9 *1 - *6 Warfarin CYP 2 C 19 Cytochrome P 450 2 C 19 CYP 3 A 5 Cytochrome P 450 3 A 5 CYP 2 B 6 Cytochrome P 450 2 B 6 *1 - *7 CYP 2 E 1 Cytochrome P 450 2 E 1 *1 A – D, *2 - *7 DPD Dihydropyrimidine dehydrogenase çeşitli *2 A: IVS 14+1 G>A (DYPD*2 A) *1 - *7 *2 A aleli 5 FU neurotoksisitesini arttırır

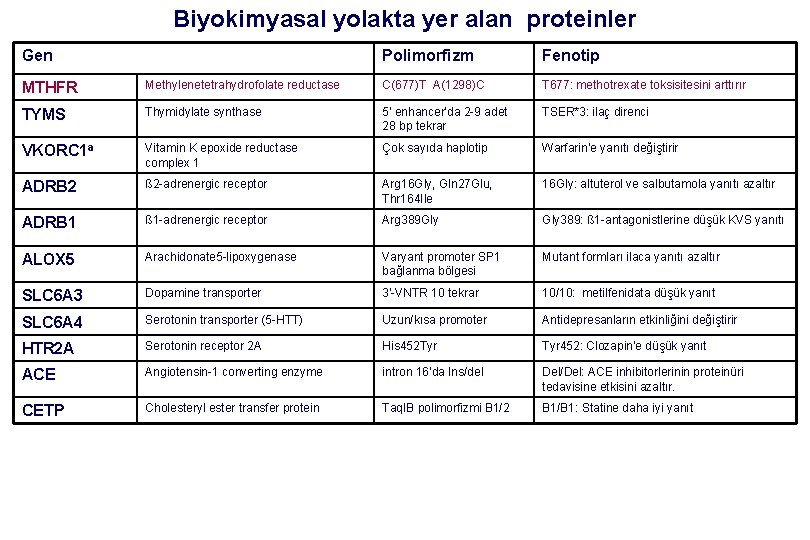
Biyokimyasal yolakta yer alan proteinler Gen Polimorfizm Fenotip MTHFR Methylenetetrahydrofolate reductase C(677)T A(1298)C T 677: methotrexate toksisitesini arttırır TYMS Thymidylate synthase 5' enhancer’da 2 -9 adet 28 bp tekrar TSER*3: ilaç direnci VKORC 1 a Vitamin K epoxide reductase complex 1 Çok sayıda haplotip Warfarin’e yanıtı değiştirir ADRB 2 ß 2 -adrenergic receptor Arg 16 Gly, Gln 27 Glu, Thr 164 Ile 16 Gly: altuterol ve salbutamola yanıtı azaltır ADRB 1 ß 1 -adrenergic receptor Arg 389 Gly 389: ß 1 -antagonistlerine düşük KVS yanıtı ALOX 5 Arachidonate 5 -lipoxygenase Varyant promoter SP 1 bağlanma bölgesi Mutant formları ilaca yanıtı azaltır SLC 6 A 3 Dopamine transporter 3'-VNTR 10 tekrar 10/10: metilfenidata düşük yanıt SLC 6 A 4 Serotonin transporter (5 -HTT) Uzun/kısa promoter Antidepresanların etkinliğini değiştirir HTR 2 A Serotonin receptor 2 A His 452 Tyr 452: Clozapin’e düşük yanıt ACE Angiotensin-1 converting enzyme intron 16’da Ins/del Del/Del: ACE inhibitorlerinin proteinüri tedavisine etkisini azaltır. CETP Cholesteryl ester transfer protein Taq. IB polimorfizmi B 1/2 B 1/B 1: Statine daha iyi yanıt

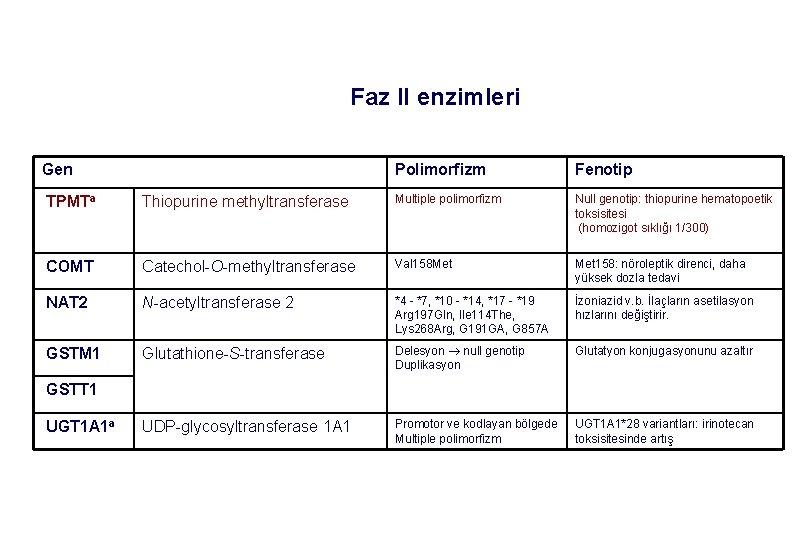
Faz II enzimleri Gen Polimorfizm Fenotip TPMTa Thiopurine methyltransferase Multiple polimorfizm Null genotip: thiopurine hematopoetik toksisitesi (homozigot sıklığı 1/300) COMT Catechol-O-methyltransferase Val 158 Met 158: nöroleptik direnci, daha yüksek dozla tedavi NAT 2 N-acetyltransferase 2 *4 - *7, *10 - *14, *17 - *19 Arg 197 Gln, Ile 114 The, Lys 268 Arg, G 191 GA, G 857 A İzoniazid v. b. İlaçların asetilasyon hızlarını değiştirir. GSTM 1 Glutathione-S-transferase Delesyon null genotip Duplikasyon Glutatyon konjugasyonunu azaltır UDP-glycosyltransferase 1 A 1 Promotor ve kodlayan bölgede Multiple polimorfizm UGT 1 A 1*28 variantları: irinotecan toksisitesinde artış GSTT 1 UGT 1 A 1 a

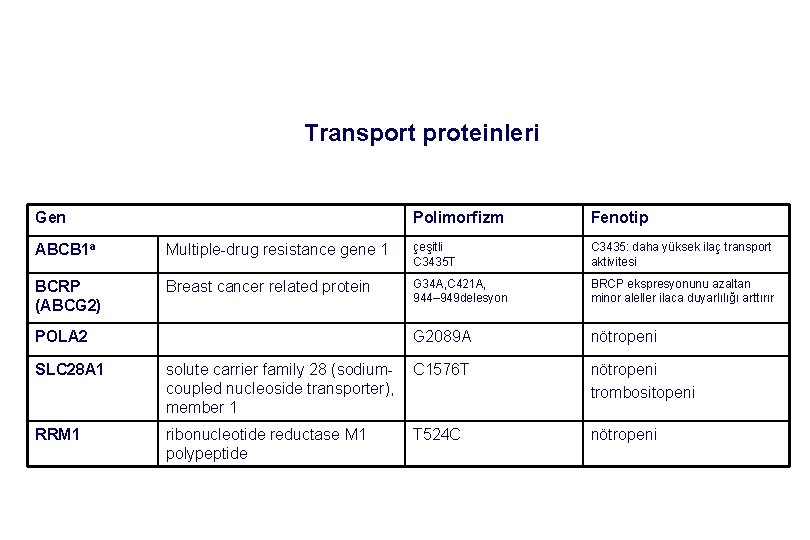
Transport proteinleri Gen Polimorfizm Fenotip ABCB 1 a Multiple-drug resistance gene 1 çeşitli C 3435 T C 3435: daha yüksek ilaç transport aktivitesi BCRP (ABCG 2) Breast cancer related protein G 34 A, C 421 A, 944– 949 delesyon BRCP ekspresyonunu azaltan minor aleller ilaca duyarlılığı arttırır G 2089 A nötropeni POLA 2 SLC 28 A 1 solute carrier family 28 (sodium- C 1576 T coupled nucleoside transporter), member 1 nötropeni trombositopeni RRM 1 ribonucleotide reductase M 1 polypeptide nötropeni T 524 C

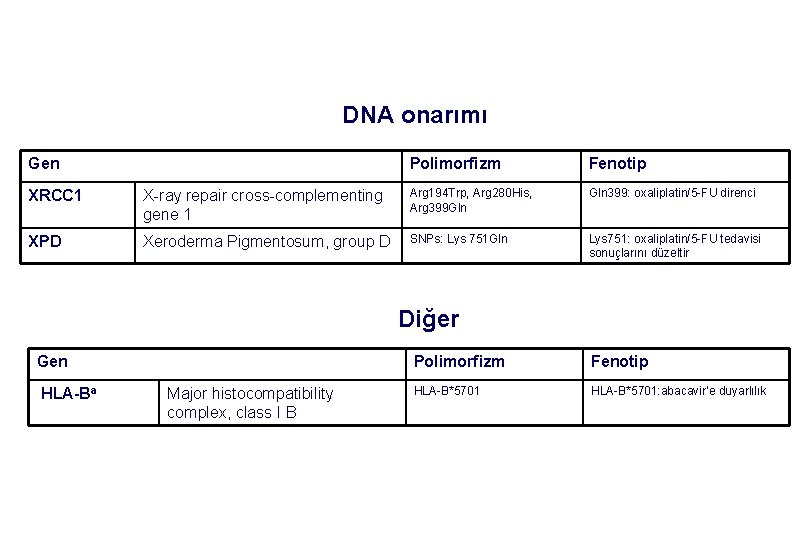
DNA onarımı Gen Polimorfizm Fenotip XRCC 1 X-ray repair cross-complementing gene 1 Arg 194 Trp, Arg 280 His, Arg 399 Gln 399: oxaliplatin/5 -FU direnci XPD Xeroderma Pigmentosum, group D SNPs: Lys 751 Gln Lys 751: oxaliplatin/5 -FU tedavisi sonuçlarını düzeltir Diğer Gen HLA-Ba Major histocompatibility complex, class I B Polimorfizm Fenotip HLA-B*5701: abacavir’e duyarlılık

5 FU DYPD: *2 A (neurotoksisite) TS: *2 (yanıtı arttırır) XRCC 1: Gln 399 (direnç) XPD: Lys 751(yanıtı arttırır) MTHFR: 677 T (yanıtı arttırır) 6 MP TPMT: *2, *3 A, *3 C, null (hematotoksisite) Irinotecan UGT 1 A 1: *28 (toksisite) MTX MTHFR: 677 T (toksisite) CYP 2 D 6 CYP 2 C 9 CYP 2 B 6

İmatinib direnci Primer direnç Erken kronik fazda %2 hastada hematolojik yanıt alınamaz %8 -13 hastada majör veya komplet sitogenetik yanıt alınamaz Sekonder direnç BCR-ABL füzyon geninde tek nükloeotid yer değişimi ile kinaz reaktivasyonu

Dirençe yol açan değişiklikler İmatinib: 128 gen(apopitoz, DNA tamiri, oksidatif stressi azaltan, sentrozom) BCR-ABL bağımlı Gen mutasyonu Gen amplifikasyonu BCR-ABL bağımsız Klonal gelişim Farklı genlerin etkileri (FIP 1 L 1 -PDGFRA füzyonu, c. KIT ve PDGFRA geni mutasyonları, vb) İlaç Atılımı-düşük intra sellüler konsantrasyon Plazmada bağlayan protein artışı/ polimorfizm: α 1 -acid glycoprotein (A <F 1 -S) P-glycoprotein (ABCB 1)
 Genetii
Genetii Fraktur coxae
Fraktur coxae Symphysis pubica synchondrose
Symphysis pubica synchondrose Anagramas con nombres
Anagramas con nombres El origen del pecado
El origen del pecado Donde estaba adan, cuando eva fue tentada
Donde estaba adan, cuando eva fue tentada Estatura de adan y eva
Estatura de adan y eva Descendientes de noe hasta jesus
Descendientes de noe hasta jesus Kombinasyon ders notu
Kombinasyon ders notu The adam and eve family tree
The adam and eve family tree Yawes memetes entes dis enfeloe
Yawes memetes entes dis enfeloe La costilla se regenera
La costilla se regenera Por el pecado de un hombre entro la muerte
Por el pecado de un hombre entro la muerte Que señal de obediencia dio dios a adan y eva
Que señal de obediencia dio dios a adan y eva Ramsay hunt sendromu
Ramsay hunt sendromu Boyun anatomisi
Boyun anatomisi Nazlı kemik
Nazlı kemik Uzun kemik yapısı
Uzun kemik yapısı Fanconi anemisi nedenleri
Fanconi anemisi nedenleri Makula utrikulus
Makula utrikulus Malformaciones congenitas
Malformaciones congenitas Susamsi kemikler
Susamsi kemikler Kemik labirent
Kemik labirent Timik hiperplazi
Timik hiperplazi Trabeküler kemik
Trabeküler kemik Skala media kulak
Skala media kulak Gelle testi
Gelle testi Kemik veter refleksi
Kemik veter refleksi Uzun kemik
Uzun kemik Metakarpal kemikler
Metakarpal kemikler Akut lymfatisk leukemi t-all
Akut lymfatisk leukemi t-all Patella ossa
Patella ossa Uzun kemik yapısı
Uzun kemik yapısı Kranium kemik konturları muntazamdır
Kranium kemik konturları muntazamdır Interradiküler kemik
Interradiküler kemik Nefrotik sendrom nefritik sendrom
Nefrotik sendrom nefritik sendrom İşlem adımlarıyla ebelikte klinik uygulamalar
İşlem adımlarıyla ebelikte klinik uygulamalar Spiritualitt
Spiritualitt Klinik risaf
Klinik risaf Contoh ayat melontar
Contoh ayat melontar Albert schweitzer holzminden
Albert schweitzer holzminden Jenjang karir perawat
Jenjang karir perawat Tiroid oftalmopati
Tiroid oftalmopati Klinik sonnenhalde
Klinik sonnenhalde 3/4 kron preparasyonu
3/4 kron preparasyonu Klinik sonnenhalde riehen
Klinik sonnenhalde riehen Dokter ilyas paccerakkang
Dokter ilyas paccerakkang Sistem pengumpil pada tubuh manusia
Sistem pengumpil pada tubuh manusia Manajemen keuangan apotek
Manajemen keuangan apotek Enolaz
Enolaz Konsep pembelajaran klinik
Konsep pembelajaran klinik Parenkim paru
Parenkim paru Dr rose dinda martini
Dr rose dinda martini Ideal clinic complaints
Ideal clinic complaints Jenis jenis hecting
Jenis jenis hecting Dokter gizi semarang
Dokter gizi semarang Hareketli bölümlü protez yapım aşamaları
Hareketli bölümlü protez yapım aşamaları Klinik danişmanlik modeli sınav soruları
Klinik danişmanlik modeli sınav soruları Oya ercan
Oya ercan Audit informasi klinis adalah
Audit informasi klinis adalah Klinik kodlama nedir
Klinik kodlama nedir Klinik fan 范氏诊所
Klinik fan 范氏诊所 Rekam medis klinik kecantikan
Rekam medis klinik kecantikan Contoh kasus non maleficence
Contoh kasus non maleficence Intrakoronal restorasyonlar
Intrakoronal restorasyonlar Fachkliniken wangen
Fachkliniken wangen Academic research organizations
Academic research organizations Ova klinik
Ova klinik Contoh penyakit tidak berjangkit
Contoh penyakit tidak berjangkit Etika klinik jonsen siegler
Etika klinik jonsen siegler Maksud fomema
Maksud fomema Klinik refraksiya turlari
Klinik refraksiya turlari Abdominalrefleks
Abdominalrefleks Klinik bilgi sistemleri
Klinik bilgi sistemleri Nilai collier
Nilai collier Vanslab
Vanslab Metin ingeç klinik
Metin ingeç klinik Armgewichte sinnvoll
Armgewichte sinnvoll Klinik psikolojisi nedir
Klinik psikolojisi nedir Kjk oldenburg
Kjk oldenburg Jenjang karir perawat
Jenjang karir perawat Hoher meißner klinik
Hoher meißner klinik