KLASSZIKUS KINETIKAI ALAPOK Pta Gyrgy Modern fizikai kmia











![A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • A A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • A](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-12.jpg)
![A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • Ebben A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • Ebben](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-13.jpg)














![Nagy feleslegben alkalmazott reaktáns • Sokkal könnyebb dolgunk van, ha [X]0 << [Y]0, mert Nagy feleslegben alkalmazott reaktáns • Sokkal könnyebb dolgunk van, ha [X]0 << [Y]0, mert](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-28.jpg)
![Nagy feleslegben alkalmazott reaktáns • A módszer előnye, hogy nem kell az [X] abszolút Nagy feleslegben alkalmazott reaktáns • A módszer előnye, hogy nem kell az [X] abszolút](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-29.jpg)













- Slides: 43

KLASSZIKUS KINETIKAI ALAPOK • Póta György: Modern fizikai kémia (Digitális Tankönyvtár, 2013), 2. 2 fejezet • P. W. Atkins: Fizikai kémia III. (Tankönyvkiadó, Budapest, 2002)

Reakciósebesség, sebességi egyenlet • A reakciók sztöchiometriai egyenletét – hasonlóan, mint a termodinamikában – itt is a jobb oldalra rendezve adjuk meg: 2 • A direkt reakcióra: • Általános esetben: a termék sztöchiometriai együtthatója és a kiindulási anyagé (reaktánsé). • Bevezetjük a következő mennyiséget:

Reakciósebesség, sebességi egyenlet • A kémiai reakcióban fellépő sztöchiometria miatt az egyes Bj anyagfajták anyagmennyisége időben egymással arányosan változik. Ez azt jelenti, hogy az mennyiség minden anyagfajtára (azaz a j indextől függetlenül) ugyanaz az érték. Itt nj a j-edik, Bj anyagfajta anyagmennyisége, t pedig az idő. Természetesen feltételezzük, hogy a reakcióban ténylegesen változó mennyiségű anyagfajtákról van szó, azaz νj ≠ 0. • A reakció sebessége: ahol V a reakcióelegy térfogata, cj pedig a j-edik anyagfajta moláris koncentrációja. Az így definiált reakciósebesség abszolút értéke független attól, hogy az egyenletben melyik anyagfajta adatai szerepelnek.

Reakciósebesség, sebességi egyenlet • A reakciósebesség a Bj anyagfajták anyagmennyiségének, a hőmérsékletnek és esetleg a nyomásnak a függvénye. A függvényt megadó sebességi egyenlet: ahol w–(c 1, c 2, …, c. N) > 0 és w+(c 1, c 2, …, c. N) > 0 az oda- és a visszareakció sebességét jelöli. A w, w– és w+ konkrét alakját elméleti megfontolások vagy kísérletek segítségével adhatjuk meg.

Reakciósebesség, sebességi egyenlet • Az ún. elemi reakciók esetében a reakcióegyenlet nem csupán a sztöchiometriai viszonyokat, hanem a molekuláris történést is kifejezi. Ebben az esetben a sztöchiometriai együtthatók együttese rögzített (nem szorozható meg egy tetszőleges szorzó tényezővel). Az elemi reakció sebességi egyenlete: valamint: és ahol k – > 0 az oda-, k+ > 0 a visszafelé irányuló reakció sebességi együtthatója. Ezt az egyenletet történeti okok miatt tömeghatás-típusú vagy Guldberg–Waage-egyenletnek szokás nevezni.

Reakciósebesség, sebességi egyenlet • Előfordul, hogy a visszafelé irányuló reakció sebessége elhanyagolható az oda irányuló reakcióéhoz képest. Az így létrejövő egyirányú reakció egyenletében a ⇌ megfordítható nyilat a → egyirányú nyíllal helyettesítjük, a sebességi egyenletben pedig elhagyjuk a w+ tagot.

Reakciósebesség, sebességi egyenlet • Amennyiben a reakciósebesség koncentrációfüggését leíró w sebességi egyenlet és a térfogat időfüggését megadó V(t) függvényértékek ismertek, a reakcióban szereplő anyagfajták koncentrációjának időbeli változását a következő differenciálegyenlet-rendszer írja le: ahol j = 1, 2, …, N • A megoldáshoz szükséges a kezdeti (t = 0 -ra vonatkozó) koncentrációk (cj(0) = c 0 j) ismerete. • Ha a V térfogat állandó, akkor:

Reakciósebesség, sebességi egyenlet • Egynél több reakció egyidejű (szimultán) lejátszódása esetén az eddig leírtakat általánosíthatjuk. • A rendszerben lejátszódó, i-edik reakció általános alakja: ahol i = 1, 2, …, M ahol νij– ≥ 0 a Bj reaktáns sztöchiometriai együtthatója, νij+ ≥ 0 pedig a Bj terméké. Ha a j-edik anyagfajta valóban szerepel az i-edik reakcióban, akkor sztöchiometriai együtthatója pozitív, egyébként 0. • Az egyes anyagfajták koncentrációjának időbeli változását leíró kezdetiérték-feladat ekkor: és cj(0) = c 0 j

Reakciósebesség, sebességi egyenlet • Előfordul, hogy egy reakciórendszerben egyszerre több elemi reakció megy végbe, viszont az összetétel változása egyetlen „bruttó” reakcióegyenlettel és a hozzá tartozó „bruttó” sebességi egyenlettel kielégítően leírható. Ekkor összetett reakcióról beszélünk, amelynek mechanizmusán a háttérben futó elemi reakciók összességét értjük. Erről a „Reakciómechanizmusok analízise” témakörben részletesebben is szó lesz. • Összetett reakcióknál a sebességi egyenlet sokféle alakú lehet. Külön említést érdemel a következő (elemi reakcióhoz hasonló): Itt azonban az αj kitevőkre – az egyes anyagfajtákra vonatkozó részrendekre – nincsenek szigorú kikötések.

A kinetikai differenciálegyenletek és cj(0) = c 0 j (2 -vel korábbi slide) • A kinetikai differenciálegyenlet-rendszer megoldása csak akkor fogadható el, ha nemnegatív kezdeti értékből indulva t > 0 esetén nemnegatív marad. • A megoldásnak a teljes t > 0 tengelyre értelmezve kell lennie. • A kinetikai differenciálegyenletek megoldásának létezése, pozitivitása és korlátossága a matematika által nyújtott eszközökkel precízen és általánosan vizsgálható. • Léteznek eredmények a változó T rendszerekre is.

A kinetikai differenciálegyenletek és cj(0) = c 0 j • A megoldás analitikus alakban (tehát véges képlettel) biztosan előállítható, ha az egyenlet jobb oldala az ismeretlenek lineáris függvénye. Ez a lineáris differenciálegyenletekre vonatkozó tételekből következik. • A nemlineáris jobb oldalú rendszerek csak egyszerű esetekben oldhatók meg analitikusan. Ilyen például a következő állandó térfogatú rendszer: X+Y→Z w = k[X][Y] (A koncentrációt a szokásos módon szögletes zárójellel jelöltük. )
![A kinetikai differenciálegyenletek Nemlineáris jobb oldalú rendszerek XYZ w kXY A A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • A](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-12.jpg)
A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • A kinetikai differenciálegyenletek: • A kezdeti feltételek (t = 0 időpontban): [X](0) = [X]0 [Y](0) = [Y]0 [Z](0) = [Z]0 • A rendszer egyszerűsítése céljából felhasználjuk, hogy a megoldás teljes értelmezési intervallumán , így [X] – [Y] = [X]0 – [Y]0 • Ezt felhasználva: [Y] = [Y]0 – [X]0 + [X] és
![A kinetikai differenciálegyenletek Nemlineáris jobb oldalú rendszerek XYZ w kXY Ebben A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • Ebben](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-13.jpg)
A kinetikai differenciálegyenletek – Nemlineáris jobb oldalú rendszerek X+Y→Z w = k[X][Y] • Ebben már csak egyetlen ismeretlen függvény ([X]) szerepel. A szeparálható változójú differenciálegyenlet megoldása: ahol [Y]0 – [X]0 ≠ 0 • Ebből [X] a t idő függvényeként kifejezhető, ezt felhasználva pedig [Y] = [Y]0 – [X]0 + [X] és (mivel [Z] + [X] = [Z]0 + [X]0) [Z] = [Z]0 + [X]0 – [X] is megadható.

A kinetikai differenciálegyenletek • A bonyolult kinetikai rendszerekben – amelyek rendszerint sok egyszerre lejátszódó reakciót tartalmaznak – az összetétel változása célszerűen a kinetikai differenciálegyenletek numerikus megoldásával határozható meg. (Ez sem mindig könnyű feladat, mert a kinetikai differenciál-egyenletek sok esetben nehezen kezelhető, ún. „merev” („stiff”) rendszerek. )

A reakciókinetika feladata • A reakciókinetika direkt feladata az, hogy a lejátszódó reakciók és sebességi egyenleteik ismeretében megadja a rendszer összetételének (és esetleg hőmérsékletének, nyomásának) időbeli változását. • Az ipari és egyéb alkalmazások során rendszerint a direkt feladat megoldására van szükség. Az ehhez szükséges egyenleteket az előző pontokban már áttekintettük. • Jelenleg még nem ismerünk olyan törvényt, amely megadná, hogy adott reaktánsok összekeverésekor milyen kémiai reakciók fognak létrejönni. A reakciókinetikai kutatások során a legtöbb esetben a mért időbeli adatok (pl. koncentrációk) segítségével megpróbáljuk meghatározni, hogy milyen sztöchiometriájú és sebességű kémiai reakciók játszódnak le a vizsgált rendszerben. Ez a reakciókinetika inverz feladata.

A reakciókinetika feladata • Az egyszerűbb reakciók felderítésére alkalmas, főként grafikus módszerekkel Fizikai Kémia II. -n foglalkoztunk. • A bonyolult kinetikai rendszereket általában számítógép segítségével tanulmányozzuk. A mérési adatok illesztésénél a következő célfüggvényt szokás használni: ahol p = (p 1, p 2, …, pm) a paraméterek vektora, N a mérési adatpontok száma, yjexp a j-edik mért adatpont, σ(yjexp) a j-edik kísérleti adatpont szórása, yjm a j-edik adatpontnak megfelelő, p paraméterkészlettel számított érték. • A feladat megtalálni azt a p paramétervektort, amelynél a legkisebb az E(p) célfüggvény értéke.

A reakciókinetika feladata • Gyakran felmerülő nehézség, hogy az E(p) célfüggvénynek több minimumhelye van. Ekkor a globális minimumot kell megtalálni. • Szintén gyakori, hogy a kémiai feladat meghatározza, hogy az optimális paramétervektort a p mely tartományában kell keresni. • A célfüggvény használata esetén a méréseket a legkisebb négyzetes eltérés szerint legjobban leíró paraméterkészletet keressük. Mivel a mért adatok szórnak, emiatt nem várható, hogy minden adatot pontosan leírjon a modell (ez az E(p) = 0 esetnek felelne meg). Ha nagyon jó a modell egyezése a mérési adatokkal (tehát a mérési adatok eltérését a modelltől csak a mérési adatok szórása okozza), akkor E(p) ≈ 1.

Hőmérsékletfüggés • A tapasztalat szerint a reakciósebesség függ a T-től. Számos esetben jó közelítéssel érvényes az eredeti Arrhenius-egyenlet: • Széles (több száz K) hőmérséklettartományban ez általában már nem alkalmazható és ilyenkor az ún. kiterjesztett Arrhenius-egyenletet szokták használni:

Hőmérsékletfüggés • Az eredeti Arrhenius-egyenlet viszonylag egyszerű magyarázatát adja az ütközési elmélet, amely a gázfázisú A+B→P w = k[A][B] reakció sebességi együtthatóját a következőképpen adja meg: ahol P a sztérikus faktor, σ a két molekula ütközési hatáskeresztmetszete, μ a redukált tömeg, k. B a Boltzmann-állandó, T a termodinamikai hőmérséklet, NA az Avogadro-állandó, R a gázállandó, Ea az aktiválási energia. • P az ütköző molekulák egymáshoz viszonyított helyzetét veszi figyelembe. • σ értéke RA és RB sugarú, merev gömb alakú részecskék esetén: • μ az A és B részecske m. A és m. B tömegéből számítható ki: Az ütközési elmélet hátránya, hogy P és Ea értékét paraméterként kezeli, azokat kiszámítani nem képes.

Hőmérsékletfüggés • Az átmeneti komplex elmélete összefüggést teremt a sebességi együttható és a reagáló részecskék, valamint a belőlük képződő átmeneti komplex anyagszerkezeti adatai között. • A gázfázisú A + B ⇌ C# → P reakcióra az Eyring-egyenlet értelmében: ahol κ a transzmissziós tényező, h a Planck-állandó, p 0 a standard nyomás, ΔE 0 a nullponti energiák különbsége, q. A 0, q. B 0 és q. C 0 az A, B és C# részecskék állapotösszegei (amelyek a részecskék transzlációs, rotációs és vibrációs állapotösszegeinek szorzatát jelentik). A – vonal azt jelenti, hogy a q. C 0 állapotösszegből a C# széteséséhez vezető rezgés állapotösszegét leválasztottuk.

Hőmérsékletfüggés • Főként az ipari gyakorlatban változó hőmérsékletű kinetikai rendszerekkel is találkozunk. Ekkor a kinetikai differenciálegyenletekhez a hőmérséklet változását leíró egyenlet is társul: A Jq hőáram hőszigetelt rendszerben nulla, egyébként pedig gyakran arányos a rendszer és a környezet hőmérsékletének különbségével. Az egyenletben szerepelnek a wi reakciósebességek, amelyek függenek a hőmérséklettől. A változó hőmérsékletű rendszerek tényleges szimulációjához szükséges, hogy ezt a függést megadjuk.

KINETIKAI EGYSZERŰSÍTŐ ELVEK • Póta György: Modern fizikai kémia (Digitális Tankönyvtár, 2013), 2. 5. 3 fejezet • P. W. Atkins: Fizikai kémia III. (Tankönyvkiadó, Budapest, 2002)

Kinetikai egyszerűsítő elvek • A kinetikai egyszerűsítő elvek segítségével egy bonyolult mechanizmus (vagy annak kinetikai differenciálegyenlet-rendszere) egyszerűsíthető. • Ha egy kinetikai differenciálegyenlet-rendszert a megmaradó mennyiségek figyelembe vételével egyszerűsítenek, akkor az egyszerűsített modell eredménye pontosan azonos lesz az eredeti modellével. • A nagy feleslegben alkalmazott reaktáns, a gyors előegyensúly, a sebesség-meghatározó lépés és a kvázistacionárius közelítés eltérő módon, de mind a reakciókinetikai modellben levő nagyon különböző időskálák létezését használják fel. Az így kapott szimulációs eredmények nem azonosak az eredeti mechanizmussal kapott megoldással, de a hiba kicsi (1% alatti).

Megmaradó mennyiségek • Sok reakciómechanizmus olyan rendszert ír le, amelyben megmaradó mennyiségek vannak. • Zárt rendszerben ilyen a rendszer összes tömege, az anyagfajták • • anyagmennyiségének összege (ha minden reakciólépésre teljesül, hogy az anyagmennyiség-változás a reakciólépés során nulla). Állandó térfogatú rendszerben a moláris koncentrációk összege is állandó. Zárt rendszerben kémiai reakciók nem változtathatják meg az elemek anyagmennyiségét, tehát minden elemre külön-külön az összes anyagmennyiségük megmaradó mennyiség. Megmaradó mennyiség az összes entalpia adiabatikus rendszerben, …vagy a töltés elektrokémiailag zárt rendszerekben. Ugyancsak megmaradó mennyiségként jelenik meg, ha egy atomcsoport nem változik meg a reakciólépések során (megmaradó atomcsoport). Ilyen lehet például az adenozin-csoport; ekkor az AMP, ADP és ATP összege a zárt biokémiai reakciórendszerben állandó.

Megmaradó mennyiségek • Ha egy NS anyagfajtát tartalmazó mechanizmusban NC megmaradó mennyiséget lehet azonosítani, akkor a kinetikai differenciálegyenlet-rendszernek N = NS – NC független változója van. • Ekkor tehát elegendő N anyagfajta koncentrációját számítani a differenciálegyenlet-rendszer megoldásával, és a többi NC anyagfajta koncentrációja a megmaradó mennyiségek kezdeti értéke alapján számítható. • A kinetikai differenciálegyenlet-rendszer változói számának csökkentése a megmaradó mennyiségek alapján nem közelítés, ilyenkor az eredetivel pontosan azonos megoldást kapunk.

Megmaradó mennyiségek Példa: • Az A → B → C sorozatos elsőrendű reakciórendszerben mindkét reakciólépés során a reakcióegyenlet bal és jobb oldalán az anyagfajták anyagmennyisége megegyezik. A reakciólépések során tehát az anyagmennyiség megőrződik, emiatt állandó térfogatú zárt rendszerben minden t időpillanatban: [A](t) + [B](t) + [C](t) = [A]0 + [B]0 + [C]0 • Elegendő tehát csak az A és B anyagfajták koncentráció– idő függvényét számítanunk, ebből C koncentrációja minden időpontban számítható: [C](t) = [A]0 + [B]0 + [C]0 – [A](t) – [B](t)

Nagy feleslegben alkalmazott reaktáns • A „nagy feleslegben alkalmazott reaktáns”-közelítés akkor alkalmazható, ha az egyik reaktánsból olyan sok van jelen, hogy a reakció során koncentrációja elhanyagolható mértékben változik meg, és így állandónak tekinthető. Ennek alapján pl. másodrendű reakciólépés elsőrendűvé alakítható át, és ebben a speciális esetben a módszer neve pszeudo-elsőrendű közelítés. X+Y→Z w = k[X][Y] • A megoldás az [X]0 ≠ [Y]0 esetre: [Y] = [Y]0 – [X]0 + [X] és [Z] = [Z]0 + [X]0 – [X]
![Nagy feleslegben alkalmazott reaktáns Sokkal könnyebb dolgunk van ha X0 Y0 mert Nagy feleslegben alkalmazott reaktáns • Sokkal könnyebb dolgunk van, ha [X]0 << [Y]0, mert](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-28.jpg)
Nagy feleslegben alkalmazott reaktáns • Sokkal könnyebb dolgunk van, ha [X]0 << [Y]0, mert ekkor Y koncentrációja a reakció végéig alig változik. Ekkor bevezethetünk egy új k′=k [Y]0 sebességi együtthatót, ami az X → Z reakcióhoz tartozik. E reakció következtében az X koncentrációja elsőrendű kinetika szerint csökken: • Az X koncentrációjának lecsengéséből minden Y koncentrációhoz kiszámítják a pszeudo-elsőrendű k′ sebességi együtthatót, majd az [Y] - k′ adatpárokból, egyenest illesztve határozzák meg a k másodrendű sebességi együtthatót: [X] k′ Meredekség = k [Y] idő
![Nagy feleslegben alkalmazott reaktáns A módszer előnye hogy nem kell az X abszolút Nagy feleslegben alkalmazott reaktáns • A módszer előnye, hogy nem kell az [X] abszolút](https://slidetodoc.com/presentation_image_h/ba2832d2ebb9c20e40b610b794be1f78/image-29.jpg)
Nagy feleslegben alkalmazott reaktáns • A módszer előnye, hogy nem kell az [X] abszolút értékét megmérni, elég az X koncentrációjával arányos jelet mérni a kísérletben (például fényelést vagy fluoreszcens jelet); ekkor az exponenciális lecsengési görbe illesztésével már meghatározható a k′ együttható. [X]-val arányos jel [X] idő

Nagy feleslegben alkalmazott reaktáns Példa: • Az ·OH + C 2 H 6 = ·C 2 H 5 + H 2 O gázfázisú elemi reakció sebességi együtthatóját szeretnénk meghatározni. A kezdeti reakcióelegyben C 2 H 6 és HNO 3 van Ar hígítógázban. • A C 2 H 6 és a HNO 3 nem reagál egymással, de a 193 nm hullámhosszú lézerfény villanása a salétromsav egy részét elbontja, és a HNO 3 + hν = ·OH + NO 2 reakcióban OH-gyökök képződnek. • Ha a lézervillanás után az OH-gyök és a C 2 H 6 összemérhető koncentrációban lenne jelen, akkor az OH-gyök abszolút koncentrációját kellene mérni, ami nehéz feladat.

Nagy feleslegben alkalmazott reaktáns Példa: • Az ·OH + C 2 H 6 = ·C 2 H 5 + H 2 O gázfázisú elemi reakció sebességi együtthatóját szeretnénk meghatározni. A kezdeti reakcióelegyben C 2 H 6 és HNO 3 van Ar hígítógázban. • A C 2 H 6 és a HNO 3 nem reagál egymással, de a 193 nm hullámhosszú lézerfény villanása a salétromsav egy részét elbontja, és a HNO 3 + hν = ·OH + NO 2 reakcióban OH-gyökök képződnek. • Ehelyett az C 2 H 6 -t változó, de ismert koncentrációban, több ezerszeres feleslegben alkalmazzák. Ekkor elegendő olyan módszer választani (pl. fluoreszcens fény erősségének mérése), amivel az OH-gyök koncentrációjával arányos jelet mérhetünk.

Nagy feleslegben alkalmazott reaktáns Példa: Az C 2 H 6 -t nagy koncentrációban alkalmazzák, majd a mért exponenciális görbe illesztésével meghatározzák az adott C 2 H 6 koncentrációhoz tartozó k′ pszeudo-elsőrendű sebességi együtthatót.

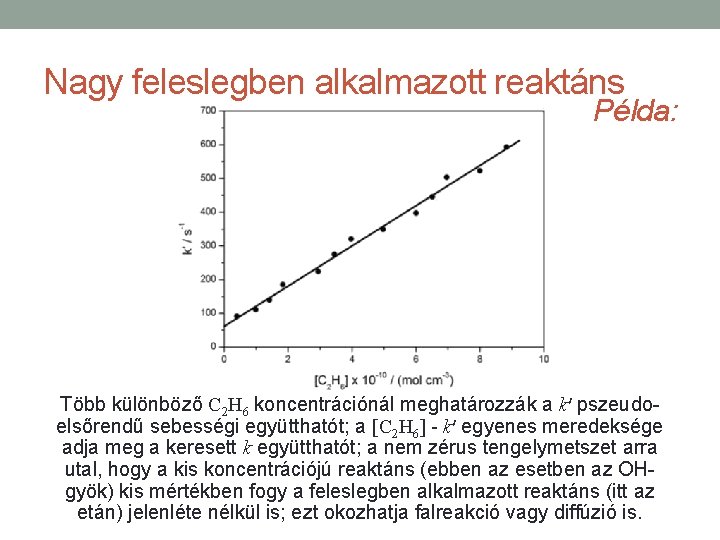
Nagy feleslegben alkalmazott reaktáns Példa: Több különböző C 2 H 6 koncentrációnál meghatározzák a k′ pszeudoelsőrendű sebességi együtthatót; a [C 2 H 6] - k′ egyenes meredeksége adja meg a keresett k együtthatót; a nem zérus tengelymetszet arra utal, hogy a kis koncentrációjú reaktáns (ebben az esetben az OHgyök) kis mértékben fogy a feleslegben alkalmazott reaktáns (itt az etán) jelenléte nélkül is; ezt okozhatja falreakció vagy diffúzió is.

Gyors előegyensúly • A „gyors előegyensúly”-közelítés akkor alkalmazható, ha egy gyors egyensúlyi reakciólépés-pár anyagfajtáit lassú reakciók fogyasztják vagy termelik. • Beállt egyensúly esetén az odairányú és a visszairányú reakciók sebessége egymással egyenlő, emiatt a részt vevő anyagfajták koncentrációinak aránya számítható a reakciólépések sztöchiometriája és az egyensúlyi állandó alapján. • Feltételezzük, hogy ha az egyensúlyi reakciólépések sebessége jóval nagyobb, mint az egyéb reakciólépéseké, akkor az egyensúlyi reakcióban résztvevő reaktánsok és termékek koncentrációaránya ugyanúgy számítható, mintha a lassú reakciólépések nem is lennének ott.

Gyors előegyensúly Példa: • Egy X ⇌ Y egyensúlyi reakció sebességi együtthatói k 1 és k-1, az egyensúlyi állandó pedig: K 1 = k 1/k-1. • Beállt egyensúly esetén az ellentétes irányú folyamatok sebessége azonos: k 1 [X] = k-1 [Y], így [Y] = (k 1/k-1)[X] = K 1 [X]. • Tegyük fel, hogy az Y reaktánst egy harmadik, az előző kettőnél sokkal lassabb reakció is fogyasztja, aminek a sebességi együtthatója k 2. A „gyors előegyensúly”-közelítés szerint ebben az X ⇌ Y → Z reakciórendszerben is jó közelítéssel [Y] = K 1 [X]. Ez azt jelenti, hogy: • Az enzimkinetikai mechanizmusoknál különösen gyakori, hogy a termék keletkezésének k′ = k 2 K 1 sebességi együtthatóját úgy adják meg, mint az enzim két (kevésbé reaktív X és nagyon reaktív Y) formája közötti átalakulást jellemző K 1 egyensúlyi állandó és a B továbbalakulását jellemző k 2 sebességi együttható szorzatát.

Sebesség-meghatározó lépés • Sebesség-meghatározó lépésnek nevezik azt a reakciólépést, aminek értéke meghatározza a termék keletkezési sebességét. • Ha a végtermék elsőrendű reakciók sorozatán keresztül keletkezik a kiindulási anyagból, akkor a legkisebb sebességi együtthatójú reakció lesz a sebesség-meghatározó lépés. • Tetszőleges mechanizmus esetén az a reakciólépés a sebességmeghatározó, amelyik sebességi együtthatójának kis megváltoztatására a végtermék termelődési sebessége jelentősen megnő. Ez általában nem a legkisebb sebességi együtthatójú reakció! • Ha egy végtermék koncentrációjának számítjuk a normált lokális érzékenységi együtthatóit (lásd később), akkor azt tapasztaljuk, hogy a legnagyobb érzékenységi együtthatónak megfelelő reakciólépés a sebesség-meghatározó.

Sebességmeghatározó lépés Példa: • Tegyük fel, hogy az F végtermék az A kiindulási anyagból sorozatos elsőrendű reakciók útján keletkezik: • A C anyag keletkezését a B anyagból a d[C]/dt = k 2[B] egyenlet írja le. Ha azonban k 2 << k 1, k 3, k 4, k 5, akkor a keletkező C anyag nagyon gyorsan továbbalakul, és hamarosan F keletkezik belőle. Ennek az F anyagnak a keletkezése is leírható tehát a d[F]/dt = k 2 [B] egyenlettel. • Tehát ha k 1, k 3, k 4 és k 5 sokkal nagyobb, mint k 2, akkor az F keletkezési sebességét csak k 2 értéke szabja meg. • Így F és B koncentrációváltozásának mérésével csak a k 2 sebességi együtthatót lehet meghatározni. Láthatjuk azt is, hogy elsőrendű reakciósorozatban nem feltétlenül az első reakció a sebességmeghatározó.

Kvázistacionárius közelítés • A kvázistacionárius közelítést annak egyik első alkalmazója után szokás Bodenstein-elvnek, illetve angol nevének (quasi steady-state approximation) rövidítése után QSSAnak nevezni.

Kvázistacionárius közelítés • A módszer lényege: 1. A reakciómechanizmus anyagfajtái közül kiválasztunk egyeseket, amelyeket a többitől eltérően kezelünk és amelyeket a továbbiakban kvázistacionárius (QSSA-) anyagoknak fogunk nevezni. A QSSA-anyagok általában nagy reaktivitású és kis koncentrációjú köztitermékek, mint pl. a gyökök. 2. Az ezen anyagok koncentrációváltozását leíró differenciálegyenletekben a bal oldalt nullával tesszük egyenlővé. A kapott egyenletek egy algebrai (tehát nem differenciál-) egyenletrendszert alkotnak, amely megadja, hogyan függ a QSSA-anyagok koncentrációja a többi (nem QSSA-) anyag koncentrációjától.

Kvázistacionárius közelítés • A módszer lényege: 3. A nem QSSA-anyagokra vonatkozó differenciálegyenletrendszer és a QSSA-anyagokra vonatkozó algebrai egyenletrendszer együtt úgynevezett csatolt differenciál-algebrai egyenletrendszert ad. Ezt az egyenletrendszert megoldva az eredeti kinetikai differenciálegyenlet-rendszerével csaknem azonos megoldást kaphatunk, amennyiben helyesen választottuk ki a kvázistacionárius anyagfajtákat. 4. Szerencsés esetben az algebrai egyenletrendszer külön is megoldható, tehát az egyes QSSA-anyagfajták koncentrációját explicit algebrai egyenletekkel ki tudjuk számítani, és ezeket az explicit algebrai egyenleteket be tudjuk írni a nem QSSAanyagok differenciálegyenlet-rendszerébe. Gyakran, de nem mindig, a kapott differenciálegyenlet-rendszernek meg tudunk feleltetni egyszerűbb reakciómechanizmust.

Kvázistacionárius közelítés • A kvázistacionárius közelítés úgy is felfogható, hogy a nemkvázistacionárius anyagfajták koncentrációjából algebrai úton kiszámítható az összes kvázistacionárius anyagfajta koncentrációja. Bármi volt kezdetben a kvázistacionárius anyagfajták koncentrációja, előbb-utóbb ezek a koncentrációk a QSSA-közelítésből kapott algebrai egyenletek megoldásából adódó értékek közelében lesznek. A kvázistacionárius közelítés kulcsa, hogy mely anyagokat választjuk kvázistacionárius anyagfajtának, és hogy mekkora hibát követünk el a QSSA alkalmazásával.

Kvázistacionárius közelítés Összefüggés egy anyagfajta koncentrációja, annak koncentrációváltozási sebessége, és a QSSA- és a valódi koncentráció különbsége, tehát a kvázistacionárius közelítés hibája között.

Kvázistacionárius közelítés Példa: • A kvázistacionárius közelítés szokásos alappéldája: • Ha k 2>>k 1, akkor a B anyag nagyon gyorsan reagál, és alkalmazható rá a kvázistacionárius közelítés. Ekkor B koncentrációját nem a d[B]/dt = k 1[A]−k 2[B] differenciálegyenlettel, hanem a következő algebrai egyenlettel számítjuk: 0 = k 1[A] − k 2[B] • Ebből B koncentrációja kifejezhető: Mivel a kiindulási feltételezésünk szerint k 2 >> k 1, ezért B koncentrációjának lefutása hasonló alakú lesz, mint A-é, csak sokkal kisebb értékekkel. Nyilvánvaló, hogy ha [B]0 kezdeti értéke nulla volt, akkor ez csak egy bizonyos időtartam (az úgynevezett „indukciós periódus”) letelte után teljesülhet.
 Klasszikus termékhagymamodell
Klasszikus termékhagymamodell Gyrgy
Gyrgy Gyrgy
Gyrgy Fizikai evolúció
Fizikai evolúció Fizikai jelek
Fizikai jelek Fizikai munka rejtvény
Fizikai munka rejtvény Fizikai felmérő rendőrség 2021
Fizikai felmérő rendőrség 2021 Csben
Csben Fizikai változás fogalma
Fizikai változás fogalma Repülés fizikai alapjai
Repülés fizikai alapjai Atkins fizikai kémia
Atkins fizikai kémia Koacervátum
Koacervátum Pascal háromszög
Pascal háromszög Alma mater
Alma mater Canvas te
Canvas te Hangtechnika alapok
Hangtechnika alapok Autocad parancssor
Autocad parancssor Autocad alapok
Autocad alapok Python alapok
Python alapok Html alapok elte
Html alapok elte Vektor hosszának kiszámítása
Vektor hosszának kiszámítása Sql alapok
Sql alapok Nn befektetési alapok
Nn befektetési alapok Autocad alapok
Autocad alapok Gitflow
Gitflow Powershell alapok
Powershell alapok Java alapok
Java alapok Active directory alapok
Active directory alapok Nn alapok
Nn alapok Excel alapok
Excel alapok Texte autocad
Texte autocad Active directory alapok
Active directory alapok Nys pta bylaws
Nys pta bylaws Fourth district pta
Fourth district pta Pta
Pta Pta diversity and inclusion
Pta diversity and inclusion Pta chanel
Pta chanel Teresa avvampato
Teresa avvampato Missouri pta
Missouri pta Georgia pta reflections
Georgia pta reflections Ncpta bylaws
Ncpta bylaws Pta membership drive ideas
Pta membership drive ideas Suffolk region pta
Suffolk region pta Zaanlands lyceum overgangsnormen
Zaanlands lyceum overgangsnormen