Klassifizierung elektroanalytischer Methoden ohne Elektrodenreaktion Kennzeichen mit Elektrodenreaktion




















- Slides: 43

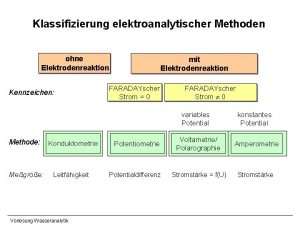
Klassifizierung elektroanalytischer Methoden ohne Elektrodenreaktion Kennzeichen: mit Elektrodenreaktion FARADAYscher Strom = 0 FARADAYscher Strom 0 variables Potential Methode: Meßgröße: Konduktometrie Leitfähigkeit Vorlesung Wasseranalytik Potentiometrie Potentialdifferenz konstantes Potential Voltametrie/ Polarographie Amperometrie Stromstärke = f(U) Stromstärke

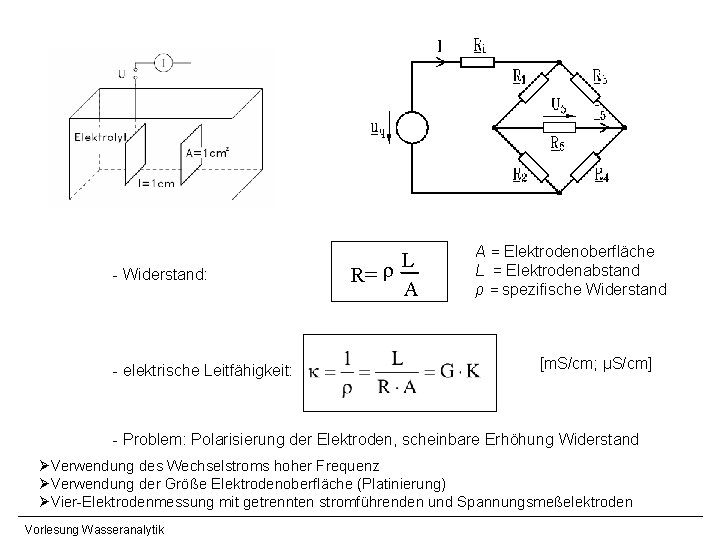
Elektrochemische Analysenmethoden • Leitfähigkeitsmessung (konduktometrisch) • p. H-Wert-Bestimmung (potentiometrisch) • Ionenselektive Elektroden (potentiometrisch) • Redoxpotentialmessung (potentiometrisch) • Erfassung des gelösten Sauerstoffs (amperometrisch) • Voltametrie/Polarographie Leitfähigkeit - summarische Methode - konduktometrische Bestimmung der Ionenstärke/gelösten Salze - keine Aussagen über Ionenarten Prinzip: - Zusammenhang Leitfähigkeit - Konzentration Elektrolyte - Messung Widerstand: WHEATSTON‘sche Brückenschaltung Vorlesung Wasseranalytik

- Widerstand: - elektrische Leitfähigkeit: L r R= A A = Elektrodenoberfläche L = Elektrodenabstand ρ = spezifische Widerstand [m. S/cm; µS/cm] - Problem: Polarisierung der Elektroden, scheinbare Erhöhung Widerstand ØVerwendung des Wechselstroms hoher Frequenz ØVerwendung der Größe Elektrodenoberfläche (Platinierung) ØVier-Elektrodenmessung mit getrennten stromführenden und Spannungsmeßelektroden Vorlesung Wasseranalytik

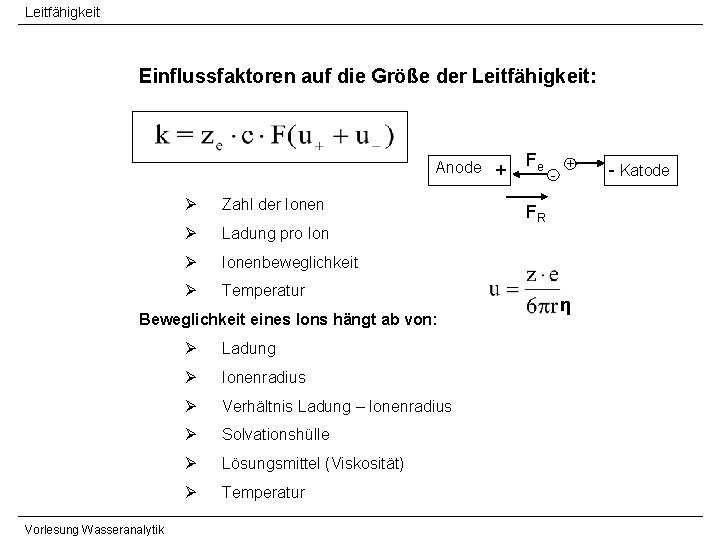
Leitfähigkeit Einflussfaktoren auf die Größe der Leitfähigkeit: Anode + Ø Zahl der Ionen Ø Ladung pro Ion Ø Ionenbeweglichkeit Ø Temperatur Beweglichkeit eines Ions hängt ab von: Vorlesung Wasseranalytik Ø Ladung Ø Ionenradius Ø Verhältnis Ladung – Ionenradius Ø Solvationshülle Ø Lösungsmittel (Viskosität) Ø Temperatur Fe - + FR η - Katode

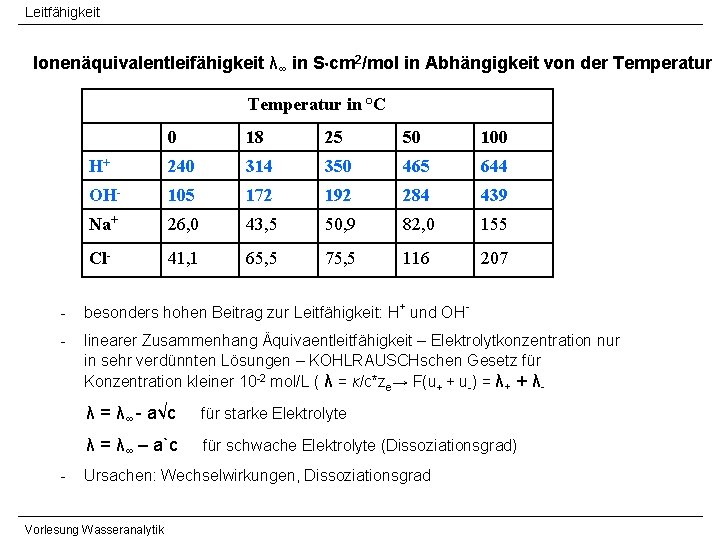
Leitfähigkeit Ionenäquivalentleifähigkeit λ∞ in S cm 2/mol in Abhängigkeit von der Temperatur in °C 0 18 25 50 100 H+ 240 314 350 465 644 OH- 105 172 192 284 439 Na+ 26, 0 43, 5 50, 9 82, 0 155 Cl- 41, 1 65, 5 75, 5 116 207 - besonders hohen Beitrag zur Leitfähigkeit: H+ und OH- - linearer Zusammenhang Äquivaentleitfähigkeit – Elektrolytkonzentration nur in sehr verdünnten Lösungen – KOHLRAUSCHschen Gesetz für Konzentration kleiner 10 -2 mol/L ( λ = κ/c*ze→ F(u+ + u-) = λ+ + λ- - λ = λ∞ - a√c für starke Elektrolyte λ = λ∞ – a`c für schwache Elektrolyte (Dissoziationsgrad) Ursachen: Wechselwirkungen, Dissoziationsgrad Vorlesung Wasseranalytik

Praxis Messtechnische Hinweise (Leitfähigkeitsmessungen sind Widerstandsmessungen mit Wechselstrom) ØKontrolle - elektrischer Kontakte auf Sauberkeit - Luftblasen im Raum zwischen der Elektroden ØGeräte besitzen in der Regel verschiedene Messbereiche (m. S/cm; µS/cm) mit Messfrequenzanpassung und Temperaturkompensation ØFunktionsprüfung/Ermittlung Zellkonstante mit definierter KCl-Lösung ØBehandlung von Messzellen (gut Spülen, Pt/Pt- Aufbewahren im Wasser) ØMessung kleiner Leitfähigkeiten unter 10 µS/cm unter Luftabschluss Vorlesung Wasseranalytik

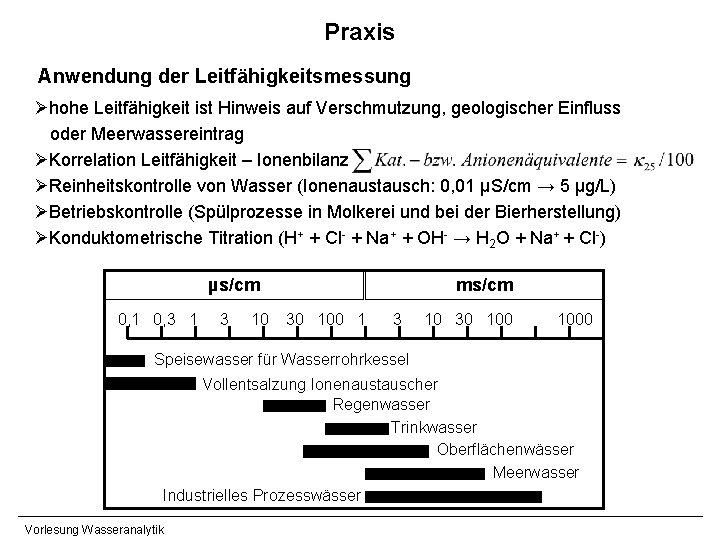
Praxis Anwendung der Leitfähigkeitsmessung Øhohe Leitfähigkeit ist Hinweis auf Verschmutzung, geologischer Einfluss oder Meerwassereintrag ØKorrelation Leitfähigkeit – Ionenbilanz ØReinheitskontrolle von Wasser (Ionenaustausch: 0, 01 µS/cm → 5 µg/L) ØBetriebskontrolle (Spülprozesse in Molkerei und bei der Bierherstellung) ØKonduktometrische Titration (H+ + Cl- + Na+ + OH- → H 2 O + Na+ + Cl-) µs/cm 0, 1 0, 3 10 ms/cm 30 100 1 3 10 30 1000 Speisewasser für Wasserrohrkessel Vollentsalzung Ionenaustauscher Regenwasser Trinkwasser Oberflächenwässer Meerwasser Industrielles Prozesswässer Vorlesung Wasseranalytik

Grundlagen der Potentiometrie Zn - Entstehung einer Galvani-Spannung ? -+ - + Zn 2+ E 0(1/2 H 2/H+) Zn. Cl 2 - Elektrodenarten (je nach der Anzahl der Gleichgewichte unterscheidet man Elektroden 1. , 2. und 3) ØElektrode 1. Art ØElektroden 2. Art ( ) ( Ag/Ag. Cl ) ØElektroden 3. Art (Ag/Ag 2 S +Pb. S) Potentialmessung • Messung der Spannung zwischen den beiden Elektroden immer stromlos Vorlesung Wasseranalytik

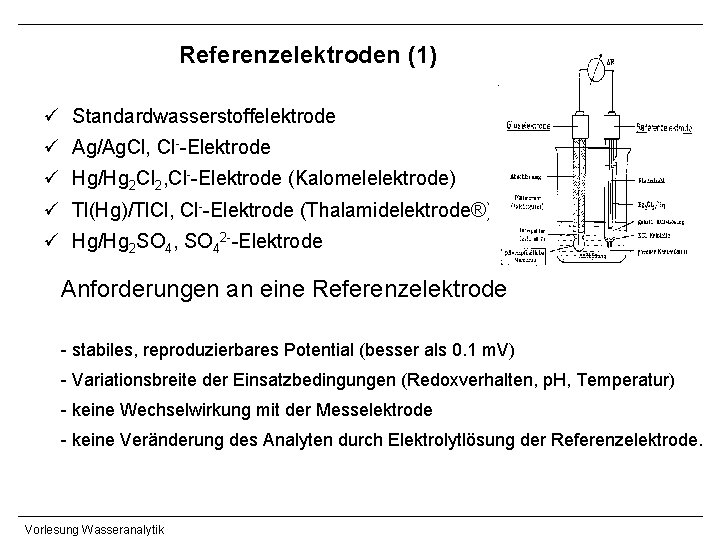
Referenzelektroden (1) ü Standardwasserstoffelektrode ü Ag/Ag. Cl, Cl--Elektrode ü Hg/Hg 2 Cl 2, Cl--Elektrode (Kalomelelektrode) ü Tl(Hg)/Tl. Cl, Cl--Elektrode (Thalamidelektrode®) ü Hg/Hg 2 SO 4, SO 42 --Elektrode Anforderungen an eine Referenzelektrode - stabiles, reproduzierbares Potential (besser als 0. 1 m. V) - Variationsbreite der Einsatzbedingungen (Redoxverhalten, p. H, Temperatur) - keine Wechselwirkung mit der Messelektrode - keine Veränderung des Analyten durch Elektrolytlösung der Referenzelektrode. Vorlesung Wasseranalytik

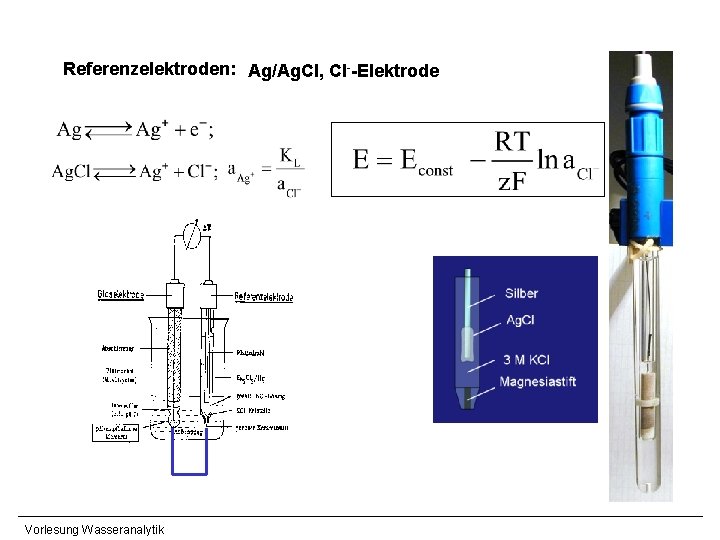
Referenzelektroden: Ag/Ag. Cl, Cl--Elektrode Vorlesung Wasseranalytik

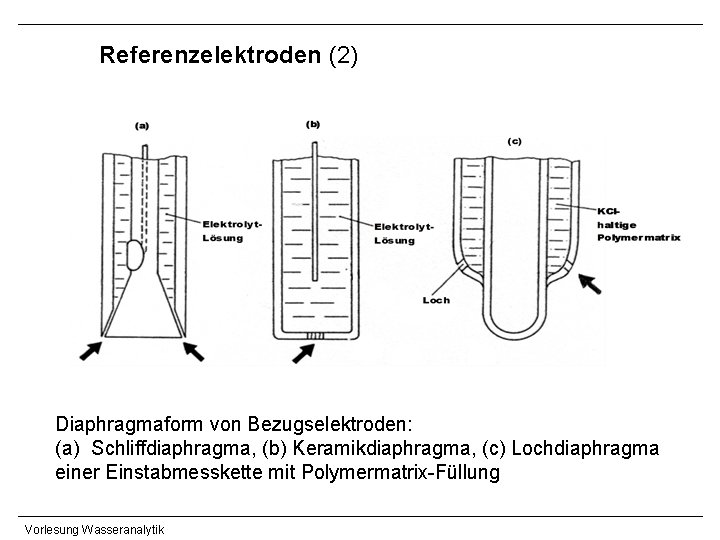
Referenzelektroden (2) Diaphragmaform von Bezugselektroden: (a) Schliffdiaphragma, (b) Keramikdiaphragma, (c) Lochdiaphragma einer Einstabmesskette mit Polymermatrix-Füllung Vorlesung Wasseranalytik

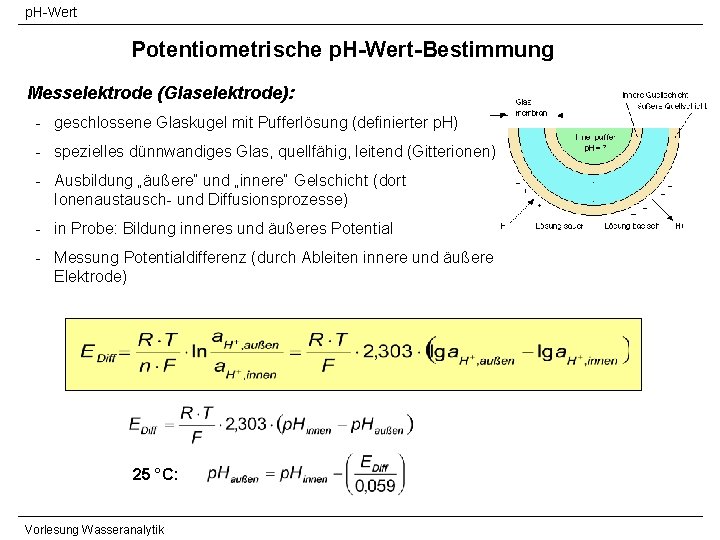
p. H-Wert Potentiometrische p. H-Wert-Bestimmung Bedeutung: - allgemeiner Parameter Feststellung Gewässergüte (Trinkw. V: p. H= 6, 5… 9, 5) - Kriterium für Möglichkeit stattfindender Prozesse 5 Fe. S 2 + 14 NO 3 - + 8 H 2 O = 7 N 2 + 10 SO 42 - + 5 Fe. OOH + 11 H+ 2 Fe. S 2 + 7 O 2 + 2 H 2 O = 2 Fe 2+ + 4 SO 42 - + 4 H+ - Bedeutung für Optimierung vieler Verfahren der Wasseraufbereitung Aussagen zu einzelnen Wasserinhaltsstoffen/Prozessen Prinzip: - Messung: Potentialdifferenz Bezugselektrode – Messelektrode - Bezugselektrode: konstantes, bekanntes Potential - Messelektrode: Potential wird durch p. H-Wert bestimmt - Potentialbestimmender Prozess: Diffusions- und Ionenaustauschvorgang Vorlesung Wasseranalytik

Sulfat- und Nitratkonzentrationen im oberflächennahen Grundwasser und Pyritgehalt im Sediment, Mockritz N River Elbe N Elbe Sediment Pyrit in mg/kg Wasser Sulfat in mg/L 1100 700 Elbe Wasserwerk 8000 Wasserwerk 6000 4000 500 2000 300 0 200 0 150 mg/L 0 m g/L NO 3 20 Brunnen Fließrichtung 1 km 0 m g/ L N O 3 1 km 5 Fe. S 2 + 14 NO 3 - + 8 H 2 O = 7 N 2 + 10 SO 42 - + 5 Fe. OOH + 11 H+ Vorlesung Wasseranalytik

Vorlesung Wasseranalytik

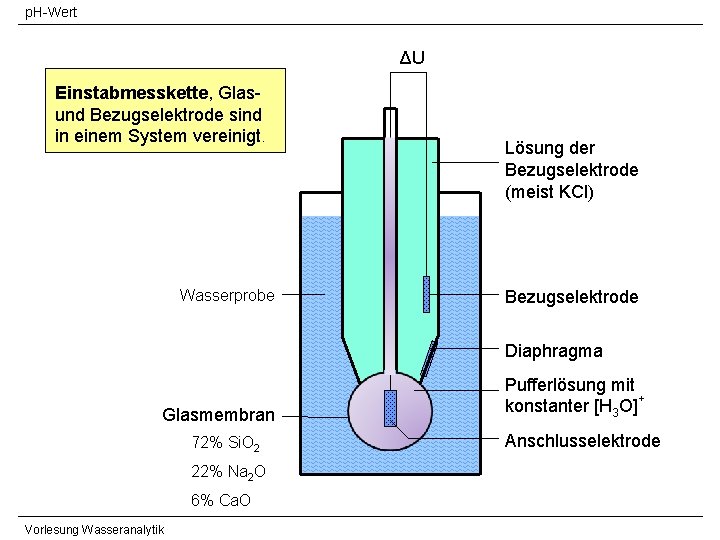
p. H-Wert ΔU Einstabmesskette, Glasund Bezugselektrode sind in einem System vereinigt. Wasserprobe Lösung der Bezugselektrode (meist KCl) Bezugselektrode Diaphragma Glasmembran 72% Si. O 2 22% Na 2 O 6% Ca. O Vorlesung Wasseranalytik Pufferlösung mit konstanter [H 3 O]+ Anschlusselektrode

p. H-Wert Potentiometrische p. H-Wert-Bestimmung Messelektrode (Glaselektrode): - geschlossene Glaskugel mit Pufferlösung (definierter p. H) - spezielles dünnwandiges Glas, quellfähig, leitend (Gitterionen) - Ausbildung „äußere“ und „innere“ Gelschicht (dort Ionenaustausch- und Diffusionsprozesse) - in Probe: Bildung inneres und äußeres Potential - Messung Potentialdifferenz (durch Ableiten innere und äußere Elektrode) 25 °C: Vorlesung Wasseranalytik

Vorlesung Wasseranalytik

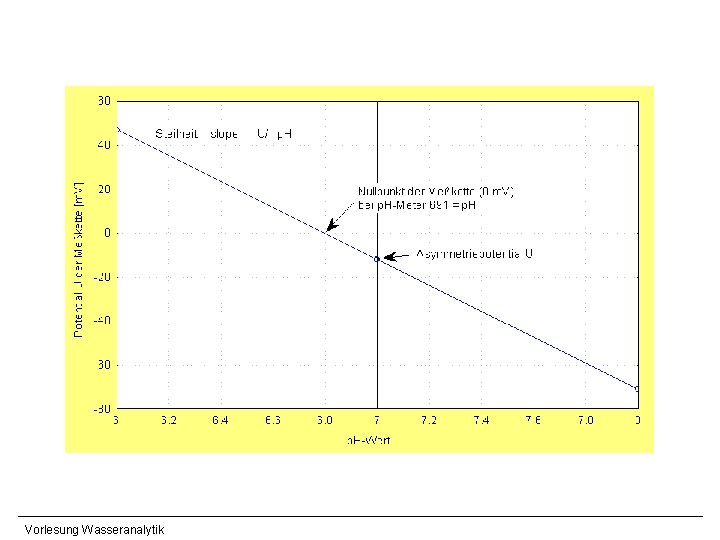
p. H-Wert Potentiometrische p. H-Wert-Bestimmung Praxis: - p. H-Messung temperaturabhängig (NERNST), i. a. Temperatur kompensiert - vor der ersten Benutzung: Quellen der Elektrode - Einstabmessketten in KCl-Lösung aufbewahren - Glaselektrode nicht trocken abreiben, nie erhitzen - Messung in stark alkalischen Medien möglichst kurz - öl-, fetthaltige Wässer: spezielle Reinigung (u. a. Ethanol) - mindestens je Messtag kalibrieren (Steilheit) Vorlesung Wasseranalytik

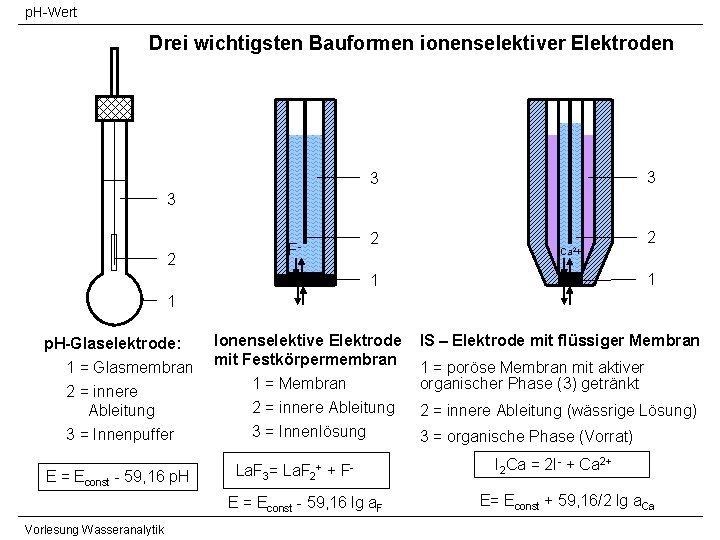
p. H-Wert Potentiometrie weiter ionenselektive Elektroden: (Festkörper- und Flüssigmembranelektroden) - potentiometrische Verfahren - Messelektrode: Innenraum bekannte Lösung, außen: Probelösung und Bezugselektrode - dazwischen heterogene Membran oder kristalliner Festkörper (schwerlösliches, anorganisches Salz) - an der Phasengrenze Messlösung – Membran (Festkörper) bilden Stoffe selektiv Potential aus (Funktion der Konzentration) - Ziel: nur einzelne Ionenart messbar, in der Praxis oft Querempfindlichkeit Beispiele: - fluorselektive Elektrode (Lanthanfluoridkristall) - Festkörperelektroden für Silber-, Chlorid-, Bromid-, Iodid- und Sulfidmessungen Vorlesung Wasseranalytik

p. H-Wert Drei wichtigsten Bauformen ionenselektiver Elektroden 3 3 3 2 F- 2 Ca 2+ 2 1 1 1 p. H-Glaselektrode: 1 = Glasmembran 2 = innere Ableitung Ionenselektive Elektrode mit Festkörpermembran 3 = Innenpuffer E = Econst - 59, 16 p. H 1 = Membran 1 = poröse Membran mit aktiver organischer Phase (3) getränkt 2 = innere Ableitung (wässrige Lösung) 3 = Innenlösung 3 = organische Phase (Vorrat) La. F 3= La. F 2+ + FE = Econst - 59, 16 lg a. F Vorlesung Wasseranalytik IS – Elektrode mit flüssiger Membran I 2 Ca = 2 I- + Ca 2+ E= Econst + 59, 16/2 lg a. Ca

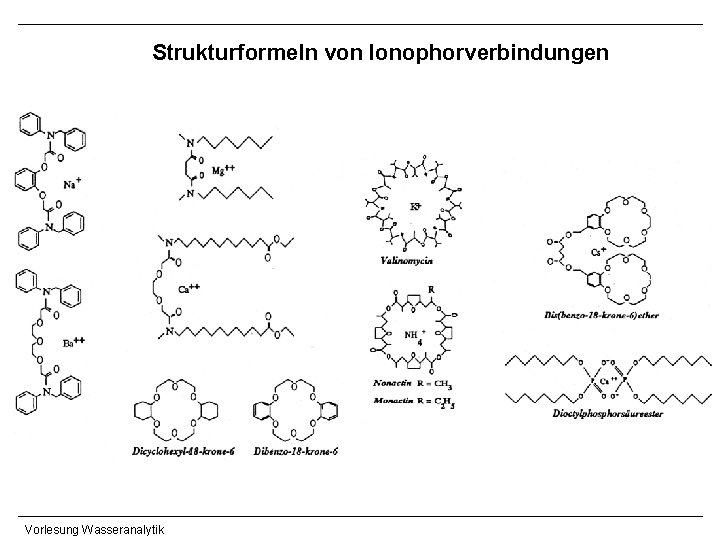
Strukturformeln von Ionophorverbindungen Vorlesung Wasseranalytik

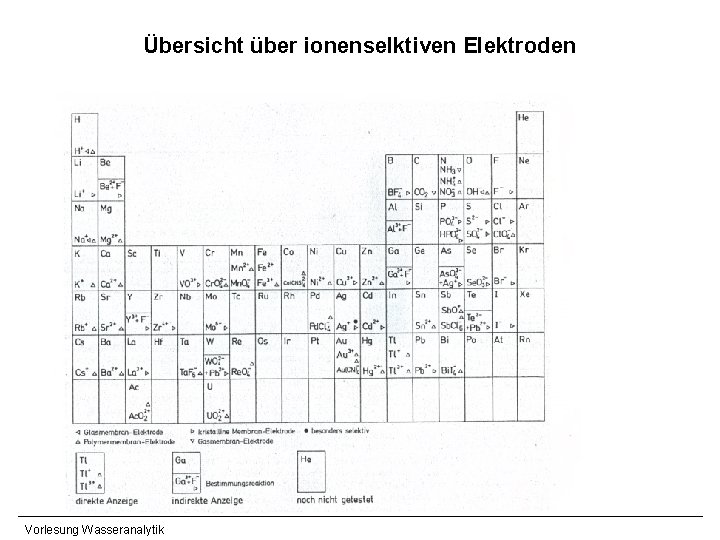
Übersicht über ionenselktiven Elektroden Vorlesung Wasseranalytik

Redoxpotential (Redoxspannung) - Redoxpotential bestimmt chemische und biologische Prozesse in Gewässern Grundlagen: Ox + ne- Red (Fe 3+ + e- Fe 2+) NERNSTsche Gleichung: Vorlesung Wasseranalytik

Redoxpotential (Redoxspannung) Ø Potentialerniedrigung bei Erhöhung Konzentration reduzierter Spezies Ø Potentialerhöhung, je mehr oxidierte Stoffe vorhanden sind Ø bei a (Ox) = a (Red) ist Eredox = E 0 (Standardpotential) Ø in Wasserproben i. a. Vielzahl Redoxsysteme, Messung der Summe der Redoxpotentiale Ø Redoxsystem häufig unter Beteiligung von Protonen p. H-Abhängigkeit Ø temperaturabhängig (Temperatur immer angeben) Ø neben Einzelpotential der Messelektrode (Platin) auch Berücksichtigung Bezugselektrode (z. B. Kalomelektrode) Vorlesung Wasseranalytik

Redoxpotential (Redoxspannung) Praxis: - regelmäßig Messkette überprüfen (gesättigte Chinhydronlösung in Pufferlösung) - Größe des Redoxpotentials abhängig von: • p. H-Wert • Temperatur • Ionenaktivität • Beschaffenheit Elektrodenoberfläche - Störungen durch Beläge auf Platinelektrode (z. B. Manganoxidhydrat) - lange Einstellzeiten beim Wechsel von Lösungen mit verschiedenen Ionenaktivitäten - Redoxpotential: Anhaltspunkt für aerobe/anaerobe Prozesse: • < -200 m. V: strikt anaerob • -200 bis 0 m. V: Übergangscharakter • positive Werte: aerobe Vorgänge Vorlesung Wasseranalytik

Voltametrie Voltammetrie - Polarographie ØUnter dem Begriff Voltammetrie (Volt-ampero-metrie) versteht man die messtechnische Aufnahme von Strom-Spannungs-Kurven. Gemäß IUPAC Definition beinhaltet der Begriff Voltammetrie das Arbeiten mit stationären oder festen Arbeitselektroden. ØErfolgt die Aufnahme der Strom-Spannungs-Kurven dagegen mit flüssigen Arbeitselektroden, deren Oberfläche periodisch oder kontinuierlich erneuert wird, so bezeichnet man diese Messmethode als Polarographie. ØEines der Hauptanwendungsgebiete polarographischer und voltammetrischer Verfahren besteht in der Spuren- und Ultraspuren-Bestimmung von Metallen in den verschiedensten Umweltkompartimenten, in Getränken und Lebensmitteln. Vorlesung Wasseranalytik

Voltametrie Messanordnung PC GE Vorlesung Wasseranalytik AE RE

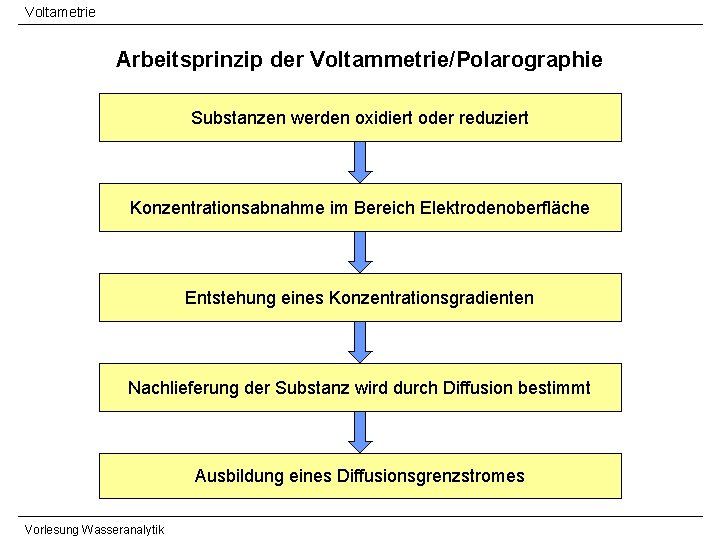
Voltametrie Arbeitsprinzip der Voltammetrie/Polarographie Substanzen werden oxidiert oder reduziert Konzentrationsabnahme im Bereich Elektrodenoberfläche Entstehung eines Konzentrationsgradienten Nachlieferung der Substanz wird durch Diffusion bestimmt Ausbildung eines Diffusionsgrenzstromes Vorlesung Wasseranalytik

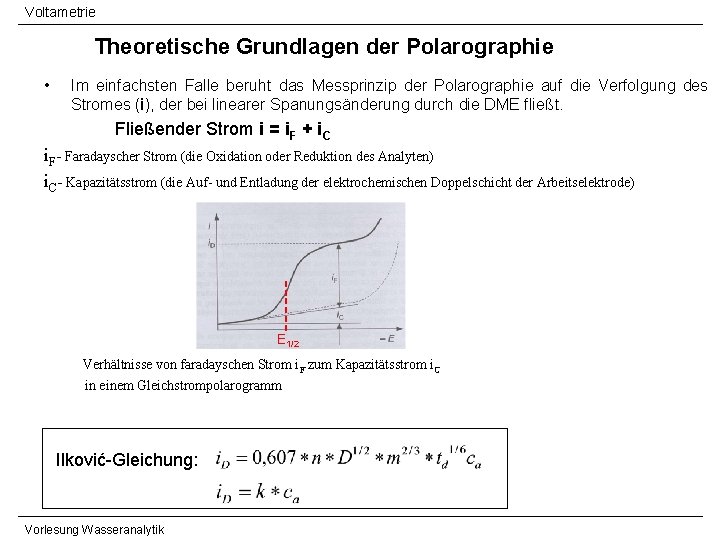
Voltametrie Theoretische Grundlagen der Polarographie • Im einfachsten Falle beruht das Messprinzip der Polarographie auf die Verfolgung des Stromes (i), der bei linearer Spanungsänderung durch die DME fließt. Fließender Strom i = i. F + i. C i. F- Faradayscher Strom (die Oxidation oder Reduktion des Analyten) i. C- Kapazitätsstrom (die Auf- und Entladung der elektrochemischen Doppelschicht der Arbeitselektrode) E 1/2 Verhältnisse von faradayschen Strom i. F zum Kapazitätsstrom i. C in einem Gleichstrompolarogramm Ilković-Gleichung: Vorlesung Wasseranalytik

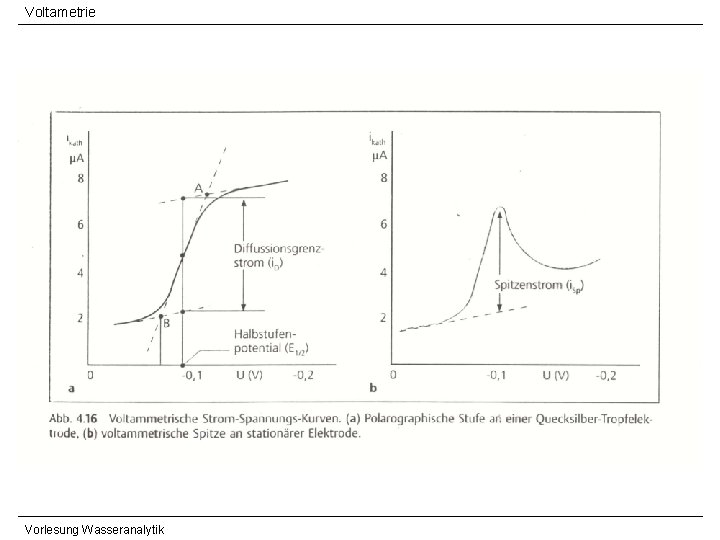
Voltametrie Vorlesung Wasseranalytik

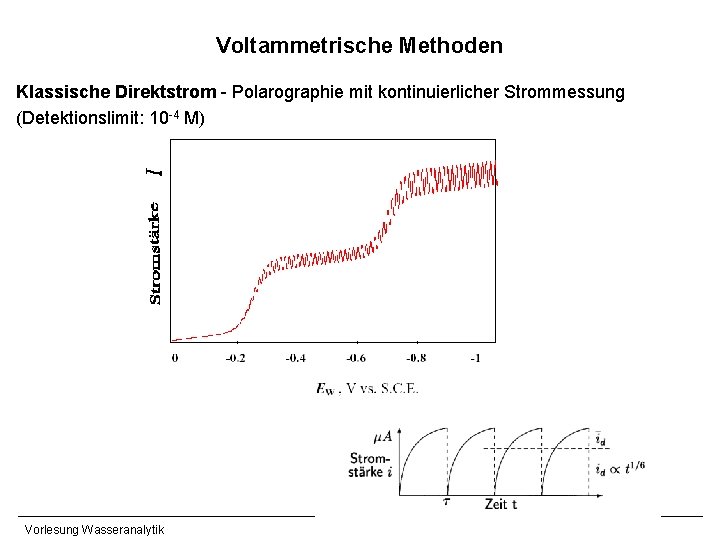
Voltammetrische Methoden Klassische Direktstrom - Polarographie mit kontinuierlicher Strommessung (Detektionslimit: 10 -4 M) Vorlesung Wasseranalytik

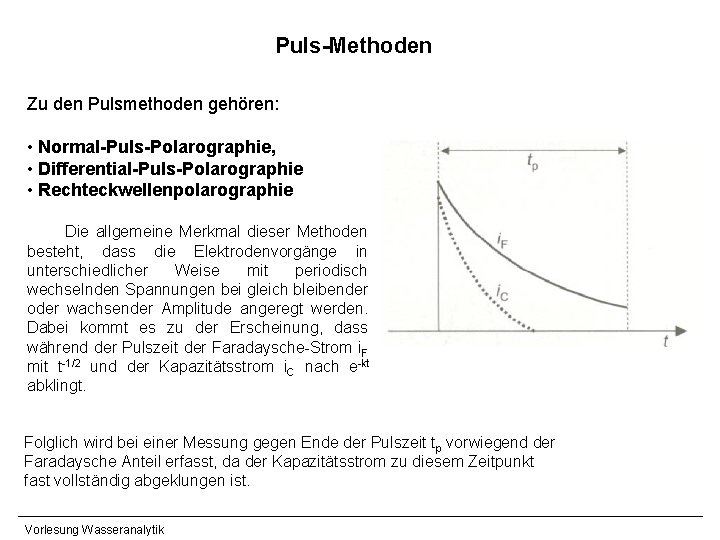
Puls-Methoden Zu den Pulsmethoden gehören: • Normal-Puls-Polarographie, • Differential-Puls-Polarographie • Rechteckwellenpolarographie Die allgemeine Merkmal dieser Methoden besteht, dass die Elektrodenvorgänge in unterschiedlicher Weise mit periodisch wechselnden Spannungen bei gleich bleibender oder wachsender Amplitude angeregt werden. Dabei kommt es zu der Erscheinung, dass während der Pulszeit der Faradaysche-Strom i. F mit t-1/2 und der Kapazitätsstrom i. C nach e-kt abklingt. Folglich wird bei einer Messung gegen Ende der Pulszeit tp vorwiegend der Faradaysche Anteil erfasst, da der Kapazitätsstrom zu diesem Zeitpunkt fast vollständig abgeklungen ist. Vorlesung Wasseranalytik

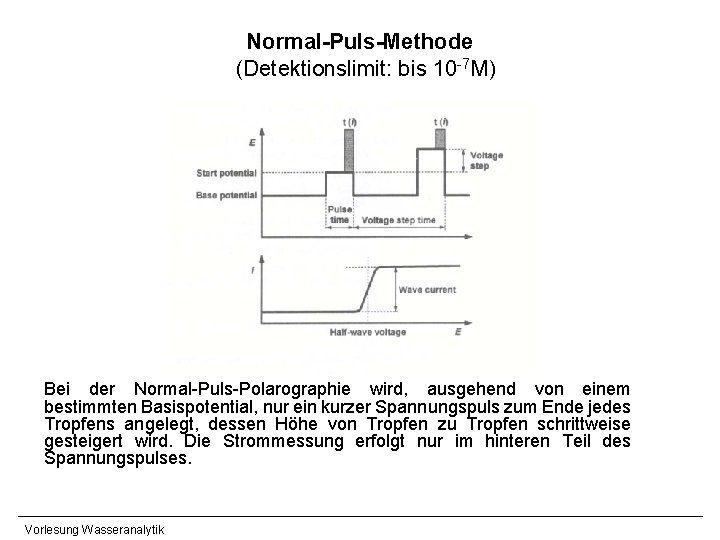
Normal-Puls-Methode (Detektionslimit: bis 10 -7 M) Bei der Normal-Puls-Polarographie wird, ausgehend von einem bestimmten Basispotential, nur ein kurzer Spannungspuls zum Ende jedes Tropfens angelegt, dessen Höhe von Tropfen zu Tropfen schrittweise gesteigert wird. Die Strommessung erfolgt nur im hinteren Teil des Spannungspulses. Vorlesung Wasseranalytik

Differential-Puls-Methode (Detektionslimit: bis zu 10 -8 M) Das Anregungssignal besteht aus einer treppenförmig anwachsenden Gleichspannung, auf die in periodischer Folge kleine Rechteckpulse von gleich bleibender Spannung gesetzt werden. Vorlesung Wasseranalytik

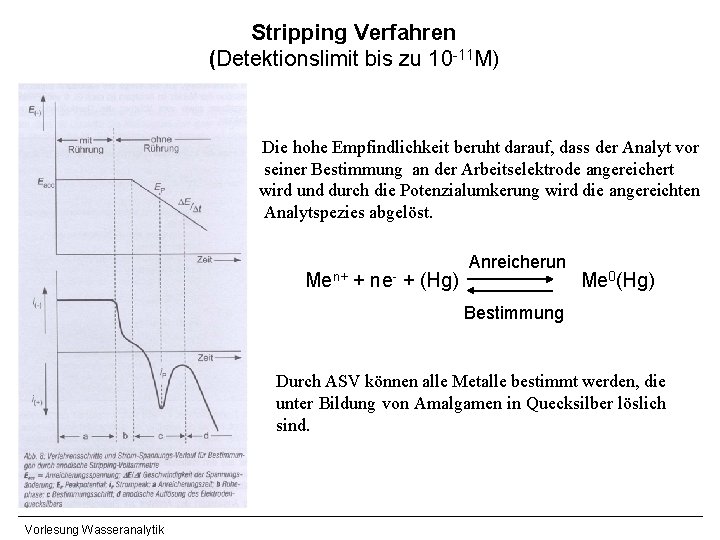
Stripping Verfahren (Detektionslimit bis zu 10 -11 M) Die hohe Empfindlichkeit beruht darauf, dass der Analyt vor seiner Bestimmung an der Arbeitselektrode angereichert wird und durch die Potenzialumkerung wird die angereichten Analytspezies abgelöst. Men+ + ne- + (Hg) Anreicherun Me 0(Hg) Bestimmung Durch ASV können alle Metalle bestimmt werden, die unter Bildung von Amalgamen in Quecksilber löslich sind. Vorlesung Wasseranalytik

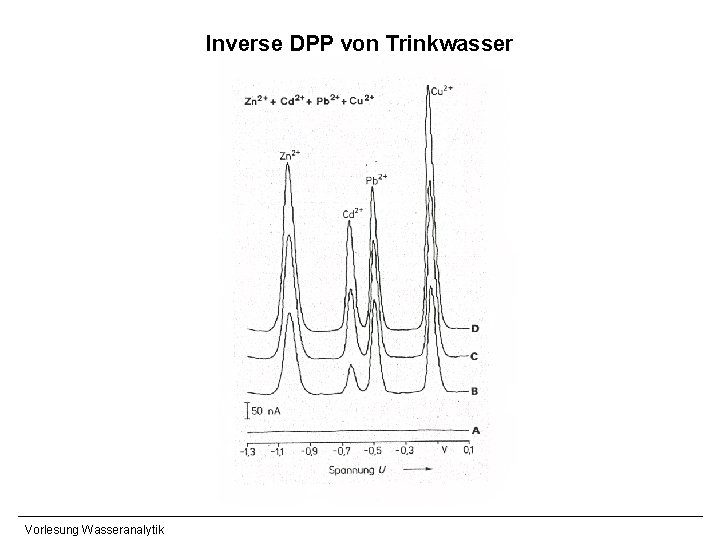
Inverse DPP von Trinkwasser Vorlesung Wasseranalytik

Voltametrie Anwendung der Voltammetrie in der Wasseranalytik DIN 38406 Teil 16: Bestimmung von 7 Metallen (Zink, Kupfer, Thallium, Blei, Cadmium, Nickel Cobalt) mittels Voltammetrie Ø VOLTAMMETRIE: - Aufnahme von Strom-Spannungskurven an polarisierten Arbeitselektroden (Messung der Stromstärke bei zeitlich veränderter Spannung) Ø POLAROGRAPHIE: - Vorlesung Wasseranalytik spezielle Methode mit einer flüssigen, tropfenden (d. h. sich verändernden) Quecksilberelektrode als Arbeitselektrode, Oberfläche erneuert sich ständig – damit frei von störenden Substanzen

Voltametrie Anwendung der Voltametrie/Polarographie in der Wasseranalytik Ø qualitative Aussagen: - Art der Substanz ist durch das Halbstufenpotential charakterisiert, Steuerung über Zusammensetzung des Grundelektrolyten (Puffer, Zusätze) Ø quantitative Aussagen: - Diffusionsgrenzstrom ist konzentrationsabhängig (Höhe der Stufe) - Messung von Peakhöhen nach Integration der Stufen, Kalibrierung notwendig Ø Invers-Voltametrie: (Detektionslimit bis zu 10 -11 M) - Vorlesung Wasseranalytik Möglichkeit zur Anreicherung, zunächst Abscheidung der Metalle an Hg-Elektrode als Amalgame, anschließend Auflösung durch Potentialumkehr und Messung

Voltametrie Typical Detection Limits (1 ppt = 1 part per trillion = 1 ng/kg) Sb(III), Sb(V) 200 ppt Arsenic As(III), As(V) 100 ppt Bismuth Bi 500 ppt Cadmium Cd 50 ppt Chromium Cr(III), Cr(VI) 25 ppt Cobalt Co 50 ppt Copper Cu 50 ppt Iron Fe(II), Fe(III) 50 ppt Lead Pb 50 ppt Mercury Hg 100 ppt Molybdenum Mo 50 ppt Nickel Ni 50 ppt Platinum Pt 0. 1 ppt Rhodium Rh 0. 1 ppt Thallium Tl 50 ppt Tungsten W 200 ppt Uranium U 25 ppt Zinc Zn 50 ppt Antimony Vorlesung Wasseranalytik

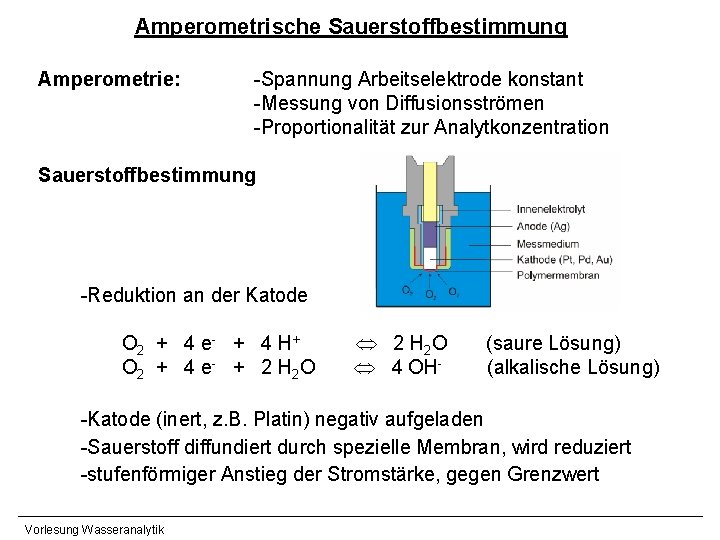
Amperometrische Sauerstoffbestimmung Amperometrie: -Spannung Arbeitselektrode konstant -Messung von Diffusionsströmen -Proportionalität zur Analytkonzentration Sauerstoffbestimmung -Reduktion an der Katode O 2 + 4 e - + 4 H + O 2 + 4 e - + 2 H 2 O 4 OH- (saure Lösung) (alkalische Lösung) -Katode (inert, z. B. Platin) negativ aufgeladen -Sauerstoff diffundiert durch spezielle Membran, wird reduziert -stufenförmiger Anstieg der Stromstärke, gegen Grenzwert Vorlesung Wasseranalytik

-Diffusionsgrenzstrom proportional zur Konzentration IGR = n F A Pm ______ L c (O 2) IGR n A L Pm Diffusionsgrenzstrom Anzahl der Ladungsträger Elektrodenoberfläche Dicke der elektrochem. Doppelschicht Permeabilitätskoeffizient - Membran (z. B. Teflon) verhindert andere Redoxreaktionen - Anströmgeschwindigkeit mind. 0, 25 m/s Vorlesung Wasseranalytik

Amperometrische Bestimmung von freiem Chlor Vorlesung Wasseranalytik

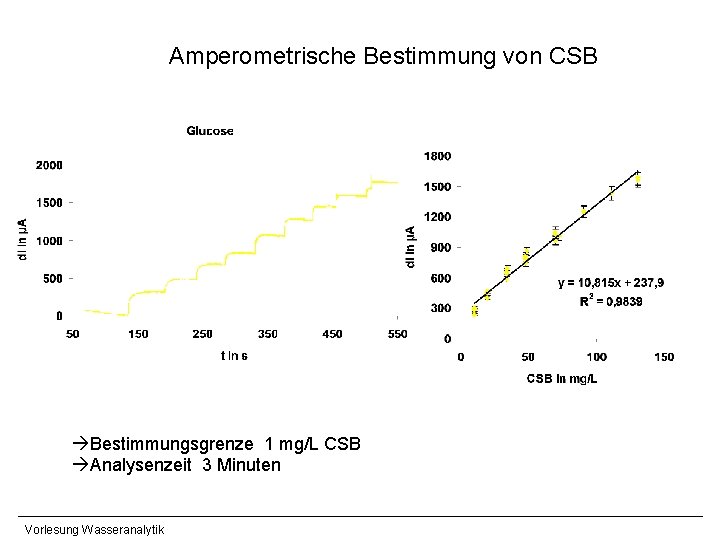
Amperometrische Bestimmung von CSB Bestimmungsgrenze 1 mg/L CSB Analysenzeit 3 Minuten Vorlesung Wasseranalytik
 Adobe analytics klassifizierung
Adobe analytics klassifizierung Gewaltpyramide
Gewaltpyramide Kennzeichen des lebens
Kennzeichen des lebens Elektrodenreaktion
Elektrodenreaktion Ohne dass ohne zu beispiel
Ohne dass ohne zu beispiel Neun punkte mit vier strichen verbinden
Neun punkte mit vier strichen verbinden Diwasserstoffdioxid
Diwasserstoffdioxid Unterschied regelstrecke mit ohne ausgleich
Unterschied regelstrecke mit ohne ausgleich Methoden zur stressreduktion
Methoden zur stressreduktion Deduktive methode sport
Deduktive methode sport Methoden en technieken van onderzoek
Methoden en technieken van onderzoek Differenzierung im chemieunterricht
Differenzierung im chemieunterricht Visgraat diagram
Visgraat diagram Trendanalyse vorgehensweise
Trendanalyse vorgehensweise Vergleichsmethode einzelhandel
Vergleichsmethode einzelhandel Methoden kunstunterricht
Methoden kunstunterricht Delphi methode risikomanagement
Delphi methode risikomanagement Delphi methode projektmanagement
Delphi methode projektmanagement Methoden der prozessmodellierung
Methoden der prozessmodellierung Mittelwert fehlerbehafteter größen
Mittelwert fehlerbehafteter größen Zeitmanagement-methoden hausarbeit
Zeitmanagement-methoden hausarbeit Codeersysteem
Codeersysteem Fragebogen schwachstellenanalyse
Fragebogen schwachstellenanalyse Didaktische netze kahlert
Didaktische netze kahlert Heterogenität im unterricht methoden
Heterogenität im unterricht methoden Kennisoverdracht methoden
Kennisoverdracht methoden Introduction to uml ppt
Introduction to uml ppt Die kommunikative methode
Die kommunikative methode Kwantitatieve gegevens
Kwantitatieve gegevens Methoden terminplanung
Methoden terminplanung Sätze mit indem
Sätze mit indem Urlaubplanung
Urlaubplanung Ohne mich könnt ihr nichts tun
Ohne mich könnt ihr nichts tun Bis durch für gegen ohne um entlang
Bis durch für gegen ohne um entlang Präterminalphase dauer
Präterminalphase dauer Kapitalwert nießbrauch
Kapitalwert nießbrauch Leben ohne sonne
Leben ohne sonne Ohne zu statt zu um zu
Ohne zu statt zu um zu Stipendium ohne gute noten
Stipendium ohne gute noten Draußen vor der tür steht ein junge ohne schuhe im schnee
Draußen vor der tür steht ein junge ohne schuhe im schnee 1-jährige ausbildung altenpflegehelferin ohne abschluss
1-jährige ausbildung altenpflegehelferin ohne abschluss Lasten heben kran
Lasten heben kran Das i dativ
Das i dativ Stipendium ohne gute noten
Stipendium ohne gute noten